谷胱甘肽调节水稻幼苗根系生长的分子机制
2019-08-13崔桂彩付童童孙川惠
崔桂彩 付童童 孙川惠

摘要:拟用中花11水稻(Oryza sativa L.)分析谷胱甘肽(glutathione,简称GSH)及其合成抑制剂丁硫氨酸-亚砜亚胺(buthionine sulfoximine,简称BSO)处理对水稻幼苗根系生长及生长素和细胞周期基因表达的影响。结果表明,在处理后5~9 d时,GSH促进了水稻根系,特别是侧根的形成和生长,而BSO则显著抑制了根系的生长。对用GSH、BSO处理6 d时的DR5-GUS[GUS(β-glucuronidase)是β-葡萄糖苷酸酶]轉基因水稻(以中花11号为背景)分析发现,GSH加快了生长素在根系的梯度分布,而BSO则延缓了生长素的梯度分布,引起生长素在初生根根尖的过度积累。从分子水平分析显示,GSH、BSO处理后6 d时,水稻幼苗根系中分别有23个生长素基因(如OsYUCCA7、OsPIN1c、OsARF1和OsIAA7等)和19个细胞周期基因(如Oryza;CycA3;1、Oryza;CycD4;2、Oryza;CDKC;2和Oryza;KRP;1等)的表达有明显差异。以上试验结果表明,GSH是调节水稻幼苗根系生长的重要信号分子,它可能通过影响这些生长素和细胞周期基因的表达及生长素的分布而参与水稻根系生长的调节。
关键词:谷胱甘肽;生长素基因;水稻根系;细胞周期基因
中图分类号: S511.01 文献标志码: A 文章编号:1002-1302(2019)02-0069-04
谷胱甘肽(glutathione,简称GSH)是植物细胞内的主要抗氧化剂和信号分子之一,在植物的生长发育和抗逆过程中有重要的调节作用[1]。研究表明,GSH可以促进番茄再生根的形成,但是会抑制其伸长生长,此外,GSH合成抑制剂丁硫氨酸-亚砜亚胺(buthionine sulfoximine,简称BSO)也会抑制再生根的伸长生长,而对再生根的数量没有明显影响[2]。进一步的研究发现,在培养基中添加生长素会明显提高再生根中的GSH水平,从而抑制根的生长,说明在器官形成过程中生长素和GSH之间存在一定的联系。BSO阻滞拟南芥初生根的生长,抑制其生长素运输基因PIN1、PIN2、PIN7的表达和生长素在根尖的积累[1],但是对不定根的PIN1表达无影响。Cheng等的报道表明,增加GSH含量,会提高拟南芥对干旱和高盐等逆境的抗性,激活生长素合成基因(如YUC2)的表达,调节细胞分裂相关基因的表达[3]。在拟南芥阻断根生长突变体rootmeristemless1中,GSH的合成强烈减少,该突变体的表型与BSO引起的生长阻滞类似[4]。GSH是维持拟南芥根分生组织细胞分裂必需的信号分子,添加外源谷胱甘肽会促进细胞分裂,相反,添加BSO会抑制细胞分裂[5]。在植物细胞早期分裂过程中,GSH和DNA共存于细胞核内,从G1期到S期,GSH对维持核内氧化还原状态平衡和基因表达起着重要的调节作用[6]。GSH调节拟南芥细胞周期相关基因如RCK和SAP的表达[3]。这些研究表明,GSH在对植物生长发育的调节与生长素和细胞分裂之间有密切关系。本试验旨在通过分析GSH和BSO对水稻幼苗根系生长、生长素分布及生长素和细胞周期基因表达的影响,探讨GSH调节水稻幼苗根系生长的机制。
1 材料与方法
1.1 材料与处理
采用中花11号水稻(Oryza sativa L.)种子(由山东理工大学植物逆境实验室保存),去壳后依次用75%乙醇(处理30 s)、0.1%氯化汞(处理15 min)、2%次氯酸钠(处理20 min)消毒,再用灭菌水冲洗干净。将种子分别植入含有 5 mmol/L GSH与 0.1 mmol/L 谷胱甘肽合成抑制剂BSO的MS培养基上,于 光—暗周期为14 h—10 h、光照度为 200 μmol/(m2·s)、昼—夜温度周期为26 ℃—20 ℃、相对湿度约为50%~60%的培养箱内培养,培养3~9 d后进行数据统计与分析。每个处理独立重复3次,每次设3个平行处理。
1.2 根系生长指标的统计
根系生长指标的统计包括所有根(初生根、不定根和侧根)的数量和长度,每个独立重复至少统计20株,统计数据用每株的平均值来表示。
1.3 根系生长素分布的测定
将DR5-GUS转基因水稻(以水稻中花11号为背景)种子灭菌消毒后,分别植入含有5 mmol/L GSH和0.1 mnol/L BSO的MS培养基上,在上述同样条件下培养6 d,然后进行GUS(β-glucuronidase,即β-葡萄糖苷酸酶)活性测定,分析根系生长素的分布和积累变化[7]。每个处理至少设20株。
1.4 根系生长素和细胞周期基因转录活性的分析
将中花11号水稻种子消毒后,分别植入含有5 mmol/L GSH和0.1 mmol/L BSO的MS培养基上培养6 d(培养条件同“1.1”节),用TRIzol试剂提取总RNA,取1 μg RNA,用TaKaRa公司的RNA PCR Kit(AMV)Ver.3.0反转录为cDNA。所有处理用等量cDNA进行PCR反应,以Osactin1基因作内标,采用Gel-Pro Analyzer软件对基因转录活性进行半定量分析。将对照的转录活性设置为1,基因表达水平≥1.3为上调,≤0.7为下调。每种处理的PCR反应在相同条件下独立重复3次。
1.5 数据处理
试验数据用SPSS软件进行统计分析,数据用平均值±标准误差表示,用单因素方差分析不同处理之间的差异,P<0.05 表示差异显著。
1.6 试验时间和地点
本研究所有试验均于2015年9月至2017年3月进行,在山东理工大学生命科学学院植物分子生物学等相关实验室完成。
2 结果与分析
2.1 GSH、BSO对水稻幼苗根系生长的影响
2.1.1 GSH、BSO对水稻幼苗初生根长度及其侧根数量和长度的影响 与对照组相比,水稻幼苗在处理后5~9 d期间,BSO显著抑制了初生根的伸长生长,而GSH则促进了其生长(图1-A)。如试验后7 d时,BSO处理的初生根长度比对照降低了49.7%(P<0.01),试验后5 d时,GSH处理的初生根长度比对照增加了37.6%(P<0.01)。由图1-B可见,GSH处理7~9 d时,初生根上侧根的数量比对照显著增加;相反,在相同的时间内,BSO处理的初生根上的側根数量明显比对照的少。如试验后9 d时,GSH处理的初生根上的侧根数量比对照增加了32.6%(P<0.01),而BSO处理的初生根上的侧根数量比对照减少了52.5%(P<0.01)。与对照相比,BSO极显著抑制了初生根上侧根的伸长生长(P<0.01),GSH则在一定程度上促进了其生长(图1-C)。
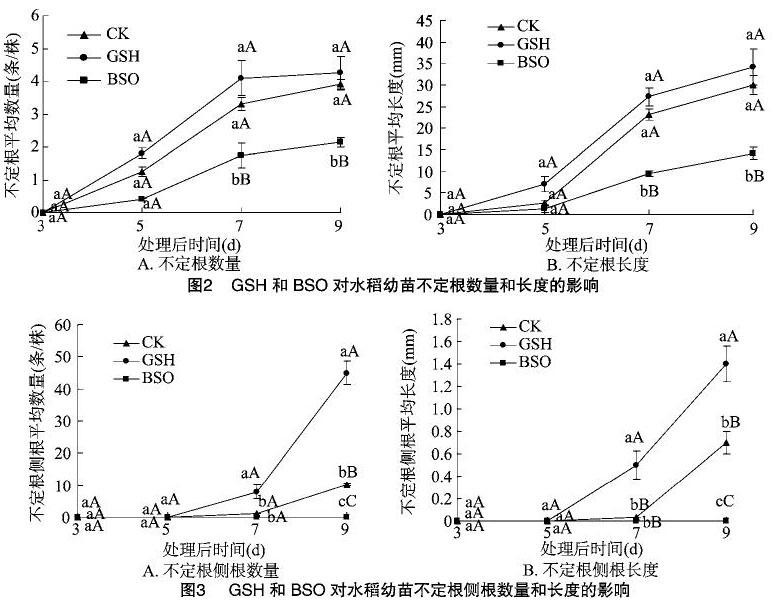
2.1.2 GSH、BSO对水稻幼苗不定根数量和长度的影响 由图2可以看出,在试验后3~9 d期间,水稻幼苗不定根的数量(图2-A)和长度(图2-B)有与图1类似的变化趋势,其中BSO处理的不定根数量和长度明显不及对照。试验后9 d时,BSO处理的不定根的数量、长度分别比对照减少了52.5%、52.6%,且与其他处理差异极显著(P<0.01),但是GSH处理的不定根数量和长度与对照之间差异不显著。
2.1.3 GSH、BSO对水稻幼苗不定根上侧根数量和长度的影响 用GSH处理7~9 d时,水稻幼苗不定根上的侧根数量(图3-A)、长度(图3-B)都比对照的显著增加。可见GSH加快了不定根上侧根的形成和生长。如GSH处理9 d时,不定根上侧根的数量比对照的增加了3.4倍(P<0.01)。相反,在整个试验期间BSO处理完全抑制了水稻幼苗不定根上侧根的形成(P<0.01)。
2.2 GSH、BSO对水稻幼苗根系生长素积累和分布的影响
生长素的积累和梯度分布对水稻幼苗根系的生长和发育有重要的调节作用。为进一步了解 GSH、BSO处理对水稻根系生长的影响与生长素积累和分布之间的关系,本试验用DR5-GUS转基因水稻分析了GSH、BSO处理6 d的根系生长素变化。由图4可见,与对照组相比,GSH加快了生长素在整个根系的梯度分布,减少了生长素在初生根根尖的过度积累,促进了侧根的形成和发育。相反,BSO则延迟了生长素的梯度分布,引起生长素在根尖的过量积累,阻滞了侧根的形成。
2.3 GSH、BSO对水稻幼苗根系生长素基因表达的影响
生长素在根系的积累和分布与生长素信号途径上关键基因家族OsYUCCAs(生长素合成)、OsPINs(生长素极性运输)和OsARFs/OsIAAs(生长素应答)基因的表达有关。本试验比较分析了GSH、BSO处理6 d的水稻幼苗根系中62个生长素基因表达的变化。结果显示,与对照相比,GSH、BSO处理引起表达变化的基因有23个(图5),其中GSH处理后表达上调的基因有6个,分别是OsYUCCA7、OsPIN1c、OsPIN10b、OsARF7、OsARF8、OsARF25;BSO处理后表达上调的基因有15个,包括OsYUCCA3、OsYUCCA6、OsYUCCA7、OsPIN1a、OsARF1、OsARF2、OsARF6、OsARF19、OsARF21、OsIAA7、OsIAA17、OsIAA21、OsIAA23、OsIAA24和OsIAA27,表达下调的基因有6个,包括OsPIN1c、OsARF7、OsARF8、OsARF15、OsARF17和OsIAA19。以上结果表明,GSH、BSO处理对根系生长素积累和分布的影响可能与生长素基因的差异表达有密切关系。
2.4 GSH、BSO对水稻幼苗根系细胞周期基因表达的影响
细胞周期调控是控制水稻根系生长发育的重要因素之一。为进一步分析GSH、BSO处理对根系生长的影响与细胞周期之间的关系,本试验检测了GSH、BSO处理6 d的水稻幼苗根系中56个细胞周期核心基因表达的变化情况。由图6可见,与对照相比,GSH、BSO处理后有19个基因的表达发生了明显变化,其中GSH激活表达的基因有6个,分别是Oryza;CycA2;1、Oryza;CycA3;1、Oryza;CycB2;1、Oryza;CycL1;1、Oryza;CDKC;2和Oryza;RB;1,抑制表达的基因也有6个,包括Orysa;CycB1;1、Oryza;CycD2;2、Oryza;CycD4;1、Oryza;CycD4;2、Oryza;CycD6;1和Oryza;CDKC;3。BSO上调表达的基因有4个,分别是Oryza;CycA3;2、Oryza;CycD6;1、Oryza;KRP;1和Oryza;RB;1,下调表达的基因有13个,包括Oryza;CycA2;1、Oryza;CycA3;1、Orysa;CycB1;1、Oryza;CycB1;2、Oryza;CycB2;1、Oryza;CycD2;2、Oryza;CycD7;1、Oryza;CycL1;1、Oryza;CDKA;1、Oryza;CDKB;2、Oryza;CDKC;2、Oryza;CDKC;3和Oryza;CDKF;3。值得注意的是,本试验中的BSO抑制了Oryza;CycA2;1等多数细胞周期进程中的正调控基因的表达,而促进了负调控基因Oryza;KRP;1、Oryza;RB;1的表达,因此BSO对水稻幼苗根系,特别是侧根的形成和发育的抑制作用与其阻滞细胞分裂有很大关系。
3 讨论
有研究表明,在根系形成过程中,生长素和GSH之间存在一定联系,适量的GSH有利于根系的生长,而GSH含量过高或过低都会抑制根的生长[2],BSO会抑制拟南芥初生根的生长[1]。本试验得到类似的结果,即GSH促进了水稻幼苗特别是侧根的形成和发育,而BSO则显著抑制了初生根、不定根和侧根的生长。Koprivova等研究发现,BSO抑制生长素运输基因PIN1、PIN2和PIN7的表达和生长素在根尖的积累[1]。Cheng等报道,外源GSH激活了生长素合成基因(如YUC2)的表达[3]。本试验结果也表明,GSH、BSO对生长素信号途径上某些关键基因(如OsYUCCA7、OsPIN1c、OsARF1和OsIAA7等)的表达调节存在明显差异,它们可能通过调节这些基因的表达来影响生长素在根系的梯度分布,进而调控根系的生长和发育。细胞周期是调控植物生长发育的关键因素之一。GSH是维持拟南芥根分生组织细胞分裂必需的信号分子。添加外源GSH可促进细胞分裂,调节拟南芥细胞周期相关基因如(RCK和SAP)的表达[3]。相反,添加BSO会抑制细胞分裂[5]。在本试验中,在GSH、BSO处理条件下有19个细胞周期基因(如Oryza;CycA3;1、Oryza;CycD4;2、Oryza;CDKC;2和Oryza;KRP;1等)的表达差异显著。特别值得注意的是,BSO抑制了多数细胞周期正调控基因如Oryza;CycA3;1的表达,而激活了负调控基因如Oryza;KRP;1的表达,推测BSO对根系生长的抑制作用可能与其延缓细胞分裂进程有密切关系。本试验结果表明,GSH是调节水稻幼苗根系生长的重要信号分子,它可能通过影响生长素和细胞周期基因表达及生长素分布而参与水稻根系生长的调节。
參考文献:
[1]Koprivova A,Mugford S T,Kopriva S. Arabidopsis root growth dependence on glutathione is linked to auxin transport[J]. Plant Cell Rep,2010,29:1157-1167.
[2]Tyburski J,Tretyn A. Glutathione and glutathione disulfide affect adventitious root formation and growth in tomato seedling cuttings[J]. Acta Physiol Plant,2010,32(2):411-417.
[3]Cheng M C,Ko K,Chang W L,et al. Increased glutathione contributes to stress tolerance and global translational changes in Arabidopsis[J]. The Plant Journal,2015,83(5):926-939.
[4]Reichheld J P,Khafif M,Riondet C,et al. Inactivation of thioredoxin reductases reveals a complex interplay between thioredoxin and glutathione pathways in Arabidopsis development[J]. The Plant Cell,2007,19(6):1851-1865.
[5]Sánchez-Fernández R,Fricker M,Corben L B,et al. Cell proliferation and hair tip growth in the Arabidopsis root are under mechanistically different forms of redox control[J]. Proc Natl Acad Sci USA,1997,94(6):2745-2750.
[6]Diaz V P,Wolff T,Markovic J,et al. A nuclear glutathione cycle within the cell cycle[J]. Biochem J,2010,431(2):169-178.
[7]Petersson S V,Johansson A I,Kowalczyk M,et al. An auxin gradient and maximum in the Arabidopsis root apex shown by high-resolution cell-specific analysis of IAA distribution and synthesis[J]. Plant Cell,2009,21(6):1659-1668.
