长链非编码RNA SNHG11对人肝癌细胞放疗抵抗作用的影响
2019-08-13戎晓东陈炫光蔡维洵陈国章
戎晓东, 陈炫光, 蔡维洵, 陈国章
中山大学肿瘤防治中心、华南肿瘤学国家重点实验室放疗科(广东广州 510630)
原发性肝细胞癌(hepatocelluar carcinoma)简称肝癌,是我国常见的恶性肿瘤之一,其发病率位于我国恶性肿瘤发病率的第3位,病死率位于我国肿瘤相关死亡率的第2位[1-2]。世界范围内每年约有70万新发肝癌病例,其中我国占世界肝癌发病人数一半左右,近年来肝癌发病率更是有逐渐升高的趋势。肝癌具有起病隐匿、恶性程度高、进展迅速的特点,早期常无明显症状,导致约80%肝癌患者被确诊时已处于中晚期,从而丧失了手术机会[1-2]。由此可见,肝癌严重威胁我国人民健康和生命。近年来,随着放射治疗技术的发展,立体定向放疗已经被证明在可手术或不可手术切除的肝癌患者中效果良好,可极大提高肝癌患者预后[3-6]。但在临床实践中有些肝癌患者存在着对射线并不敏感的现象,导致放疗效果不佳[7-10]。然而,关于导致肝癌细胞放射抵抗的机制研究较少,因此,进一步研究肝癌细胞放射抵抗的作用机制,靶定关键分子,具有重要的临床意义。SNHG11,属于长链非编码RNA,定位于染色质20q11.23,目前其功能尚不明确,2018年1月至2019年2月,我们通过分析SNHG11对肝癌细胞放疗抵抗的生物学作用及对γH2AX表达水平的影响,为深入了解肝癌细胞放射治疗抵抗提供更多理论依据。
1 材料与方法
1.1 细胞 肝癌细胞株SK-Hep1和SMMC-7721均购自中科院上海细胞库。
1.2 主要试剂 c-caspase3一抗、总caspase3一抗、γH2AX一抗均购自美国Cell Signalling Technology(CST)公司,GAPDH一抗、β-actin一抗、HSP70一抗均购自北京锐抗,兔二抗、鼠二抗购自中山金桥;DMEM培养基、RPMI 1640培养基、胎牛血清购自美国Gibco。
1.3 细胞培养 SK-Hep1细胞使用含有10%南美胎牛血清的DMEM培养基,SMMC-7721细胞使用含有10%南美胎牛血清的RPMI 1640培养基在37℃、5%CO2条件下培养。
1.4 慢病毒表达载体的构建及感染 计算感染病毒体积=(MOI×细胞数量)÷病毒滴度,将SK-Hep1细胞以每孔5×105个细胞接种到6孔板中培养,待细胞贴壁24 h后,1 mL细胞培养基中加入适量sh-con和sh-SNHG11慢病毒悬液,加至6孔板中培养8~10 h,再加入1 mL细胞培养基培养2~3 d。按照同样的方法向SMMC-7721细胞中转染Control和SNHG11的慢病毒,提取细胞总RNA,用qRT-PCR检测细胞中SNHG11的表达水平,建立稳定过表达和敲低SNHG11的细胞株模型。
1.5 RNA提取 将转染了敲低或过表达SNHG11慢病毒48 h的SK-Hep1和SMMC-7721细胞株接种至6 cm皿中,即SNHG11、Control、sh-SNHG11、sh-con共4组,待细胞长至80%可进行RNA的提取。培养好的细胞去除培养基,用PBS缓冲液洗涤2遍,加入1 mL总RNA提取试剂Trizol(购自Invitrogen公司),用移液枪反复吹吸以充分裂解细胞。待裂解液由黏稠变为清稀后将液体吸入1.5 mL离心管中,冰上静置5 min。向离心管中加入200 μL氯仿,剧烈振荡后离心15 min,液体分为3层,将含有RNA的上层水相到新的1.5 mL去酶离心管中,加入0.5 mL异丙醇,上下颠倒,充分混匀,离心10 min,去除上清,用75%乙醇(DEPC水配置)洗涤沉淀,去除上清后晾干,用DEPC水溶解RNA沉淀并测量浓度。
1.6 实时定量PCR RNA逆转录按PrimeScirpt逆转录试剂盒(TaKaRa)说明书操作,定量PCR用SYBR Green PCR Mater Mix,定量PCR仪为Roche lightCycler 4800。逆转录反应条件为37℃孵育60 min,85℃孵育5 min终止反应。PCR反应条件为95℃10 min预变性,95℃10 s变性,60℃退火20 s,72℃延伸10 s,共40个循环。检测完成后,计算机系统自动分析个样本Ct值,采用2-ΔΔCt计算基因的相对表达量。使用的引物序列如下:SNHG11-F:5′-GGTGCTGTGTACCTCCTCC-3′,SNHG11-R:5′-CAGATCAGGGTGCTGCAGG-3′。
1.7 Western blot 将构建好的过表达或敲低SNHG11细胞株接种至6孔板中(分别为SNHG11、Control、sh-SNHG11、sh-con 4组),待细胞贴壁以后进行4 Gy照射,每组均收取未照射及照射后2、4、6 h的蛋白,进行Western blot。首先用胰酶消化收集细胞,用PBS缓冲液洗涤3遍,加入适量RIPA裂解液裂解蛋白,振荡、离心,去除沉淀,取上清,用BCA试剂盒测定蛋白浓度,加入适量蛋白上样缓冲液,用沸水煮5~10 min,-80℃保存。蛋白电泳按照等质量30 μg上样,经12% SDS-PAGE凝胶电泳后电转至硝酸纤维素膜上,用含有5%脱脂奶粉的TBST缓冲液封闭1 h,一抗孵育、二抗孵育后,进行ECL法暗室发光显像,用Image J软件测量条带灰度值并进行统计。
1.8 细胞照射 肝癌细胞放射处理方法为:6 MV X射线进行室温垂直照射,剂量率为200 cGy/min,照射野为15 cm×15 cm,源皮距为100 cm。克隆形成实验照射方法为,对慢病毒稳定表达的细胞进行放射,所使用剂量为0、2、4、6、8 Gy。Western blot检测蛋白表达水平使用的剂量为4 Gy。
1.9 克隆形成实验 将Control和过表达SNHG11的SMMC-7721细胞,以及转染sh-con和sh-SNHG11的SK-Hep1细胞种植到培养板中,在孵箱中培养24 h后进行放射。种植细胞的数量和照射剂量都为梯度,分别是0 Gy种400个细胞,2 Gy种800个细胞,4 Gy种1 600个细胞,6 Gy种3 200个细胞,8 Gy种6 400个细胞。将照射后的细胞置于37℃,5%CO2的孵箱进行培养,向培基中按照1∶100的比例加入青链霉素混合液,每5 d换1次液。连续培养14 d后去除培基,以PBS缓冲液洗涤细胞2次,用甲醇固定1 h,1%结晶紫染色1 h,清水漂洗干净。计数>50个细胞的集落数目,计算:贴壁率(PE)=对照组集落形成数÷种植细胞数×100%;存活率(SF)=(实验组集落形成数÷细胞种植数)÷贴壁率。用单击多靶模型拟合细胞存活曲线,计算放射生物学参数。实验重复3次。将稳定表达Control和SNHG11的SMMC-7721细胞、sh-con和sh-SNHG11的SK-Hep1细胞株按照梯度细胞密度进行铺板培养,剂量梯度照射,然后计算克隆形成率,按照公式y=1-[1-exp(-kx)]N拟合细胞存活曲线并计算放射生物学参数[11-12]。
1.10 统计学方法 采用SPSS 23.0统计软件,进行单因素方差分析及LSD-t检验,以P≤0.05为差异有统计学意义。
2 结果
2.1 构建敲低和过表达SNHG11细胞模型 我们在几株肝癌细胞中检测SNHG11的表达水平,最终确定SNHG11表达水平较高的SMMC-7721细胞构建稳定敲低细胞株,表达水平低的SK-Hep1细胞构建过表达细胞株。我们在SK-Hep1细胞中转染sh-con和sh-SNHG11,在SMMC-7721细胞中转染Control和SNHG11慢病毒质粒后,Control、SNHG11、sh-con与sh-SNHG11组SNHG11的mRNA表达量分别为1.00±0.00、93.68±3.80、1.39±0.14和0.26±0.05。见图1。

*与Control比较P<0.05;△与sh-con比较P<0.05图1 qRT-PCR检测SNHG11的mRNA表达量
2.2 放疗敏感性 过表达SNHG11后细胞放射生物学参数N、Do、Dq、SF2分别为对照组(Control)的1.14、2.15、2.20、1.21倍,而敲低SNHG11(sh-SNHG11组)后N、Do、Dq、SF2分别为对照组(sh-con)的0.78、0.16、0.41、0.55倍,过表达SNHG11导致细胞放疗抵抗,而敲低SNHG11后细胞放疗敏感性增加。见图2和表1。
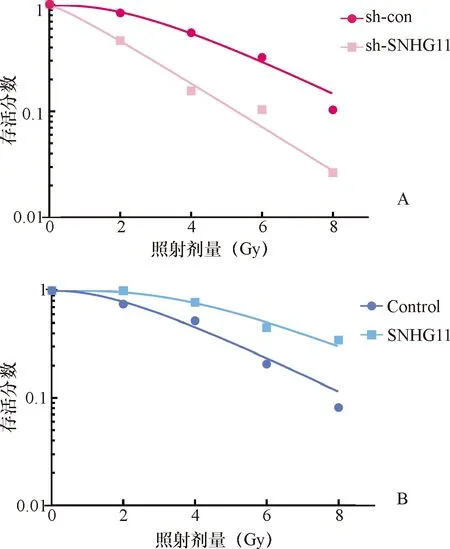
A:sh-con与sh-SNHG11;B:Control与SNHG11图2 单击多靶模型拟合细胞存活曲线
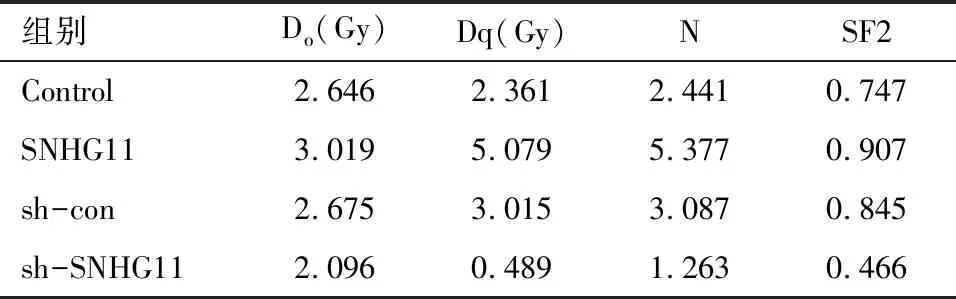
表1 单击多靶模型参数值
2.3 DNA损伤相关蛋白检测 在4 Gy放疗情况下,过表达SNHG11后γH2AX表达水平较Control组低,而敲低SNHG11后表达水平随时间增加。见图3、表2。
2.4 放疗情况下细胞凋亡相关蛋白检测 放疗可以增加细胞中凋亡蛋白c-caspase3的表达,而过表达SNHG11能部分逆转c-caspase3的表达上调,敲低SNHG11可以进一步促进凋亡蛋白表达。见图4、表3。
3 讨论
研究表明放疗在肝癌中发挥越来越重要的作用,其中SBRT可以使小肝癌2年局部控制率达到85%以上,在局部晚期肝癌患者中2年局部控制率达到接近40%~60%[5-6],但是仍然有部分肝癌患者因放射抵抗导致肿瘤控制不佳进而预后较差。因此寻找肝癌放射抵抗的分子机制,对提高肝癌患者在放疗局部控制率方面有着非常重要的意义。
在本研究中,我们使用单击多靶模型拟合细胞存活曲线,从而计算放射生物学参数N、Do、Dq、SF2、k。
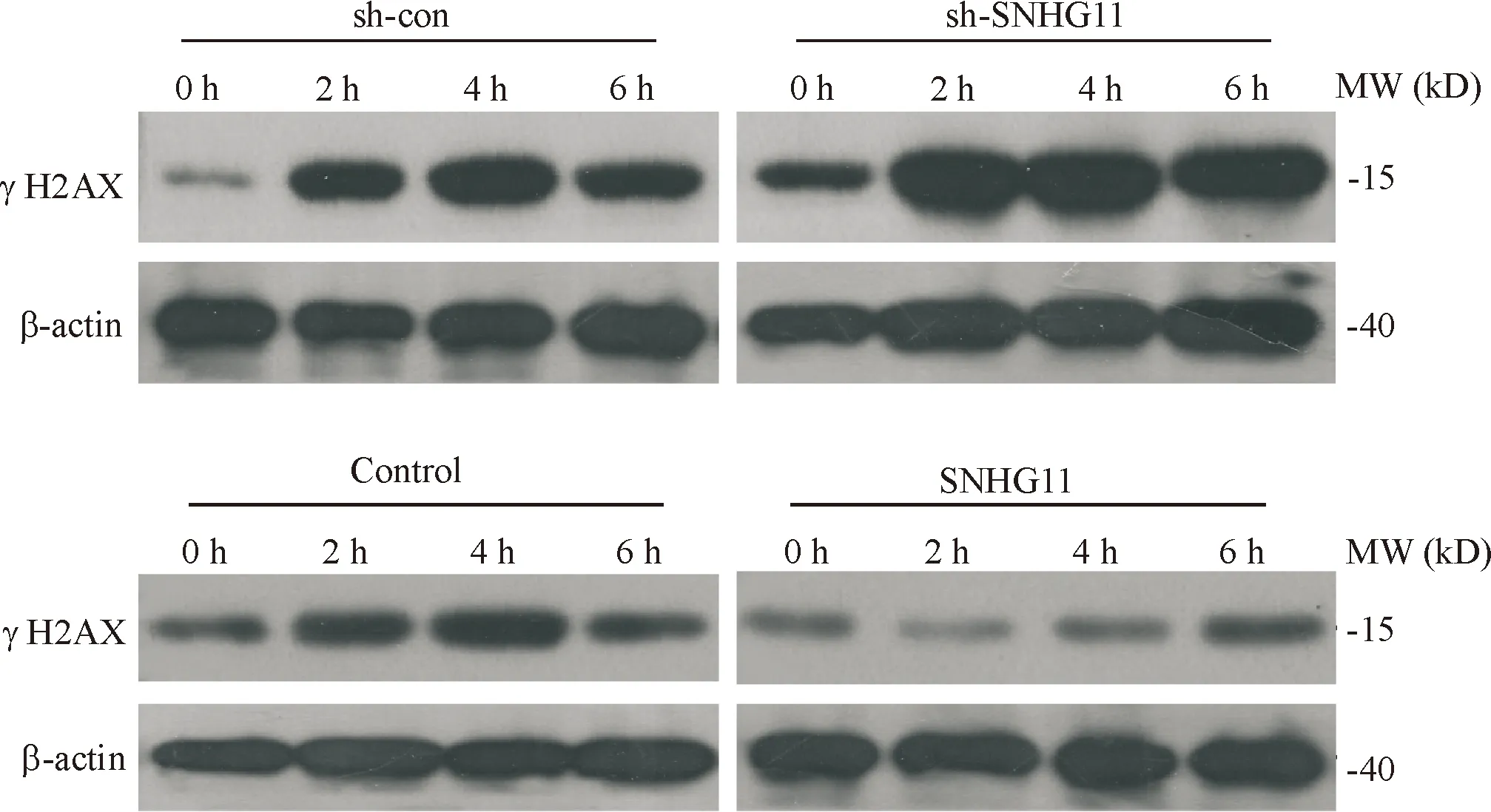
图3 Western blot检测DNA损伤修复蛋白在4 Gy照射下随时间的表达变化表2 不同处理组γH2AX的表达水平
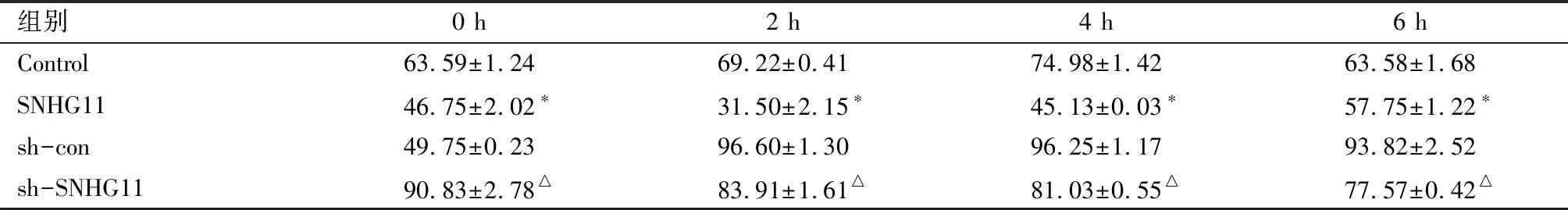
组别0 h2 h4 h6 hControl63.59±1.2469.22±0.4174.98±1.4263.58±1.68SNHG1146.75±2.02∗31.50±2.15∗45.13±0.03∗57.75±1.22∗sh-con49.75±0.2396.60±1.3096.25±1.1793.82±2.52sh-SNHG1190.83±2.78△83.91±1.61△81.03±0.55△77.57±0.42△
*与Control比较P<0.05;△与sh-con比较P<0.05
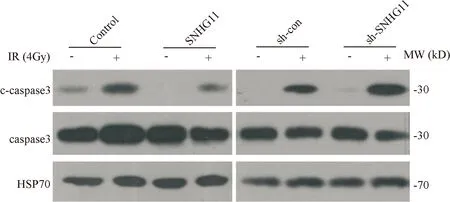
图4 Western blot检测c-caspase3、总caspase3的表达

表3 不同处理组c-caspase、caspase的表达水平
*与Control+IR比较P<0.05;△与sh-con+IR比较P<0.05
这些衡量放射敏感性的参数能够较真实全面地反映细胞放射生物学特性,已被广泛应用于细胞放射敏感性的分析。这些参数分别从不同角度反映细胞放射敏感性,N值反映细胞对放射引起损伤的修复能力(k=1/N),Dq是细胞受损所需要的阈量,Do为曲线指数区下降63%所需要的剂量,SF2是2 Gy时的细胞存活分数,这些指标数值越大,代表放射抵抗性增强[11-13]。通过计算放射生物学参数,我们认为SNHG11可以促进肝癌细胞放疗抵抗。
肿瘤细胞放射抵抗的产生是多基因、多因子、多步骤及多重机制共同作用的结果。肿瘤细胞受到射线照射后,造成DNA双链断裂,激活DNA损伤修复信号通路,从而促进肿瘤细胞的存活,因此肿瘤中DNA损伤修复通路的过度激活可以促进肿瘤细胞在射线照射下的存活,也就是说,DNA损伤修复增强是肿瘤细胞放射抵抗的重要原因[14-15]。我们发现SNHG11高表达的肝癌细胞对射线抵抗,提示lncRNA在肿瘤细胞放射抵抗中发挥重要的作用,可能是由于SNHG11的高表达使得DNA损伤修复通路激活增强。H2AX为染色体组蛋白H2A家族的成员之一,在各种理化因素的刺激下,细胞DNA双链断裂,H2AX被磷酸化成为γH2AX。γH2AX作为一种生物标志物,能够清楚反映DNA损伤修复和修复的情况[16-18]。γH2AX是DNA损伤修复通路中的重要分子,是DNA损伤重要的标志,其表达升高提示DNA损伤加重,出现时间快提示DNA损伤出现早,消退时间快提示DNA损伤修复加快。本研究我们发现在肝癌细胞中过表达SNHG11,射线诱导的γH2AX表达降低,提示SNHG11降低了射线诱导的DNA损伤,并加快了DNA损伤修复过程,提示SNHG11可能是通过增强射线引起的DNA损伤修复增加,进而增加肝癌细胞的放射抵抗。
放疗能够导致DNA双链断裂,启动细胞对DNA的修复机制,而无法被修复的损伤将引起细胞凋亡[19-21]。射线可以通过增加肿瘤细胞的凋亡达到控制肿瘤细胞增殖的目的,因此我们猜想SNHG11导致肿瘤细胞放射抵抗可能与细胞凋亡相关。细胞内蛋白酶的级联活化是凋亡的一个重要标志,这些蛋白酶中主要是caspase。在凋亡发生时,caspase能够被剪切成活化状态,如c-caspase3[22-23]。在本研究中,我们发现SNHG11过表达的肝癌细胞射线诱导的c-caspase3表达减少,而SNHG11沉默表达的肝癌细胞射线诱导的c-caspase3增加,而总的caspase水平没有明显变化,提示SNHG11可以抑制射线诱导的肝癌细胞的凋亡。
已有大量的研究表明lncRNA在肝癌增殖、侵袭转移、代谢等方面发挥重要作用[24-25],例如lncRNA-UFC1可以通过激活β-catenin促进肝癌细胞的增殖[26],SNHG6可以通过发挥内源性ceRNA的作用促进肝癌细胞的增殖、侵袭转移等[27]。而对于lncRNA影响肿瘤细胞放射敏感性的研究较少,并且大多数是对宫颈癌、鼻咽癌、胶质瘤等癌种,例如lncRNA-GAS5 能够通过调控miR-106b/IER3信号轴来增强宫颈癌细胞放射敏感性[28];lncRNA ANCR通过抑制PTEN的表达促进鼻咽癌细胞的放疗抵抗性[29]。然而,对于lncRNA在肝癌放射抵抗中的作用却鲜有报道,而我们的研究对于证明lncRNA参与肝癌细胞对射线抵抗提供了强有力的证据,但是SNHG11如何调控肝癌细胞DNA损伤修复通路,其中的具体机制仍需进一步探讨。
