沉默Akt减少乳腺癌MCF-7/ADM细胞对阿霉素的耐药性*
2019-08-13王玲蔡岳华焦荣华贺百花阳宁
王玲, 蔡岳华, 焦荣华, 贺百花, 阳宁
1湖南环境生物职业技术学院医药技术学院(湖南衡阳 421001); 2南华大学附属第二医院泌尿外科(湖南衡阳 421001)
乳腺癌是一种乳腺上皮组织恶性肿瘤,发病率高,对女性身心健康危害大。化疗是乳腺癌治疗的主要手段,但易产生耐药性,从而降低药物的疗效,甚至导致治疗失败[1-2]。因此,深入阐明乳腺癌耐药性的产生机制,并从中寻找关键性的靶点,对逆转耐药性及提高临床疗效具有重要的意义。Akt又称为蛋白激酶B,被磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase, PI3K)激活后,可促进肿瘤细胞增殖、侵袭、转移及耐药性的产生[3-6]。近年研究表明,Akt失调与乳腺癌发生发展密切相关,被认为是肿瘤预后不良的一个独立预测因子[7-8]。阿霉素(adriamycin, ADM)是乳腺癌化疗的常用药物,但Akt在乳腺癌ADM化疗耐药中的作用尚待研究。2017年6月至2018年5月,本研究首先观察Akt在人乳腺癌细胞ADM敏感株(MCF-7/S)和耐药株(MCF-7/ADM)中的表达和活性,然后用小干扰RNA(small interfering RNA, siRNA)技术沉默MCF-7/ADM细胞中Akt表达,探讨其对ADM耐药性的影响及分子机制,从而为抑制乳腺癌细胞多药耐药提供一个新的靶点。
1 材料与方法
1.1 细胞、药物与主要试剂 MCF-7/S和MCF-7/ADM细胞由中山大学肿瘤医院提供,来源于美国国立癌症研究所。ADM为深圳万乐药业有限公司产品。新生胎牛血清以及DMEM培养基购于Gibco公司提供。Akt小干扰RNA(small interfering RNA, siRNA)和阴性对照 siRNA由上海吉玛公司合成。LipofectamineTM2000和PVDF膜购于美国Invitrogen公司。兔抗人Akt、磷酸化Akt(phosphorylated Akt, p-Akt)、Bcl-2、Bax、P-gp及β-actin单克隆抗体购自美国Santa Cruz 公司。RIPA蛋白裂解液和辣根过氧化物酶标记的山羊抗兔IgG购于上海碧云天生物技术有限公司提供。Annexiv-FITC/碘化丙啶(propidium iodide, PI)双染细胞凋亡检测试剂盒由贝博生物提供。四甲基偶氮唑蓝(MTT)和二甲基亚砜购自美国 Sigma公司。
1.2 细胞培养 MCF-7/S、MCF-7/ADM细胞复苏后接种于含10%新生胎牛血清、100 U/mL的青霉素、100 μg/mL链霉素的DMEM培养基中,静置于37℃、5%CO2、100%湿度的培养箱内培养,隔天换液1次,待细胞生长至80%~90%融合度时,以0.25%的胰蛋白酶进行消化,并进行传代培养,当培养细胞达到一定数量,且呈现对数生长时待用。
1.3 细胞转染 取上述呈对数生长的MCF-7/S、MCF-7/ADM细胞,接种于96孔板中(1×106/孔),每个培养孔加入0.18 mL DMEM培养液,孵育24 h后进行转染实验。分为3组:空白对照组、阴性对照siRNA组和Akt siRNA组,利用lipofectamineTM2000转染试剂盒,分别予培养液、阴性对照siRNA(20 nmol/L)、Akt siRNA(20 nmol/L)处理细胞48 h。Akt siRNA核苷酸序列为 5′-CCUGGGUAA-AAGAAGUCAATT-3′(正义链)和5′-UUGACUUCUUUGACCCAGGTT-3′(反义链);阴性对照siRNA核苷酸为5′-UUCUCCGAACGUGUCACGU-3′(正义链)和5′-ACGUGACACGUUCGGAGAA-3′(反义链)。
1.4 Western blot 收集处理完毕后的MCF-7/S、MCF-7/ADM细胞,用RIPA蛋白裂解液提取细胞中总蛋白质,BCA法进行蛋白定量,上样、电泳并转膜,加入兔抗人一抗,其中Akt、p-Akt、Bcl-2、Bax、P-gp抗体的稀释浓度为1∶500,β-actin抗体的稀释浓度为1∶2 500,4℃孵育过夜,洗涤后加入辣根过氧化物酶标记的山羊抗兔IgG(1∶2 500)二抗,在37℃条件下孵育1 h,ECL(广州永诺生物科技有限公司)显色,暗室曝光。利用Labwork凝胶图像分析系统对所有胶片进行扫描,以β-actin为内参,计算目的蛋白相对表达水平。
1.5 MTT比色法检测MCF-7/S、MCF-7/ADM细胞对ADM的敏感性 取对数生长期的MCF-7/S、MCF-7/ADM细胞,接种于96孔板中(1×106/孔),分别予培养液、Akt siRNA(20 nmol/L)处理48 h,然后分别加入不同浓度的ADM(0.5、1、2、4、8、16 μmol/L),培养24 h后每孔加入20 μL MTT溶液(0.5 g/L),培养4 h,小心吸去培养液,并添加150 μL二甲基亚砜,置入摇床,低速振荡10 min,以二甲基亚砜调零,利用Bio-Tek808酶标仪(美国 Bio-Rad公司)测定570 nm波长下每孔的吸光度(A)值,据此计算ADM的半数抑制浓度(half maximal inhibitory concentration, IC50)和耐药倍数,其中耐药倍数=MCF-7/ADM细胞IC50/MCF-7/S细胞IC50。
1.6 流式细胞术检测MCF-7/ADM细胞凋亡 收集MCF-7/ADM细胞,用PBS洗涤2次,以1 000 r/min离心10 min,弃上清,调整细胞浓度至1×106·mL-1,加5 μL Annexiv-FITC至终浓度为1 g/L,37℃避光温浴30 min,然后加PI至终浓度为5 μg/mL,用350目尼龙网滤膜过滤以去除细胞团块,4℃避光染色30 min后,上流式细胞仪检测,激发光波长用488 nm,用一波长为515 nm的通带滤器检测FITC荧光,另一波长>560 nm的滤器检测PI。总凋亡率=右上象限(Q2)凋亡率+右下象限(Q4)凋亡率。
2 结果
2.1 MCF-7/ADM细胞Akt活性增加 整体Akt水平无明显变化(P>0.05),但MCF-7/ADM细胞p-Akt水平明显高于MCF-7/S细胞,差异有统计学意义(P<0.01),见图1、表1。
2.2 Akt siRNA转染效率检测 相对于空白对照组,阴性对照siRNA组Akt水平无变化(P>0.05),而Akt siRNA组Akt水平显著降低(P<0.01)。见图2、3和表2。
2.3 沉默Akt增强MCF-7/ADM细胞对ADM化疗的敏感性 用ADM处理后,MCF-7/S、MCF-7/ADM细胞的IC50分别为(0.36±0.06)、(3.54±3.27) μmol/L,耐药倍数为65.39倍,而Akt siRNA和ADM共处理的MCF-7/S、MCF-7/ADM细胞,IC50分别为(0.28±0.05)、(2.17±0.29)μmol/L,耐药倍数下降至7.75倍。
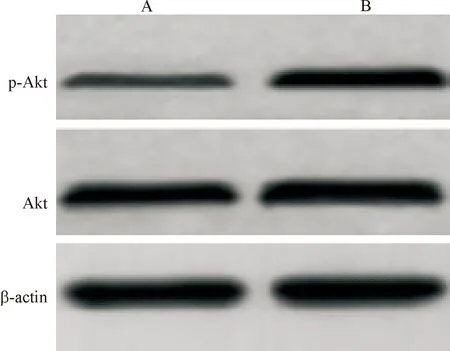
A: MCF-7/S细胞; B: MCF-7/ADM细胞
图1Westernblot检测MCF-7/S、MCF-7/ADM细胞Akt和p-Akt表达

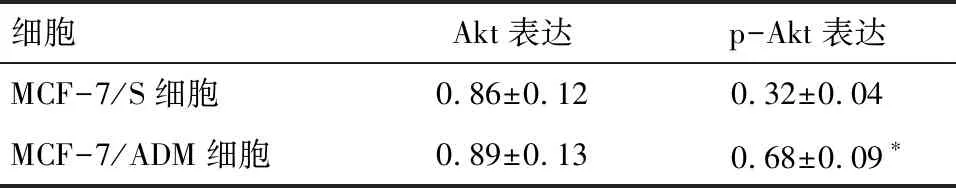
细胞Akt表达p-Akt表达MCF-7/S细胞0.86±0.120.32±0.04MCF-7/ADM细胞0.89±0.13 0.68±0.09∗
*与MCF-7/S细胞比较P<0.01
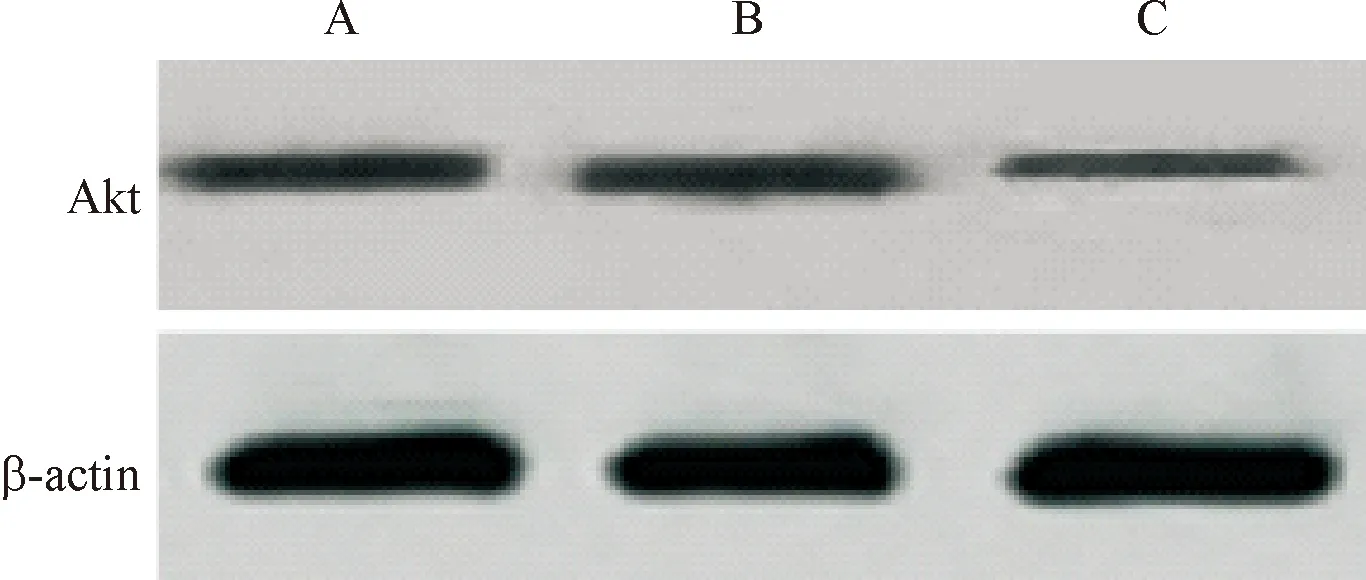
A: 空白对照组; B: 阴性对照siRNA组; C: Akt siRNA组图2 Western blot检测MCF-7/S细胞Akt表达

A: 空白对照组; B: 阴性对照siRNA组; C: Akt siRNA组
图3Westernblot检测MCF-7/ADM细胞Akt表达

表2 各组MCF-7/S、MCF-7/ADM细胞Akt表达水平比较
*与空白对照组比较P<0.01
2.4 沉默Akt 促进MCF-7/ADM细胞凋亡 Akt siRNA组凋亡率较空白对照组增加(P<0.01),而阴性对照siRNA组凋亡率与空白对照组比较,差异无统计学意义(P>0.05),见图4、表3。
2.5 沉默Akt对MCF-7/ADM细胞Bcl-2、Bax表达的影响 Akt siRNA转染MCF-7/ADM细胞下调Bcl-2表达,上调Bax表达,与空白对照组比较,差异均有统计学意义(P<0.01),但阴性对照siRNA转染不影响MCF-7/ADM细胞Bcl-2、Bax的表达(P>0.05)。见图5、表3。

A: 空白对照组; B: 阴性对照siRNA组; C: Akt siRNA组图4 流式细胞术检测MCF-7/ADM细胞凋亡
2.6 沉默Akt抑制MCF-7/ADM细胞P-gp表达 Western blot结果表明,Akt siRNA组MCF-7/ADM细胞P-gp表达水平较空白对照组降低(P<0.01),然而阴性对照siRNA转染对P-gp表达水平无影响(P>0.05)。见图6、表3。


组别凋亡率(%)Bcl-2表达Bax表达P-gp表达空白对照组16.28±3.140.76±0.150.27±0.04 0.84±0.19阴性对照siRNA组17.59±3.670.73±0.140.31±0.05 0.81±0.17Akt siRNA组 38.46±6.28∗ 0.38±0.07∗ 0.62±0.11∗0.43±0.09∗
*与空白对照组比较P<0.01
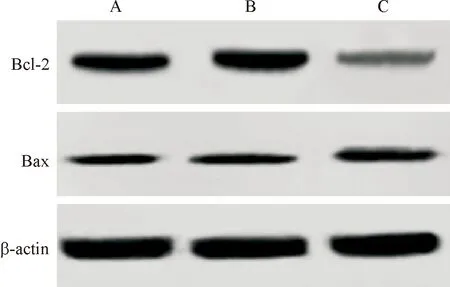
A: 空白对照组; B: 阴性对照siRNA组; C: Akt siRNA组图5 Western blot检测MCF-7/ADM细胞Bcl-2和Bax表达

A: 空白对照组; B: 阴性对照siRNA组; C: Akt siRNA组图6 Western blot检测MCF-7/ADM细胞P-gp表达
3 讨论
Akt是存在于人类染色体中的鼠类胸腺瘤病毒致癌基因的同源物,是一种癌基因,包含AH/PH结构域、催化结构域和尾部的调节结构域。PI3K通过磷酸化Akt促进其激活,参与调控细胞增殖、分化、凋亡、自噬等生物学过程,并与肿瘤细胞获得性耐药的出现密切相关[9-12]。本研究发现,MCF-7/ADM细胞p-Akt水平明显高于MCF-7/S细胞,提示Akt在耐药的乳腺癌细胞中呈活化状,而且用siRNA沉默Akt表达后,MCF-7/ADM细胞对ADM化疗敏感性明显增加,这些结果表明抑制Akt可能是减少乳腺癌耐药性的一个有价值的途径。
细胞凋亡即Ⅰ型程序性细胞死亡,指在多种基因调控下发生的细胞主动死亡过程,其中Bcl-2抑制凋亡过程,而Bax促进凋亡发生[13]。细胞凋亡不足是肿瘤化疗耐药性产生的一个重要原因。PI3K/Akt信号通路在调控肿瘤细胞凋亡中发挥重要作用[14-18]。Hu等[19]报道,姜黄素通过抑制Akt磷酸化促进乳腺癌细胞凋亡。蟾毒灵是中药蟾酥的活性成分之一,有广谱抗癌作用。研究发现,蟾毒灵通过抑制PI3K/Akt信号通路,使乳腺癌细胞凋亡率增加[20]。本研究中,Akt siRNA转染MCF-7/ADM细胞促进凋亡发生,并下调Bcl-2表达,上调Bax表达。因此,沉默Akt通过降低Bcl-2/Bax比值诱导MCF-7/ADM细胞凋亡,这可能是其减少乳腺癌耐药性的一个重要机制。
P-gp是一个170 kD的跨膜糖蛋白,具有ATP结合转运体的功能,可将肿瘤细胞内的化疗药物泵出细胞,从而降低细胞内药物浓度,产生耐药性[21-22]。已有研究表明,P-gp在40%的乳腺癌组织中呈高表达,提示P-gp过表达是引起乳腺癌患者发生多药耐药的重要原因[23]。本课题组前期研究发现,华蟾素通过下调MCF-7/ADM细胞P-gp表达,使细胞内ADM浓度升高,从而增强耐药肿瘤细胞对ADM的敏感性[24]。P-gp是PI3K/Akt信号通路的下游效应子。林思园等[25]用LY294002阻断PI3K/Akt信号通路,发现P-gp表达下调,MCF-7/ADM细胞对ADM敏感性明显增加。本研究中,Akt siRNA组MCF-7/ADM细胞P-gp表达水平显著低于空白对照组,提示抑制P-gp表达也是Akt沉默减少MCF-7/ADM细胞耐药性的重要原因。
综上所述,沉默Akt可能通过促进凋亡和下调P-gp表达部分逆转MCF-7/ADM细胞对ADM的耐药性。因此,抑制PI3K/Akt信号通路有望成为拮抗乳腺癌细胞多药耐药及提高化疗效果的新策略。
