流感病毒与肠道菌群的相互作用对感染结局的影响
2019-08-13刘雨琪朱俊萍何秋水
刘雨琪,朱俊萍※,何秋水,2※
(1.首都医科大学基础医学院病原生物学系,北京100069; 2.芬兰图尔库大学医学微生物学和免疫学系,西芬兰 图尔库 20520)
流感病毒是一种严重威胁全球人类健康的呼吸道病毒。1918年的“西班牙大流感”(H1N1)在1918—1919年不到两年的时间里蔓延全球,造成了数千万患者的死亡,其中青壮年人死亡为主要特征,流感病毒感染后继发的细菌性肺炎可能是造成死亡的主要原因[1]。而这一现象在H2N2“亚洲流感”(1957—1958年)和H3N2“香港流感”(1968—1969年)暴发中也有发现。一些呼吸道常见细菌,如肺炎球菌、溶血性链球菌、脑膜炎奈瑟菌、金黄色葡萄球菌以及流感嗜血杆菌等为“西班牙流感”中继发细菌性感染的主要成员[2]。流感大暴发通常呈周期性出现,而季节性流感则每年可致300万~500万重症患者,以及25万~50万的患者死亡[3]。新近研究数据发布,自1999—2015年,每年有291 243~645 832人死于流感病毒相关的呼吸道疾病[4]。在人群中引起高发病率和死亡率的主要是人类甲型流感病毒和乙型流感病毒,以在中老年人群以及存在免疫缺陷的患者中更为突出[5]。仅甲型流感病毒,平均每年可感染全球5%~10%的成年人以及20%~30%的儿童[6]。20世纪以来,中国也曾多次暴发全国范围的大型流感疫情,涉及甲型H1N1、H3N2、H7N9、乙型流感病毒等多种亚型,目前已形成多种亚型共同流行的趋势。探究流感病毒作用于机体免疫系统的机制以及牵涉抗病毒免疫应答的肠道菌群与流感病毒的相互作用对于流感防治新策略的制订和优化有重要意义。现就流感病毒与肠道菌群的相互作用对感染结局的影响进行综述。
1 流感病毒概述
流感病毒是一种有包膜的负链RNA病毒,为正黏病毒科成员,主要通过呼吸道传播。病毒感染呼吸道黏膜细胞,造成局部损伤,具有传染性强、发病率高、抗原变异快等特点[7-8]。流感病毒感染主要引起发热、咳嗽、咽炎、疲惫、肌肉痛等症状,患者常伴有肠道功能失调,病情严重者可能致死且儿童更容易发病[8]。流感之所以每年反复发生,取决于流感病毒独特的结构及分节段的RNA遗传物质的快速变异[9]。流感病毒RNA转录和复制过程相关的聚合酶蛋白亚基中发生的大量突变可导致病毒宿主范围扩大和病毒致病性的增强[10]。流感病毒一般不入血形成病毒血症,且本身对宿主细胞的致病效应不强,但其可影响机体免疫应答,引起不同类型淋巴细胞数量改变以及相应细胞因子的产生,导致全身反应和严重的免疫病理损伤[11-12]。黏膜免疫在流感病毒感染及抗感染过程中发挥重要作用。
2 肠道菌群及其对黏膜免疫的影响
肠道菌群是人类肠道中的正常微生物群,细菌总数可达100万亿,远远超过人体自身的细胞数量,而肠道菌群的总质量可达1.5 kg[13]。已经发现定植于肠道的细菌可达上千种[14],主要分属4个菌门:拟杆菌门、厚壁菌门、变形菌门和放线菌门,其中拟杆菌门和厚壁菌门为优势菌门[15-16]。根据肠道菌群与宿主的关系可分为共生菌、条件致病菌和致病菌3类。其中共生菌是与宿主存在共生关系的生理性细菌,条件致病菌只在机体免疫功能低下时有致病作用,病原菌会在肠道菌群失调时大量定植并引起疾病。肠道菌群在维持机体健康方面发挥重要作用,其可调节机体的免疫应答、竞争性抑制病原菌定植、诱导机体产生对共生菌的免疫耐受、维持肠道内环境的稳定并帮助免疫系统发育成熟,同时还可以分解及合成营养物质供机体吸收利用等[3,17]。研究发现,饮食、居住环境、抗生素使用、病毒感染等因素均可影响个体肠道菌群的组成[18-19]。
肠道菌群不仅能调节机体对肠道内病原体的免疫应答,还可影响肠道外其他部位发生的病毒感染[8]。细菌可通过自身结构成分或其代谢产物进入循环系统影响肠道外的环境,如革兰阴性菌的细胞壁成分脂多糖和细菌代谢产物短链脂肪酸对免疫系统的重要调节作用已被证明[18]。短链脂肪酸是肠细胞的能量来源之一,能激活黏蛋白,增强肠道黏膜屏障的完整性,影响肠道黏膜免疫系统的免疫调节作用[20]。短链脂肪酸也可激活炎症小体,上调白细胞介素(interleukin,IL)-1β和IL-10的表达。有研究表明嗜酸乳杆菌L-92、鼠李糖乳杆菌GG等益生菌会加强这种上调效应,增强机体的抗病毒能力及免疫保护作用[21-22]。此外,短链脂肪酸通过激活适应性免疫应答提高机体对病毒及其他病原体的清除能力,实现抗病毒免疫的正向调节[3,16]。可见,肠道菌群及其代谢产物在病毒感染和机体免疫调节中均发挥重要作用。肠道菌群还能通过模式识别受体调节参与炎症反应的基因表达以及抗菌肽的产生[23]。肠道菌群失调可改变不同淋巴细胞亚群的比例以及炎症细胞因子的分泌,诱导免疫负调节作用[24]。目前研究表明,肠道菌群与呼吸道病毒感染之间联系密切,且可通过“肠-肺轴”影响相关疾病的发生、发展[25]。在流感病毒感染的个体中,肠道菌群的改变能够影响宿主抗体反应和病毒特异性CD4+T细胞、CD8+T细胞的功能,还能通过适当激活炎症细胞因子分泌在呼吸道黏膜的免疫调节中发挥作用[26-27]。
3 流感病毒与肠道菌群的相互作用
3.1流感病毒感染对肠道菌群组成的影响 正常情况下,人体内的微生物与宿主处于相对稳定的动态平衡,但病毒感染等因素会破坏这种平衡[19]。临床研究发现,流感患者常伴有肠道功能紊乱与失调[27]。多项研究表明,在动物和人体中,流感病毒感染均能引起呼吸道和肠道菌群的改变,破坏宿主-微生物稳态[25,28-29]。甲型流感病毒通过感染人的呼吸道致病,而在自然水禽宿主中主要感染胃肠道,致病性小并且通过粪口传播。研究发现,流感病毒H1N1感染绿头鸭后泄殖腔菌群丰度下降,其中厚壁菌门数量减少,变形菌门与拟杆菌门的数量增加[28]。与对照组相比,感染H9N2的鸡泄殖腔菌群中变形菌门数量增多,而双歧杆菌丰度降低[29]。Bartley等[30]研究年龄、饮食等因素对流感病毒感染后所发生的菌群改变的影响,发现年龄对小鼠肠道菌群门类变化的影响不大,但流感病毒感染及饮食因素均对肠道菌群组成有明显。有研究发现,H1N1感染小鼠的粪便中菌群多样性显著改变,其中拟杆菌门与厚壁菌门的比例升高[18]。而流感病毒FM1株感染的小鼠肠道中,肠杆菌科、肠球菌等致病菌数量增加,乳杆菌、双歧杆菌等益生菌数量减少[31]。流感病毒PR8株感染的小鼠肠道中分节丝状菌数量减少,拟杆菌属总量基本不变[32],变形菌门数量增加,专性厌氧菌数量减少[30](表1)。总之,流感病毒感染小鼠后通常导致肠道菌群中肠杆菌数量增多,乳杆菌和分节丝状菌数量减少,且在流感病毒感染后,肺部CC趋化因子受体9(C-C chemokine receptor 9,CCR9)+CD4+T细胞可被募集至肠组织,CD4+T细胞产生γ干扰素,同时肠道菌群组成改变,黏膜免疫功能失调,其中大肠埃希菌的增加导致肠上皮细胞分泌IL-15水平增高,促进CD4+T细胞原位分化为Th17细胞,引起肠损伤[32,35]。
同时,Deriu等[36]研究发现,小鼠模型中流感病毒感染引起的肠道菌群失调会促进沙门菌的二次感染,而人患流感并发生高死亡率的主要危险因素之一是继发细菌性肺炎[37]。在甲型流感病毒感染的人群中,成人常伴发金黄色葡萄球菌混合感染,而儿童常出现肺炎球菌混合感染[38]。Loughran等[39]研究发现,甲型流感病毒感染可直接抑制人体对肺炎球菌的免疫应答。体外实验发现,流感病毒(H1N1和H2N3)和高温杀灭的肺炎球菌共孵育人外周血单个核细胞(peripheral blood mononuclear cells,PBMCs),相较单独的肺炎链球菌感染组PBMCs 分泌IL-23、IL-17、γ干扰素水平降低,IL-1β 和IL-10水平无明显变化,而H2N3组的PBMCs 分泌IL-6水平也下降。已知IL-17对肺炎球菌感染中病原的清除十分关键,而且证实IL-17应答下调部分原因是由流感病毒的血凝素成分导致。与健康人肠道菌群相比,H7N9感染者双歧杆菌/肠杆菌比值下降[3]。Qin等[40]分析了26例H7N9感染者的肠道菌群组成,发现无论是H7N9感染者还是未经感染者,肠道中都是拟杆菌门、厚壁菌门和变形菌门数量占优势,但与未感染人群相比,H7N9感染者中拟杆菌门数量下降,变形菌门数量增多;其中,感染者的双歧杆菌数量减少,沙门菌、大肠埃希菌和肠球菌数量增加。由此可见,H7N9感染者相较于未感染者肠道菌群组成不稳定,益生菌数量减少而致病菌数量增加。Yu等[41]体外分离培养流感病毒感染者(n=155)与健康人(n=145)的PBMCs,发现病毒刺激后感染者PBMCs分泌IL-22和IL-34水平增高。两种细胞因子均由Th17细胞分泌,但其分泌细胞分属不同亚类。该研究发现IL-34表达上调是由IL-22的上调所致,而IL-34则可反馈抑制IL-22的表达(表2)。已知IL-22的受体广泛分布于肺、肠等上皮组织细胞,研究发现芳香族化合物受体/IL-22/信号转导及转录激活因子信号通路可参与小鼠肠道共生菌产生的抗菌分子(包括溶菌酶、RC型凝集素RegⅢγ 和隐窝素5 mRNA等)产量的调节,从而影响肠黏膜屏障的功能[44-45]。

表1 动物实验中流感病毒感染引起的肠道菌群变化及相关免疫反应
IEL:上皮内淋巴细胞;LPL:固有层淋巴细胞;IEC:小肠黏膜上皮细胞;IL:白细胞介素;Th:辅助性T细胞;IFN-γ:γ干扰素;↑:数量增加/表达上调;↓:数量减少/表达下调;-:文献中无相关数据
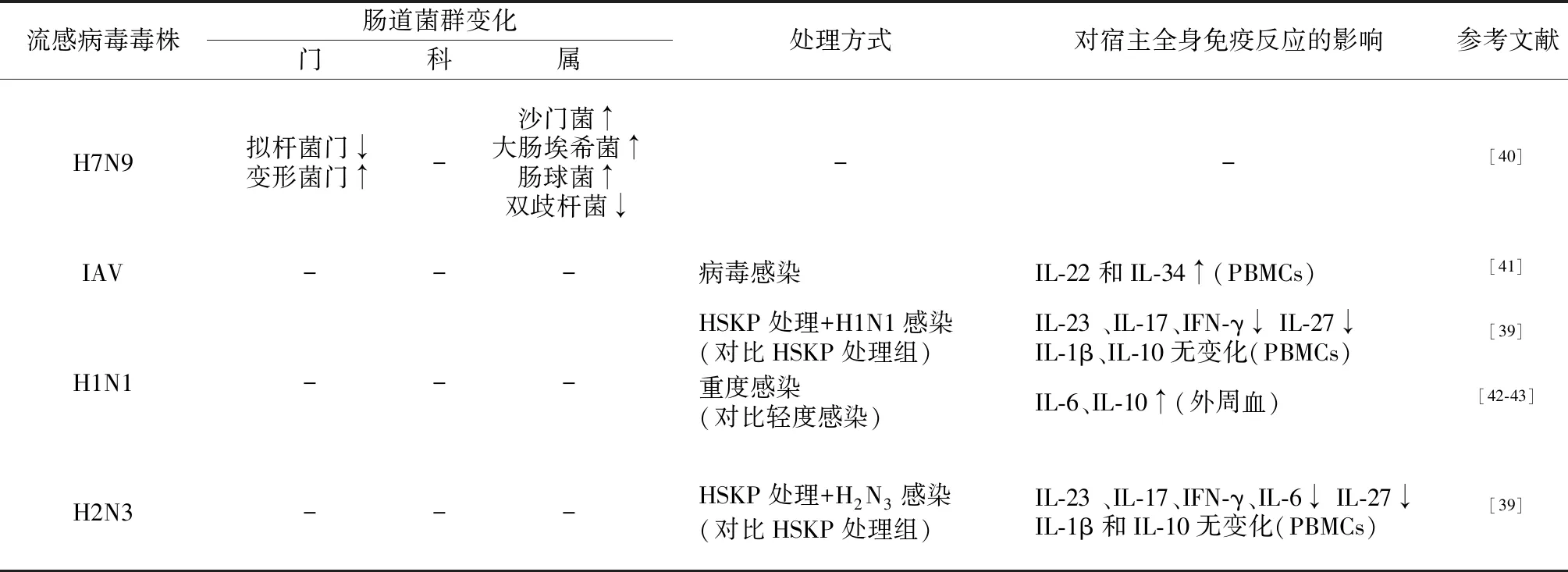
表2 流感病毒感染引起人的肠道菌群变化及相关免疫反应
IAV:甲型流感病毒;PBMCs: 外周血单个核细胞;HSKP:高温杀灭的肺炎球菌IL:白细胞介素;IFN-γ:γ干扰素;↑;数量增加/表达上调;↓:数量减少/表达下调;-:文献中无相关数据
3.2肠道菌群对流感病毒感染的影响 研究发现,只有当病毒感染小鼠呼吸道并出现肺部损伤时才会引起严重的肠道免疫损伤[32]。肠损伤的发生并非病毒直接感染肠道上皮细胞引起,而是由病毒感染呼吸道上皮细胞导致呼吸道黏膜淋巴细胞在趋化因子配体1-CCR9趋化因子轴的作用下迁移至肠道黏膜,从而改变肠道微生物组成及稳态,最终引起肠道免疫损伤。有研究通过分离小肠黏膜上皮细胞、固有层淋巴细胞和上皮内淋巴细胞进行染色测定各类细胞内细胞因子的表达量,结果发现,H1N1病毒PR8株感染后,小鼠肺部CD4+T细胞的γ干扰素表达水平显著升高,且肠道菌群组成相应发生改变;但γ干扰素表达量低时,病毒感染小鼠的肠道免疫损伤减轻,IL-17表达水平正常,肠道菌群组成未发生改变[32]。由此可见,肺源性的效应细胞CD4+T细胞可能通过过量分泌γ干扰素干扰肠道微生物群的稳态,导致肠道菌群失调[32]。在流感病毒感染的小鼠中,除发生肺源性CCR9+CD4+T细胞的招募及其分泌γ干扰素介导肠道菌群组成变化并引起肠道免疫损伤外,肠道菌群变化还可诱导小肠上皮细胞产生IL-15,直接或间接刺激小肠本身的Th17细胞发生极化。但IL-15对Th17细胞的作用仍存在争议,推测其对Th17细胞生成有促进和抑制双重作用[32]。
γ干扰素在流感病毒感染过程中发挥重要作用。流感病毒H1N1的CA04株感染小鼠模型中,通过检测肺泡灌洗液中的细胞因子水平发现γ干扰素的产生可增加机体对流感病毒的易感性。流感病毒感染引起小鼠肺部γ干扰素分泌增加,作用于2型固有淋巴细胞表面的γ干扰素受体,导致肺部2型固有淋巴细胞活性减弱,IL-5分泌减少,可能影响肺部上皮组织的完整性,导致机体对流感病毒的抵抗力下降[33]。2型固有淋巴细胞在黏膜免疫中发挥重要作用,尤其在肺部,除分泌IL-5外,还能产生IL-13和双调蛋白,双调蛋白是一种与表皮生长因子家族同源的双功能生长调节蛋白。流感病毒感染的小鼠中,呼吸道黏膜屏障中的内皮细胞、上皮细胞和巨噬细胞表达IL-33,诱导2型固有淋巴细胞分泌IL-13,并刺激其表达双调蛋白。IL-33是黏膜屏障的保护性因子,其分泌量减少会增加小鼠继发细菌性感染的概率[34](表1)。由于全身的黏膜免疫系统相互联系,流感病毒感染时,肺与肠的黏膜免疫反应都涉及γ干扰素的分泌增多,在肺与肠道黏膜免疫中是否存在相似的调节机制尚不清楚。除CD4+T细胞外,其他细胞是否也存在迁移现象,以及流感疾病过程中2型固有淋巴细胞是否对肠道黏膜免疫产生影响尚不明确。
肠道菌群改变可通过免疫途径间接影响流感病毒感染。利用抗生素处理动物,构建菌群紊乱模型,可以研究肠道菌群对流感病毒感染的影响。吴莎等[26]将正常小鼠经甲硝唑灌胃后,用总厌氧菌培养基脑心浸液琼脂分离检测后发现,小鼠肠道中总厌氧菌数量下降。随后在建立的厌氧菌菌群失调小鼠模型中发现,厌氧菌失调会导致Th1、Th2、Th17、调节性T细胞比例的变化。H1N1病毒FM1株感染小鼠肺组织匀浆中γ干扰素、IL-17水平升高,IL-4、IL-10水平降低,此时Th1、Th17细胞因子分泌占优势。甲硝唑处理后再经流感病毒感染的小鼠相较于单纯病毒感染小鼠表现为IL-4、IL-10水平升高,γ干扰素、IL-17水平显著降低。而患者外周血中IL-6与IL-10水平增高,可能与流感病毒感染的病程进展和病情加重有关[42-43]。Th2细胞、调节性T细胞因子分泌优势主要是菌群失调引起免疫负向调节作用,而各细胞因子的变化可能影响流感病毒从机体的清除从而加重病毒感染后的免疫病理损伤[26,42-43](表2)。Yu等[24]研究发现,经不同种类抗生素处理的小鼠,在感染流感病毒后,肠道菌群组成及脾脏中不同种类CD4+T 细胞数量变化不同。病毒感染对Th1、Th2细胞占比并无太大影响,Th1、Th2细胞的占比主要受肠道菌群调节,但肠道菌群变化对Th17细胞占比影响不大。然而,Wang等[32]研究发现,将流感病毒H1N1的PR8株感染小鼠的肠道菌群移植到对照组小鼠体内,则对照小鼠体内IL-17表达增多,可见病毒感染诱导的肠道菌群改变可以促进Th17细胞的分化以及相应细胞因子的产生。流感病毒感染对Th17细胞数量变化的影响机制仍待进一步阐明。相较于单纯流感病毒感染小鼠,抗生素处理后再经感病毒感染的小鼠固有免疫与适应性免疫应答减弱,肺部CD4+T细胞和 CD8+T 细胞数量减少,肺泡中巨噬细胞抗病毒基因表达降低,血液中病毒载量增加[27](表1)。在感染H7N9流感病毒的患者中也存在类似现象[40]。可见,抗生素处理后的菌群失调会降低机体的抗病毒免疫应答,从而加重流感病毒感染后造成的肺损伤。Steed等[46]研究发现肠道菌群代谢产物脱氨基酪氨酸也能影响流感病毒感染。经去氨基酪氨酸处理的小鼠肺部干扰素刺激基因表达增加。敲除 Irgm1-/-的高表达Ⅰ型干扰素的小鼠,流感病毒感染后造成的死亡率降低。与对照组小鼠相比,去氨基酪氨酸治疗组小鼠流感相关的死亡率显著降低,推测感染前去氨基酪氨酸通过增强Ⅰ型干扰素释放,实现了对流感病毒H1N1感染的部分抵抗。
另一方面,肠道菌群中的益生菌在抗流感病毒感染中发挥积极作用。益生菌可通过调节固有免疫,维持肠壁的完整性,激活适应性免疫应答,增强机体的抗病毒能力[47]。目前,益生菌在病毒感染防治中的研究越来越多,Belkacem等[48]研究发现,副干酪乳杆菌可通过改变炎症细胞因子的释放调节机体的炎症反应状态。接种流感病毒前,用副干酪乳杆菌饲喂小鼠,能预激免疫系统和促炎因子释放,在流感病毒感染后,IL-33分泌增加,激活Th2细胞产生IL-13,促进上皮细胞增生,随后抗炎因子IL-10分泌增加,降低炎症反应,从而避免过度炎症反应导致机体的免疫病理损伤[48]。
目前多数研究仍集中在肠道菌群变化与机体抗流感病毒免疫应答的关系方面,但Bandoro和Runstadler[49]的研究提示肠道菌群还可与流感病毒发生直接作用。已知健康人体的肺部菌群和野鸭泄殖腔菌群都是以厚壁菌门、变形菌门和拟杆菌门为主。选取包括这三大主要菌门和疣微菌门中13种来源肠道菌群的代表性细菌,在野鸭流感模型中研究其是否直接对流感病毒稳定性产生影响,结果发现其中11种细菌对流感病毒的稳定性产生不同程度的影响。初步推测肠道细菌可直接作用于流感病毒或通过其代谢产物的间接作用降低流感病毒的稳定性。已有研究发现肠道菌群及细菌细胞壁成分脂多糖可通过直接作用促进人脊髓灰质炎病毒和鼠乳腺肿瘤病毒的致病性[50-51]。而该动物实验中发现肠道菌群可降低流感病毒在小鼠中的致病性,并且进一步确认了脂多糖能够以温度依赖方式和浓度依赖方式(37 ℃)降低甲型流感病毒的持久生存能力和结构稳定性。进一步分析,不同亚型以及不同宿主来源的流感病毒与脂多糖互作的敏感性不同。如流感病毒在禽类的泄殖腔内可直接接触肠道细菌及其细胞壁成分脂多糖,而流感病毒感染引发的肠道菌群失调则可能造成肠道黏膜屏障损坏,导致脂多糖泄露进入循环系统。在一定条件下,脂多糖可与病毒粒子结合影响流感病毒包膜的完整性,致使病毒形态变化,导致其传染性下降[49]。
4 小 结
流感病毒感染人及动物宿主后均可引起肠道菌群组成改变,其中致病菌数量增加,益生菌数量减少。而肠道菌群失调又可降低宿主的抗病毒免疫应答,加重流感病毒感染后造成的肺损伤。目前,针对季节性流感病毒的疫苗是应对流感病毒感染的最佳对策。但疫苗只能诱导窄谱的毒株特异性免疫应答,对发生抗原变异的病毒株感染无交叉保护[52]。因此,疫苗必须随流行毒株的变异而不断更新。在流感病毒感染中出现的密切关联的肺部与肠道的黏膜免疫反应,提示黏膜免疫系统的整体性在许多疾病的发生、发展中可能存在相似的作用机制。目前益生菌疗法也可能对流感的治疗及机体抗病毒免疫能力的提升发挥积极作用。Brundage[53]曾提出在流感大流行前可考虑进行细菌性疫苗的接种以及常见呼吸道病原菌敏感的广谱抗生素的大量使用,以预防和减轻流感和细菌相互作用导致的严重后果。肠道菌群在流感病毒感染包括机体抗病毒应答中作用关键,广谱抗生素的使用必须慎重且有针对性的选用。
