帕利哌酮对精神分裂症患者临床症状、认知功能及神经营养因子的影响
2019-08-13陈清刚
邹 琳,陈清刚,魏 安
(1.天津市安定医院,天津 300222;2.天津市滨海新区塘沽安定医院,天津 300450
神经营养因子主要包括神经生长因子(Nerve growth factor, NGF)、脑源性神经营养因子(Brain derived neurotrophic factor, BDNF)和神经营养因子3(Neurotrophin 3, NT-3),是神经元生长、分化所必需的物质[1]。研究显示,精神分裂症患者发病及临床症状与神经营养因子表达异常密切相关,患者血清BDNF和NGF水平均低于正常人[2-4]。临床药物对精神分裂症的治疗效果评价仅停留在宏观层面,具体改善调节机制尚未完全明确。万齐根等[5]对接受阿立哌唑治疗的精神分裂症患者临床症状、认知功能与神经营养因子的相关性研究显示,阿立哌唑可上调血清神经营养因子水平,与临床症状存在相关性。帕利哌酮作为非典型抗精神病药物之一,可提高患者血清BDNF水平,改善患者阴性症状和社会功能[6-7]。Gumuslu等[8]研究显示,帕利哌酮可上调小鼠脑神经营养因子(BDNF、NGF)水平,减少神经病变。但关于帕利哌酮对NGF、NT-3的影响尚无研究报道。本研究通过分析接受帕利哌酮治疗的精神分裂症患者临床症状、认知功能和血清神经营养因子水平的改善及其相关性,探讨帕利哌酮对精神分裂症的治疗机制,为临床合理应用提供参考。
1 对象与方法
1.1 对象
选取2016年4月-2018年4月在天津市安定医院住院的精神分裂症患者为研究对象。入组标准:①符合《国际疾病分类(第10版)》(International Classification of Diseases,tenth edition,ICD-10)精神分裂症诊断标准;②阳性和阴性症状量表(Positive and Negative Syndrome Scale,PANSS)评分≥60分;③年龄18~45岁。排除标准:①伴有其他严重疾病;②有药物过敏史;③妊娠期或哺乳期妇女。符合入组标准且不符合排除标准共60例。同期从本院工作人员及家属中招募健康志愿者共60例作为对照组。本研究经天津市安定医院医学伦理委员会审核批准,研究对象均签署知情同意书。
1.2 治疗方法
研究组口服帕利哌酮片治疗(芮达,西安杨森制药有限公司,20160112、20170425),初始剂量为3 mg/d,根据患者病情在1周内调整药物剂量为6~12 mg/d,治疗12周。
1.3 评定方法
1.3.1 精神症状和认知功能评定
采用PANSS评定研究组治疗前后的精神症状,PANSS共30个条目,包括7项阳性症状量表、7项阴性症状量表和16项一般精神病理症状量表,另有3项补充项目用于评定攻击危险性。采用1~7分7级评分,评分越高症状越严重。由经过训练的精神科医师综合患者相关信息和临床检查进行评定。以评定前一周内的全部信息为评定的时间范围,整个评定过程耗时约30~50 min。
采用Stroop测验(Stroop Color-Word Test,SCWT)、数字符号编码测验(Digit-Symbol Coding Test,DSCT)、持续操作测验(Continuous Performance Test,CPT)和连线测验A(Trail Making Test A,TMTA)评定对照组和研究组治疗前后的认知功能。在安静独立的环境进行测评,每名对象测评耗时约10 min。SCWT为测试者在45 s内准确读出汉字或颜色的数量;DSCT为测试者在90s内按要求填写正确的数量;CPT为对计算机显示的一系列数字的反应情况,电脑依据虚报率和漏报率自动计分,评分越高代表注意警觉力越好;TMTA为按要求完成阿拉伯数字顺序连接所需时间。由经过统一培训的2名医师进行评定,一致性检验组内相关系数(intra-class correlation coefficient,ICC)均大于0.80。
1.3.2 血清神经营养因子检测
于研究开始的次日和治疗结束后清晨分别抽取5 mL肘静脉血,静置后取上层血清,保存于-80℃冰箱中。对照组于研究次日清晨采集血清。采用酶联免疫吸附技术检测NGF、BDNF和NT-3浓度。试剂盒及配套试剂购于上海酶联生物科技有限公司,化学试剂购于天津市科密欧化学试剂有限公司。为减少实验误差,所有检测均由同一人使用同一批试剂完成。
1.4 统计方法
2 结 果
2.1 一般资料比较
研究组男性35例,女性25例;年龄18~45岁,平均(30.21±5.42)岁;身高(166.32±8.64)cm,体质量指数(BMI)为(21.09±1.82),病程0.5~5年。对照组男性33例,女性27例;年龄18~42岁,平均(31.74±5.81)岁;身高(163.92±8.31)cm,BMI为(20.87±1.79)。
2.2 研究组治疗前后PANSS评分比较
治疗后,研究组PANSS各分量表评分及总评分均低于治疗前,差异均有统计学意义(P均<0.01)。见表1。
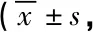
表1 研究组治疗前后PANSS评分分)
注:PANSS,阳性和阴性症状量表
2.3 两组认知功能比较
研究组治疗前SCWT、CPT、DCST及TMTA评分均低于对照组(P<0.05),治疗后SCWT、CPT、DCST及TMTA评分均较治疗前高,但仍低于对照组,差异均有统计学意义(P均<0.05)。见表2。
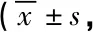
表2 研究组治疗前后及对照组认知功能评分分)
注:SCWT,Stroop测验;CPT,持续操作测验;DCST,数字符号编码测验;TMTA,连线测验A;t1/Z1、P1,研究组治疗前与对照组比较;t2/Z2、P2,研究组治疗后与对照组比较;t3/Z3、P3,研究组治疗前后比较
2.4 两组神经营养因子水平比较
研究组治疗前BDNF、NGF、NT-3水平均低于对照组,差异均有统计学意义(P均<0.05),治疗后研究组血清BDNF、NGF、NT-3水平较治疗前高(P均<0.01),但仍低于对照组,差异有统计学意义(P<0.05或0.01)。见表3。

表3 研究组治疗前后与对照组血清神经营养因子水平
注:BDNF,脑源性神经营养因子;NGF,神经生长因子;NT-3,神经营养因子3;t1、P1为研究组治疗前与对照组比较,t2、P2为研究组治疗后与对照组比较;t3、P3为研究组治疗前与治疗后比较
3 讨 论
本研究显示,精神分裂症患者认知功能指标(SCWT、CPT均值、DCST及TMTA时间)评分均低于对照组,患者认知功能受损;同时患者血清神经营养因子水平低于对照组。治疗后精神症状显著改善,认知功能评分提高,神经营养因子水平上升,与Chung等[9-11]研究结果一致,提示精神分裂症的发生可能与体内神经营养因子(BDNF、NGF、NT-3)表达异常相关。BDNF、NGF、NT-3具有神经保护和促进神经细胞再生的作用,其水平降低可能对神经组织产生可塑性损伤,降低神经系统信息传递功能,引发精神疾病。
接受帕利哌酮治疗后,精神分裂症患者血清神经营养因子水平提高,且神经营养因子水平与临床症状和认知功能具有一定的相关性。帕利哌酮能够激活和调节神经营养因子基因表达,提高该基因的蛋白合成能力,从而修复受损的神经元细胞和神经组织,减少损伤面积[12]。BDNF在脑内可与络氨酸蛋白激酶B特异性跨膜受体结合,对神经元和神经胶质细胞产生影响,参与神经元生长、分化和修复过程[13-15]。有研究显示,帕利哌酮可上调小鼠BDNF、NGF水平,减少神经病变[7]。经帕利哌酮治疗后,患者血清BDNF水平上升,进一步说明神经营养因子与精神分裂症的发生发展密切相关,帕利哌酮可能通过上调BDNF、NGF、NT-3水平发挥治疗作用[16]。本研究结果显示,精神分裂症患者接受药物治疗后,其认知功能和神经营养因子水平仍无法达到正常人水平,原因可能是患者脑损伤严重[17],无法完全逆转,也可能是未达到治愈水平,还需深入研究探讨。
本研究的不足之处在于:设计及实施过程未考虑学习效应对认知功能的影响,下一步应对是否存在学习效应和神经营养因子与认知功能的相关性进行深入探讨。本研究样本量较小,观察时间有限,未来研究应扩大样本量,延长治疗时间,进一步探讨帕利哌酮对精神分裂症患者血清神经营养因子与临床症状和认知功能的相关性。
