产苦马豆素疯草内生真菌Alternaria Section Undifilum oxytropis的诱变筛选
2019-08-13郝宝成宋向东高艳王学红刘宇李元曦梁妍陈柯源胡毓瑶邢小勇胡永浩梁剑平
郝宝成,宋向东,,高艳,,王学红,刘宇,李元曦,,梁妍,陈柯源,胡毓瑶,邢小勇,胡永浩,梁剑平
产苦马豆素疯草内生真菌Section的诱变筛选
郝宝成1,宋向东1,2,高艳1,2,王学红1,刘宇1,李元曦1,2,梁妍1,陈柯源1,胡毓瑶1,邢小勇2,胡永浩2,梁剑平1
(1中国农业科学院兰州畜牧与兽药研究所/农业部兽用药物创制重点实验室/甘肃省新兽药工程重点实验室,兰州 730050;2甘肃农业大学动物医学院,兰州 730070)
【】疯草是黄芪属和棘豆属有毒植物的统称,疯草内生真菌Section是从疯草中分离获得的一种具有产生苦马豆素(swainsonine,SW)能力的真菌。因其产物SW一方面体现出良好的抑制肿瘤细胞生长、浸润和转移作用及潜在的抗艾滋病病毒等多种药用活性,另一方面牛羊因大量误食疯草能导致中毒,对草原畜牧业健康发展造成了严重的危害,受到研究人员的广泛关注。但由于疯草内生真菌Section产苦马豆素生物合成机制尚不清楚,严重制约了后续通过生物发酵大量获得SW用以抗肿瘤机制研究与临床应用,以及通过基因工程手段对疯草进行脱毒育种,使疯草成为牛羊可食用、无毒的天然牧草。【】利用有效的研究手段,阐明Section产苦马豆素生物合成机制。【】以Section为出发菌株分别采用紫外辐照诱变、亚硝基胍化学诱变、紫外辐照与亚硝基胍复合诱变的3种诱变方式,在不同诱变时间、诱变剂量等条件下对其进行了诱变筛选研究。通过测定不同诱变方式和作用条件下对菌株的致死率,经发酵培养、连续5代传代培养、并采用α-甘露糖苷酶活性分析法检测诱变菌株产苦马豆素含量变化,优化确定了不同诱变方式下最佳诱变条件,并将优势突变菌株接种马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)和改良察式液体培养基,连续培养32 d,测定并绘制了突变菌株D4和UD1的生长周期曲线。【】经上述3种诱变方式处理后,分别获得1株产苦马豆素含量变化较大、能稳定连续传代培养的突变菌株U4、D4、UD1。其优化的诱变条件,紫外辐照为辐照处理160 s,亚硝基胍化学诱变为亚硝基胍诱变剂量6 μL、诱变处理时间5 min,紫外辐照与亚硝基胍复合诱变为紫外辐照20 s,亚硝基胍诱变剂量2 μL,诱变处理时间5 min。突变菌株U4、D4、UD1较原始菌株,菌落形态偏小、中间凸起,菌落颜色呈微粉色或白色,且其产苦马豆素含量均有显著变化,其中U4突变菌株产苦马豆素量平均增加16.02%(<0.01)、D4 突变菌株产苦马豆素量平均降低23.58% (<0.01),UD1 突变菌株SW产量平均增加21.87%(<0.01),但D4、UD1突变菌株生长周期与出发菌株一致,均为24 d。【】通过紫外辐照诱变、亚硝基胍化学诱变、紫外辐照与亚硝基胍复合诱变方法,成功筛选出产苦马豆素含量变化较原始菌株差异较大的3株突变菌株U4、D4、UD1,这为后续利用高通量测序等分子生物学手段,在分子水平上阐释疯草内生真菌Section关键基因、关键酶在其生物合成苦马豆素机制关系方面奠定研究基础。
Section;疯草内生真菌;苦马豆素;诱变筛选;生物合成机制
0 引言
【研究意义】疯草广泛分布于世界范围内,已成为危害草地畜牧业最严重的毒草,其毒害已被列入世界性“生态经济病”之一。据统计,截至2013年中国疯草面积约1 100万hm2[1],疯草在天然草地的迅速蔓延与扩散,引起疯草灾害的多发和频发,造成大批牲畜中毒、死亡。近年来,中国西部天然草地动物因疯草中毒死亡所造成的经济损失仍在不断剧增[2-3]。现已确证引起疯草中毒的主要毒性物质是苦马豆素(swainsonine,SW)[4-5]。另有研究表明SW具有抑制肿瘤细胞生长[6]、抑制肿瘤细胞浸润和转移、抗病毒感染[7]、增强免疫及潜在的抗艾滋病病毒等多种药用活性[8-9]。目前国外二期抗肿瘤临床试验已经完成[10]。疯草内生真菌是从疯草中分离获得的,具有产苦马豆素能力的一类真菌[11]。研究表明疯草中普通存在能够产生SW的内生真菌Section,如从疯草中分离出能产生SW的内生真菌[12-14],研究结果表明疯草中SW含量与疯草内生真菌密切关联,且疯草内生真菌的分离率越高,疯草及疯草内生真菌中SW的产量越高[15-18]。虽然中国疯草面积超过1 100万hm2,为SW的研究和开发提供了充足的来源,但由于疯草中SW含量较低,提取技术有限,而且面临植物资源消耗造成草地沙漠化等严重生态问题,直接从疯草中提取SW已不是一种理想的方法[19]。因此,通过生物发酵获取内生真菌次生代谢产物,扩大SW来源以及进行批量生产,已成为获取SW 的新途径。但目前对SW在疯草内生真菌中的生物合成通路还未完全阐释清楚。如果能明确疯草内生真菌产苦马豆素的生物合成途径和分子机理,则可利用基因工程手段对内生真菌进行改造,一方面抑制Section的生长,阻断SW在内生真菌中的合成路径,降低或消除疯草的毒性。另一方面通过真菌发酵培养、提取,获得大量SW将为抗肿瘤临床应用和科学研究提供有力的技术支撑,达到改良和利用的双赢。【前人研究进展】由于疯草内生真菌产SW的生物合成通路还未完全阐释清楚,目前推测其代谢合成的通路类似于豆类丝核菌和金龟子绿僵菌,哌啶酸和酵母氨酸脱氢酶为SW合成的主要中间物。HARRIS等曾对疯草()中SW的合成机理进行了研究,发现含有反式-1-羟基吲哚里西啶和1,2-二羟基吲哚里西啶和SW,推测疯草感染了豆类丝核菌或类似的微生物而导致疯草合成SW[20]。此后,MUKHERJEE等通过简并引物,(RACE)-PCR、反向PCR技术研究酵母氨酸脱氢酶基因序列;并研究酵母氨酸脱氧酶在SW合成中的作用,研究结果显示,敲除酵母氨酸脱氢酶基因后,赖氨酸和SW产量下降,推断酵母氨酸脱氢酶在SW中起着尤为重要的作用[21]。杨国栋等研究发现L-赖氨酸中被标记的碳氮原子可以掺入到哌可酸和苦马豆素中,推测L-赖氨酸、哌可酸在真菌合成SW的通路中扮演重要的角色[22]。近年来,国内外学者研究发现疯草内普遍存在能合成SW的内生真菌;酵母氨酸脱氢酶是疯草内生真菌SW合成的关键酶之一,推测疯草内生真菌中SW合成通路可能类似于豆类丝核菌和金龟子绿僵菌[23]。李海利等对疯草内生真菌(,)的蛋白组学进行了初步的研究,采用已构建的双向电泳条件、酶解方法及一维固相等电聚焦与质谱结合对真菌蛋白质进行了鉴定,试验共鉴定出应激蛋白、盐胁迫蛋白、真菌过敏原蛋白、参与赖氨酸的生物合成代谢蛋白等49个功能蛋白;其中鉴定出与苦马豆素生物合成路径相关的酶:酵母氨酸氧化酶、酵母氨酸脱氢酶、呢可酸氧化酶、与赖氨酸生物合成相关的酶及一些未知的与苦马豆素生物合成相关的蛋白,这些蛋白的鉴定为进一步开展苦马豆素生物合成关键酶研究奠定了基础[24-25]。LU等对波状芽管蠕孢菌进行了全基因测序,研究结果表明波状芽管蠕孢菌是由70.05 Mb基因组成,并推测其中有164个基因位点所对应的氨基酸或酶可能参与苦马豆素的合成途径,并进一步推测有P6C途径和P2C途径[26-27],但仍需要进一步的研究进行验证确认。【本研究切入点】随着科学技术的发展,利用微生物诱变选育技术也逐渐成熟起来。通过物理或化学手段,以人工干预的方式,诱导促使微生物中某些基因进行重组或缺失来优化基因性状[28],使微生物的代谢产物及生长情况向人们的期望所发展,已成为大多数学者的共识。本研究拟采用紫外辐照诱变、亚硝基胍化学诱变和紫外辐照与亚硝基胍的复合诱变方法,以期筛选获得高产、低产或不产SW的诱变新菌株,为后续利用高通量测序等分子生物学手段,在分子水平上阐释疯草内生真菌Section关键基因、关键酶在其生物合成SW机制关系方面奠定研究基础。【拟解决的关键问题】研究结果将为阐明疯草内生真菌Section产苦马豆素分子作用机理研究提供物质基础保障和理论依据,并对后期疯草进行脱毒改良或人工育种,在一定程度上有效降低由于疯草中毒引起的经济损失,发挥其潜在的牧草价值,保护草地生态健康发展提供技术参考。
1 材料与方法
试验于2016 年11 月至2018 年1月份在中国农业科学院兰州畜牧与兽药研究所兽用天然药物研究室完成。
1.1 菌株
Section(编号:CICC2493)购自中国工业微生物菌株保藏中心。
1.2 试剂与仪器
亚硝基胍购自上海叶源生物科技公司;PDA、改良察氏培养基购自索莱宝生物公司;组织研磨器、除菌滤膜购自博乐知生物科技有限公司;氯化锂、PBS、丙酮购自天津大茂化学试剂厂;α-甘露糖苷酶、对硝基苯基-α-D甘露糖苷、柠檬酸缓冲液(pH =4.5)、硼酸-氢氧化钠(pH =9.5),α-D甘露糖苷、双(三甲基硅烷基)三氟乙酰胺BSTFA+(三甲基氯硅烷)TMCS,SW标准品(98.4%,西安杨凌天力生物科技有限公司),无水乙醇、甲醇等化学试剂。高速台式冷冻离心机(YiH-2050R-1)购自湖南湘仪;立式单门双层加热制冷振荡器、生物安全柜(fsafe-1500)购自上海力申科学仪器有限公司;微孔板酶标版振荡器混匀(B100-2A)购自杭州卓尔科学仪器有限公司;恒温培养箱(NP-9272A)购自上海鸿都电子科技有限公司;紫外灯(ZW5D15W-Z150)购自沈阳普力德商贸有限公司。
1.3 Alternaria Section Undifilum oxytropis菌种原液的制备
以Section为出发菌株,选择挑取生长良好的菌落置于菌丝研磨器中加磷酸盐缓冲液(除菌)10 mL研磨,三层搽镜纸过滤除去菌丝,将过滤所得的菌液移入10 mL EP管中备用。
1.4 α-甘露糖苷酶活性分析法测定菌丝及发酵中SW含量标准曲线的制定
将1 mg·mL-1浓度的SW标准品溶液稀释配制为10、8、7、6、5、4、3、2、1、0.5、0.25、0.125、0.0625、0.03125 μg·mL-1。分别加10 μL置于96孔板中,并加入20 μL α-甘露糖苷酶(浓度:1 U·mL-1)和50 μL柠檬酸盐缓冲液于37℃下水浴15 min,然后加入20 μL对硝基苯基-α-D-甘露糖苷作为底物,37℃水浴1.5 h,反应完全后,采用分光光度法在405 nm测定产物的吸光值,绘制SW对α-甘露糖苷酶活性百分比影响折线图及标准曲线,并对样品进行测定。
1.5 紫外辐照诱变
1.5.1 诱变处理 将编号1、2、3……7的7个6孔细胞培养板中,每孔分别加入1 mL磷酸盐缓冲液(pH=7),再依次加入0.5 ml菌液,置于振荡器混匀仪上,低速运行,将1—6号板放置于波长为253.7 nm的卡瑞尔紫外灯下15 cm处,分别辐照20、40、80、160、320、640 s时取出。7号板不做紫外辐照处理作为空白对照,紫外诱变所有的操作均在黑暗避光环境下操作,待紫外诱变结束后,将诱变后菌液吸取200 μL涂于接种于PDA培养基平板上,置于避光的恒温箱中连续培养24 d,记录菌落数,以上细胞培养板分别设6个平行重复,并计算平均致死率(致死率按以下公式计算):

1.5.2 紫外辐照诱变菌株筛选 选取经紫外诱变处理生长良好的菌株,利用无菌接种针挑取单个菌落,划线接种于PDA培养基平板上,28℃、180 r/min恒温培养箱24 d,收集菌丝提取SW,利用α-甘露糖苷酶活性分析法,计算菌丝中SW含量,并在改良察式液体培养基中连续传代5次,每一代培养结束后,检测菌丝中SW含量,评价其产SW稳定性。
1.6 亚硝基胍化学诱变
1.6.1 诱变处理 分别取浓度0.5 mg·mL-1亚硝基胍2、4、6、8、10、12 μL,于6个2 mL EP管中,加磷酸盐缓冲液(pH=7.0)1 mL,依次加入0.5 mL菌液,28℃,120 r/min恒温培养箱中反应5、10、15、20、25、30 min,加入浓度为0.9%的无菌生理盐水5 mL稀释终止反应,11 000 r/min离心10 min,弃上清,再加入浓度为0.9%无菌生理盐水5 mL,震荡,1 000 r/min离心10 min,弃上清,再加入0.9%生理盐水5 mL,震荡后吸取200 μL涂布接种于PDA培养基中平板中培养,立刻置恒温箱中连续培养24 d,记录菌落数,每个剂量组设6个平行重复,计算平均致死率。
1.6.2 亚硝基胍化学诱变菌株筛选 选取亚硝基胍处理生长良好的菌株,利用无菌接种针挑取单个菌落,划线接种于PDA培养基平板上,28℃、180 r/min恒温培养箱24 d,收集菌丝,提取SW,利用α-甘露糖苷酶活性分析法,计算菌丝中SW含量,将SW含量变化差异较大的菌株在改良察式培养基中连续传代5代,每一代培养24 d,培养结束后检测菌丝中SW含量,评价其产SW稳定性。
1.7 紫外辐照与亚硝基胍复合诱变
1.7.1 诱变处理 将编号1、2、3……7的7个6孔细胞培养板,每孔分别加入1 mL磷酸盐缓冲液(pH=7),再依次加入0.5 mL菌液,置于振荡器混匀仪上,低速运行,将1—6号板放置于紫外灯下15 cm处,分别辐照20、40、80、160、320、640 s时取出,依次加入亚硝基胍2 μL,28℃,120 r/min诱变处理5 min,7号板不做任何诱变处理作为空白对照,诱变后立即加入浓度为0.9%的无菌生理盐水5 mL稀释终止反应,11 000 r/min离心10 min,弃上清,再加入浓度为0.9%无菌生理盐水5 mL,震荡,1 000 r/min离心10 min,弃上清,再加入0.9%生理盐水5 mL,震荡后吸取200 μL涂布接种于PDA培养基平板中培养,置于避光的恒温箱中连续培养24 d,记录菌落数,以上细胞培养板分别设6个平行重复,并计算平均致死率。
1.7.2 紫外辐照与亚硝基胍复合诱变菌株筛选 选取经紫外辐照和亚硝基胍复合诱变处理生长良好的菌株,采用无菌接种针挑取单个菌落,划线接种于PDA培养基平板上,28℃恒温培养箱24 d,收集菌丝,提取SW,利用α-甘露糖苷酶活性分析法,计算菌丝中SW含量,将SW含量变化差异较大的菌株在改良察式液体培养基中连续传5代,每一代培养24 d,培养结束后检测菌丝中SW含量,评价其产SW稳定性。
1.8 诱变菌株生长曲线的测定
选取诱变筛选获得的SW产量变化显著的新菌株,接种于PDA、改良察式液体培养基中置于28℃,180 r/min恒温摇床发酵培养以及恒温培养箱32 d,每隔4 d取样1次,每日观察记录诱变菌生长情况,并利用α-甘露糖苷酶活性分析法检测突变菌株产SW含量,绘制其生长曲线。
1.9 数据分析
采用SPSS19.0统计分析软件采用单因素方差法对试验结果进行统计,结果均以(平均值±标准差)统计显示。*表示差异显著(<0.05),**表示差异显著(<0.05)。
2 结果
2.1 α-甘露糖苷酶活性分析法标准曲线的绘制
从图1结果表明,SW浓度在1×10-3—5×10-3mg·mL-1范围内线性关系良好,并以5个梯度的苦马豆素浓度为横坐标,以苦马豆素对α-甘露糖苷酶活性百分比为纵坐标,利用EXCEL制作标准曲线,回归方程为=-0.0753+0.4532(2=0.9993)(图2)。
2.2 紫外辐照对诱变菌株平均致死率的影响
从表1、图3可以看出紫外辐照20 s,菌株开始死亡,死亡率为11.54%,但随着时间的增加为40 s时,致死率为40.28%,当紫外辐照80 s时致死率增加至83.33%,辐照160 s时致死率为94.87%,辐照320 s时致死率达到100%。结果表明紫外辐照20 s到80 s此间致死率变化较大,并随时间增加致死率不断上升。

图1 不同浓度SW对α-甘露糖苷酶活性百分比的影响

图2 SW抑制α-甘露糖苷酶活性百分比标准曲线
2.3 诱变菌株紫外辐照最佳诱变条件的确定
分别从紫外辐照20、40、80、160 s中选取1株生长良好的诱变菌株,依次命名为U1、U2、U3、U4进行发酵培养,经α-甘露糖苷酶活性分析法检测菌丝中SW含量(表2,图4),并经过连续传代5代培养,最终确定U4诱变株为生长良好且SW含量传代稳定的菌株,因此,紫外辐照处理160 s为紫外辐照诱变最佳条件。与原始菌株相比U4菌株菌落形态较小,且菌落呈白色微粉,菌落底色也偏粉(图5)。

表1 紫外辐照对Alternaria Section Undifilum oxytropis菌株的致死率

表2 突变菌株产SW含量
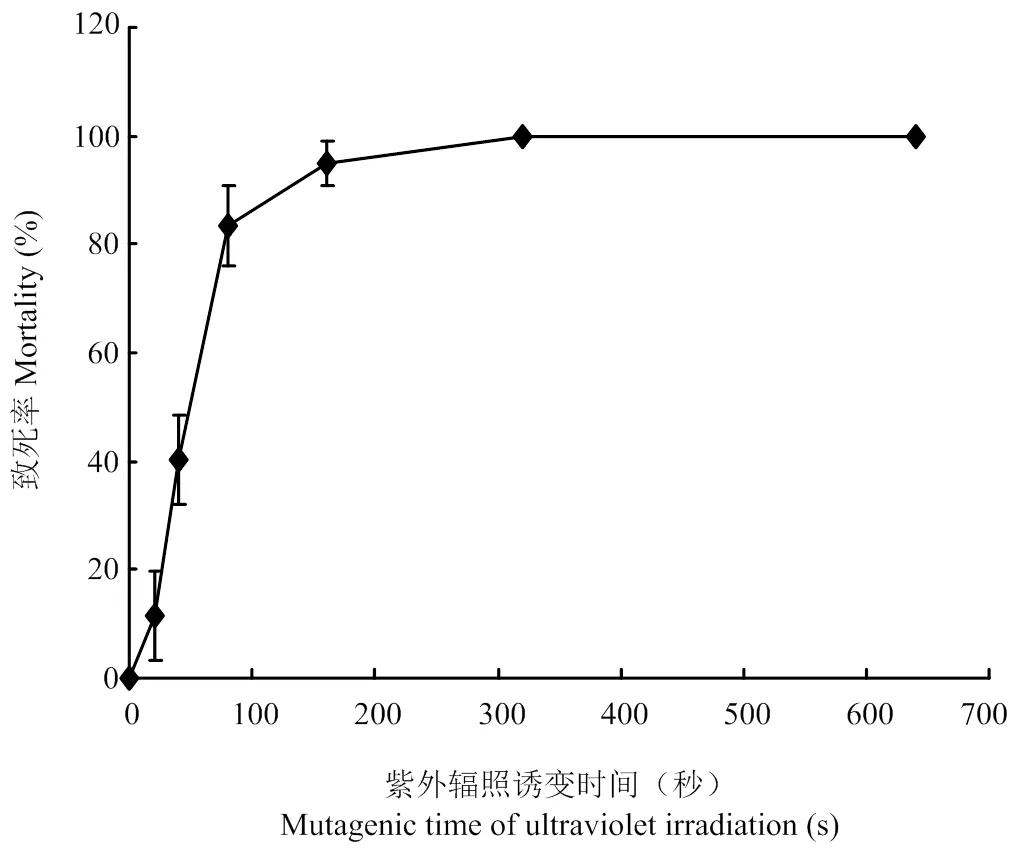
图3 紫外辐照对Alternaria Section Undifilum oxytropis菌株的致死率

* P<0.05,** P<0.01
2.4 亚硝基胍对诱变菌株平均致死率的影响
由表3结果看出,当亚硝基胍剂量为6 μL,与出发菌株诱变处理5 min时,平均致死率达58.33%,当亚硝基胍剂量为12 μL,与出发菌株诱变处理5 min时,平均致死率达到100%。结果表明,随亚硝基胍诱变剂量、诱变处理时间的增加,诱变菌株平均致死率也快速上升。

A、B为原始菌株生长菌落形态,C为紫外诱变后初筛的U4突变株菌落形态,D为U4传代培养后的菌落形态

表3 亚硝基胍诱变对Alternaria Section Undifilum oxytropis菌株致死率
2.5 亚硝基胍诱变最佳条件的确定
根据一般优选半数致死率附近的诱变剂量和诱变处理时间作为最佳诱变条件的原则,选取亚硝基胍诱变剂量2 μL、诱变处理时间15 min;亚硝基胍诱变剂量6 μL、诱变处理时间5 min,两组各3株诱变菌株,将其依次编号为D1、D2、D3、D4、D5、D6,采用无菌接种针挑取单个菌落,划线接种于PDA培养基平板上,传代培养5代,经α-甘露糖苷酶活性分析法检测菌丝中SW含量,诱变菌株产SW含量见表4和图6。图7-E为D4诱变后培养菌落形态,7-F为D4传代后生长24 d后菌落形态,可见菌落形态为中间凸起,呈不规则形状,菌落颜色发白略微偏粉。图7- G为诱变后D1培养生长菌落形态,7-H为D1连续传代5代后培养生长24 d后菌落形态,可见菌落形态偏小,且菌落颜色发白,生长相对于原始菌株缓慢。

表4 突变菌株产SW含量
<
**<0.01

**P<0.01
2.6 紫外辐照与亚硝基胍复合诱变对诱变菌株平均致死率的影响
由表5、图8可以看出,在复合诱变时菌株在紫外辐照20 s、亚硝基胍诱变剂量2 μL,诱变处理时间5 min时,诱变菌株致死率达到58.98%,当复合诱变时间达到160 s时,致死率达到96.15%,当复合诱变时菌株在320 s,致死率达到100%。结果表明,在亚硝基胍诱变剂量为2 μL,诱变处理5 min时,随紫外辐照时间增加致死率也随之上升。
2.7 复合诱变最佳条件的确定
选取紫外辐照20 s,亚硝基胍作用剂量2 μL,作用5 min时,菌株中菌落形态较原始菌落差异较大、长势良好菌株6株诱变菌接种于PDA培养基上,传代5代,经α-甘露糖苷酶活性分析法检测菌丝及发酵中SW含量,共获得3株产SW稳定诱变新菌株,将其依次编号为UD1、UD2、UD3,结果见表6和图9。图10-I为UD1株诱变后的培养24 d菌落生长形态,图10-J为UD1连续传代5代后生长24d后菌落生长形态,可见菌落偏圆且中间凸起,且菌落颜色发白。
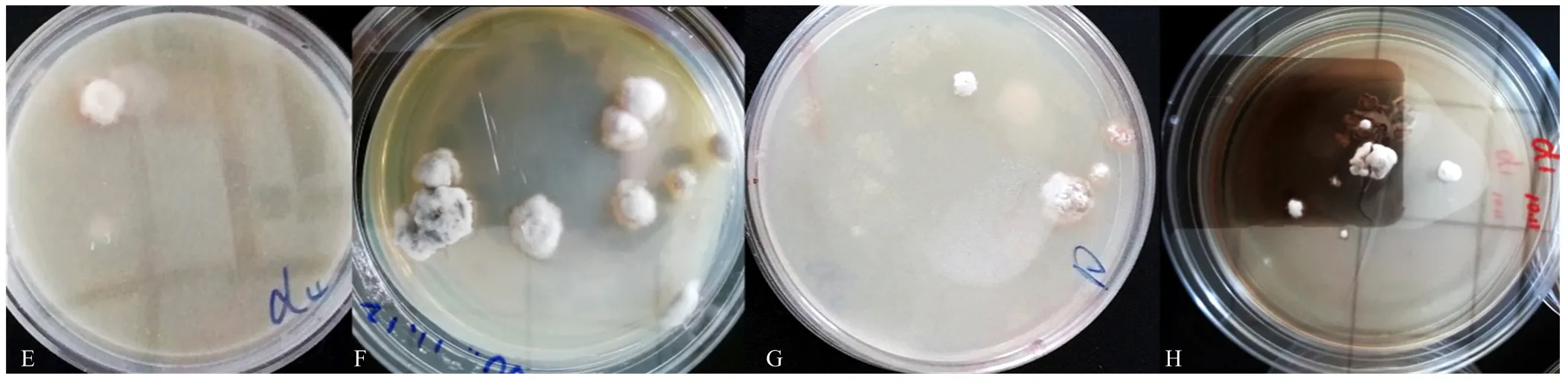
E诱变后D4培养菌落形态,F为D4传代培养后的菌落形态,G为诱变后D1培养菌落形态,H为D1传代培养后的菌落形态
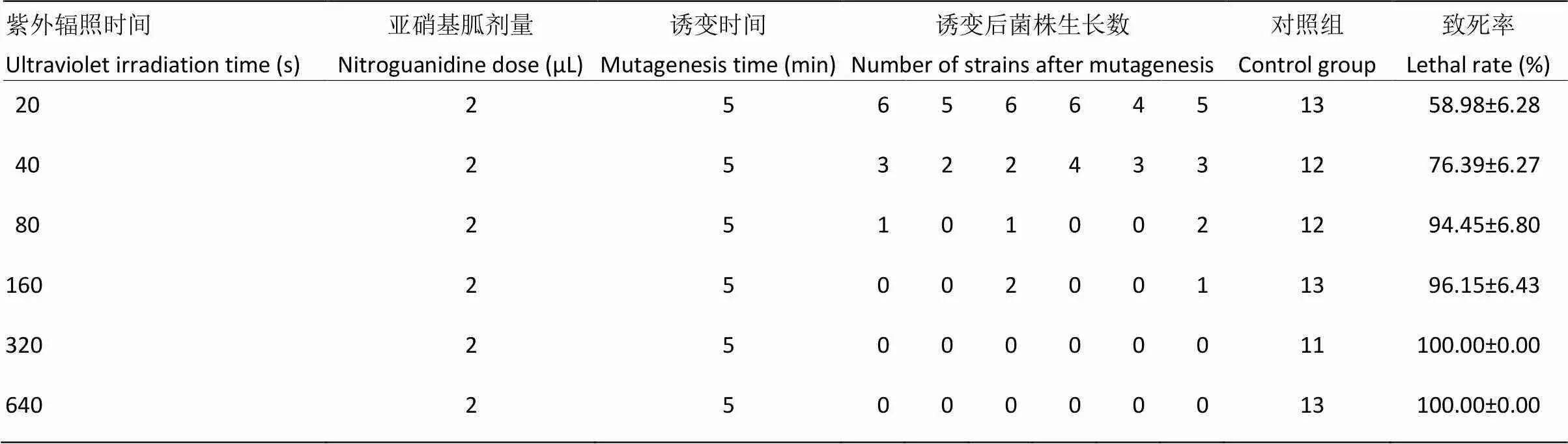
表5 紫外辐照与亚硝基胍复合诱变对菌株的致死率
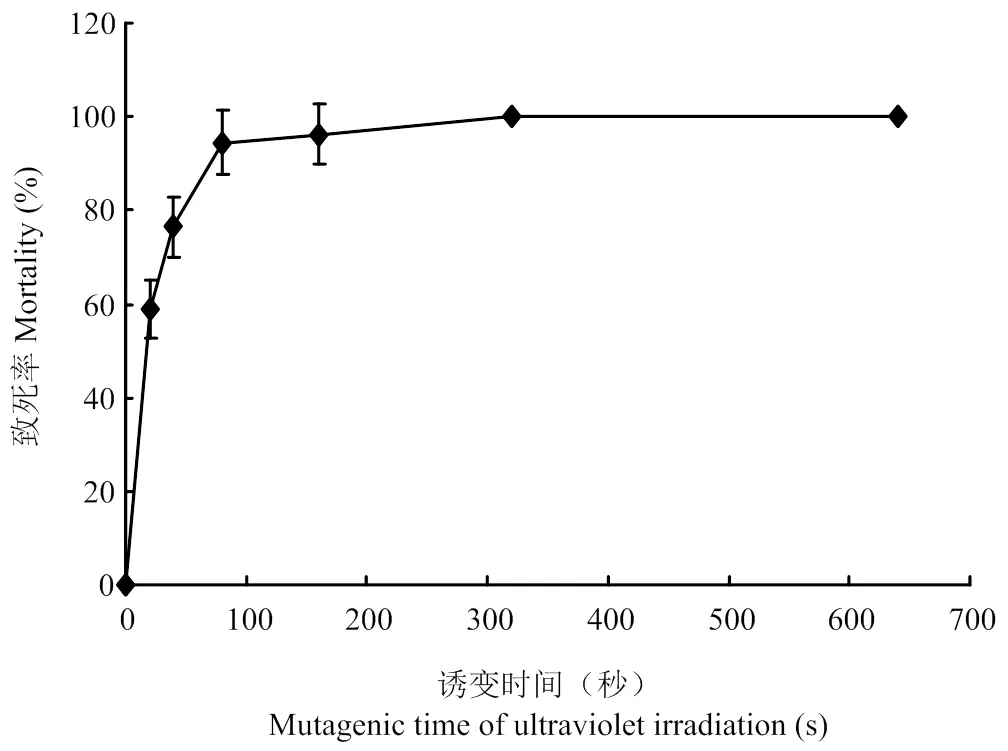
图8 紫外辐照与亚硝基胍复合诱变对菌株的致死率

**P<0.01
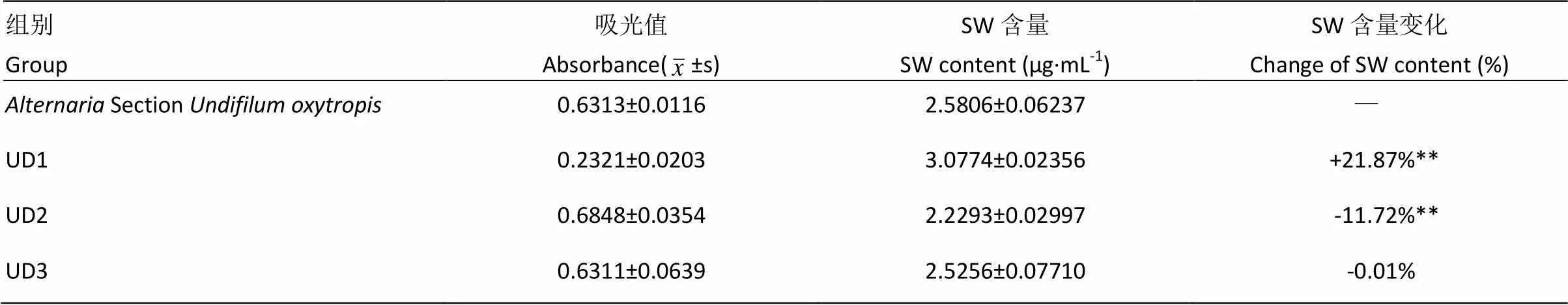
表6 突变菌株产SW含量
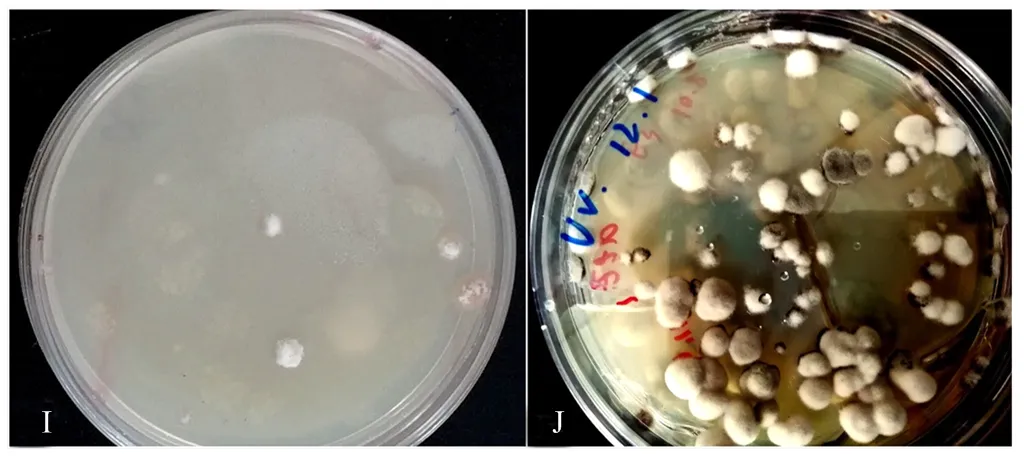
I为诱变后UD1菌落生长形态;J为UD1传代培养后的菌落生长形态
2.8 诱变菌株D4、UD1生长周期的测定
从表7可以看出,诱变菌株D4和UD1在培养至24 d时菌丝干重达到最大值,且菌丝中SW含量同时达到最大值,24 d后趋于稳定不再增加,但菌丝干重有所下降(图11)。结果表明,诱变菌株D4和UD1的生长周期为24 d,与原始菌株的生长周期相同(图12)。
3 讨论
微生物诱变筛选的主要目的是通过人工干预的方式使微生物的代谢产物及生长情况向人们的期望所发展。随着科学技术的不断进步,诱变育种技术也逐渐成熟起来,诱变育种的原理是通过物理或化学的诱导使微生物中某些基因进行重组或缺失来优化基因性状[29-30]。

图11 突变菌株与AlternariaSection Undifilum oxytropis菌株菌丝干重
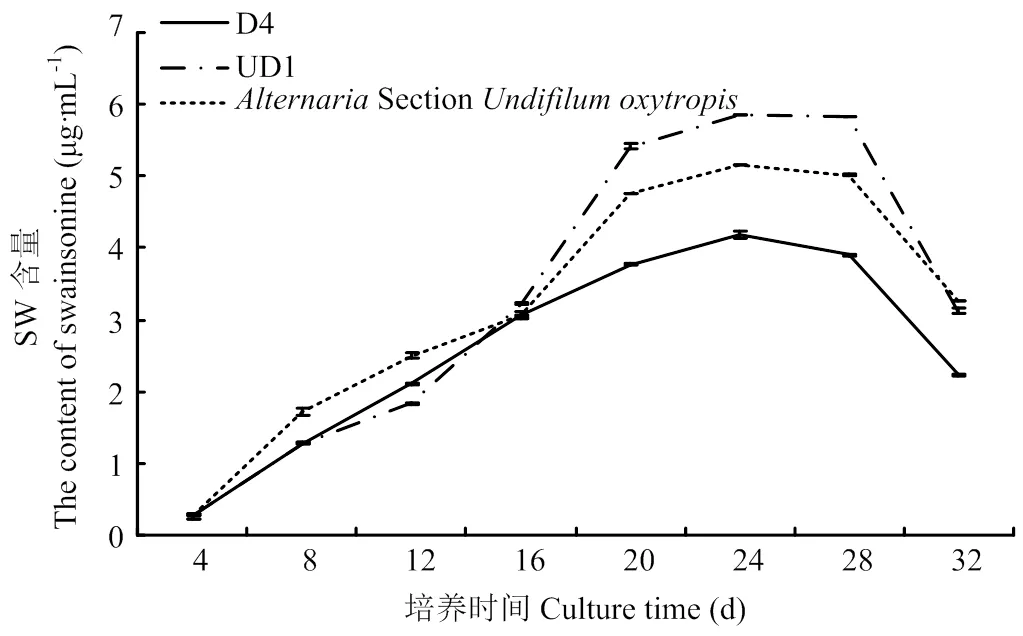
图12 突变菌株与AlternariaSection Undifilum oxytropis菌株产SW含量

表7 突变菌株与Alternaria Section Undifilum oxytropis菌株菌丝干重及SW产量检测
本试验中采用紫外辐照诱变、亚硝基胍诱变及紫外辐照和亚硝基胍诱变相结合的复合诱变方法。其中,紫外辐照诱变具有操作相对简单易行,育种效率高且安全等特点,原理是DNA或RNA能够吸收256 nm紫外波长而影响DNA的正常复制和转录来引起基因突变[31]。化学诱变是一种具有低成本、方便使用、专一性强等特点的诱变常用方法,其中亚硝基胍因其诱变效果稳定良好,被认为是化学诱变方式中的第一选择性化学诱变剂。亚硝基胍诱变主要是使微生物基因产生“GC-AT”转化,诱导DNA复制叉附近的突变,随时间的变化亚硝基胍诱变效果是不相同的,一般优选引起半数致死率附近的诱变剂浓度及作用时间作为最佳诱变选育时间[32-35]。例如,SANDESH[36]分别利用紫外线、乙基磺酸甲酯(EMS)和亚硝基胍(MNNG)对雨生红球藻进行诱变,获得的诱变新株中总类胡萝卜素和虾青素含量提高了23%—59%,从转录水平上分析发现类胡萝卜素合成途径相关基因的表达均明显高于野生型。采用复合诱变的方法是为了防止诱变选育菌株过程中,菌株对诱变剂、诱变作用时间产生耐受,从而导致致死率及突变率的下降[37]。本试验通过紫外辐照诱变、亚硝基胍化学诱变和复合诱变的方式筛选获得的3株新菌株U4、D4、UD1产苦马豆素含量分别为平均增加16.02%、平均降低23.58%,UD1平均增加21.87%,也验证了亚硝基胍化学诱变在常规诱变方法中具有很好的作用效果。
长期以来,虽然有学者推测疯草内生真菌产苦马豆素的代谢合成的通路,可能与豆类丝核菌和金龟子绿僵菌类似,但其验证试验进展缓慢。如何选择合适、有效的研究方法来阐明Section产苦马豆素的生物合成通路显得尤为关键。本试验选取常规的诱变手段,对原始菌株进行诱变筛选,以期从突变菌株产苦马豆素差异性入手,从分子水平上探究寻找调控苦马豆素合成的关键基因和关键酶,为后续研究提供参考依据和技术支撑。
4 结论
通过紫外辐照、亚硝基胍化学诱变、紫外辐照与亚硝基胍结合的复合诱变方法,成功筛选出产苦马豆素含量变化较原始菌株差异较大的3株突变菌株U4、D4、UD1,这为后续利用分子生物学手段在分子水平上阐释疯草内生真菌Section关键基因、关键酶在合成苦马豆素机制关系方面研究奠定了基础。
[1] 周启武, 赵宝玉, 路浩, 王姗姗, 张樑, 温伟利, 杨晓雯. 中国西部天然草地疯草生态及动物疯草中毒研究与防控现状. 中国农业科学, 2013, 46(6): 1280-1296.
ZHOU Q W, ZHAO B Y, LU H, WANG S S, ZHANG L, WEN W L, YANG X W. The research and control situation of ecology and animal poisoning of locoweed in western natural grassland of China., 2013, 46(6): 1280-1296. (in Chinese)
[2] 赵宝玉, 刘忠艳, 万学攀, 霍星华, 郭玺, 王建军, 刘忠艳, 孙莉莎, 史志诚. 中国西部草地毒草危害及治理对策. 中国农业科学, 2008, 41(10): 3094-3103.
ZHAO B Y, LIU Z Y, WAN X P, HUO X H, GUO X, WANG J J, LIU Z Y, SUN L S, SHI Z C. Damage and control of poisonous-weeds in Chinese western grassland., 2008, 41(10): 3094-3103. (in Chinese)
[3] 全国畜牧总站. 中国草业网, 草原毒害草: http: //www. digitalgrass. cn/jsp/welcome. jsp , 2011-02-08.
The national stockbreeding station. China grass industry network, Grassland poison grass: http: //www. digitalgrass. cn/jsp/welcome. jsp , 2011-02-08. (in Chinese)
[4] 王雨梅, 韩国栋, 赵萌莉. 疯草内生真菌共生体的研究与展望. 中国草地学报, 2007, 29(4): 99-103.
WANG Y M, HAN G D, ZHAO M L. Prospects and research progress in locoweed fungal endophyte symbiont., 2007, 29(4): 99-103. (in Chinese)
[5] Cook D, Michael H R, Kevin D W, Stegelmeier B L. Locoweed poisoning in livestock., 2009, 2: 16-20.
[6] Singh D, Kaur G. Optimization of different process variables for the production of an indolizidine alkaloid, swainsonine from., 2011, 10(5): 1072-1078.
[7] 郝宝成, 武凡琳, 邢小勇, 项海涛, 温峰琴, 王学红, 权晓弟, 胡永浩, 梁剑平. 苦马豆素抗牛病毒性腹泻病毒研究. 中国农业科学, 2014, 47(1): 170-180.
HAO B C, WU F L, XING X Y, XIANG H T, WEN F Q, WANG X H, QUAN X D, HU Y H, LIANG J P. Study on inhibitory effect of the swainsonine from alkaloid of. Ex bend on bovine viral diarrhea virus., 2014, 47(1): 170-180. (in Chinese)
[8] Goss P E, Reid C L, Bailey D, Dennis J W. Phase IB clinical trial of the oligosaccharide processing inhibitor swainsonine in patients with advanced malignancies., 1997, 3(7): 1077-1086.
[9] 萨如拉, 卢萍. 内生真菌苦马豆素生物合成研究进展. 绿色科技, 2018, 8: 227-229.
SARULA, LU P. Research progress of swainsonine biosynthesis in endophytic fung., 2018, 8: 227-229. (in Chinese)
[10] Philip E S, Walter S, Paul E, Jennifer K, Eric W, Ronald M B. Phase II study of the efficacy and safety of oral GD0039 in patients with locally advanced or metastatic renal cell carcinoma., 2005, 23(6): 577-581.
[11] 汪治刚, 曹师, 徐娜, 徐杉, 李彦忠. 我国3种疯草的内生真菌培养特性研究. 草业学报, 2017, 26(10): 158-169.
WANG Z G, CAO S, XU N, XU S, LI Y Z. Cultural characteristics of fungal endophyte from 3 locoweed species in china., 2017, 26(10): 158-169. (in Chinese)
[12] Braun K, Romero J, Liddell C, Creamer R. Production of swainsonine by fungal endophytes of locoweed., 2003, 107(8): 980-988.
[13] Braun K. Fungal endophyte infection and swainsonine toxicity in locoweed. New MexicoNew Mexico State University, 1999: 156-162.
[14] LU H, QUAN H Y, ZHOU Q W, REN Z H, XUE R X, ZHAO B Y, Creamer R. Endogenous fungi isolated from three locoweed species from rangeland in western China., 2017, 11(5): 155-170.
[15] Wu C C, HanT S, Lu H, Zhao B Y. The toxicology mechanism of endophytic fungus and swainsonine in locoweed., 2016, 47: 38-46.
[16] 路浩, 李国中, 杨晓雯, 曹丹丹, 薛瑞旭, 权海云, 赵宝玉. 甘肃棘豆内生真菌种群多样性. 中国兽医学报, 2014, 34(7): 1094-1099.
LU H, LI G Z, YANG X W, CAO D D, XUE R X, QUAN H Y, ZHAO B Y. Diversity of endophytic fungi from., 2014, 34(7): 1094-1099. (in Chinese)
[17] 薛瑞旭, 权海云, 任祯慧, 路浩, 赵宝玉. 疯草内生真菌次级代谢产物分析. 动物医学进展, 2016, 37(7): 64-70.
XUE R X, QUAN H Y. REN Z H, LU H, ZHAO B Y. Analysis of secondary metabolites offrom locoweeds., 2016, 37(7): 64-70. (in Chinese)
[18] 周启武, 于龙凤, 路浩, 曹丹丹, 赵宝玉. 小花棘豆和变异黄芪内生真菌显微分布及定量检测. 微生物学报, 2014, 54(5): 572-581.
ZHOU Q W, YU L F, LU H, CAO D D, ZHAO B Y. Microscopic distribution and quantitative detection of endophytic fungusfromDC and., 2014, 54(5): 572-581. (in Chinese)
[19] 黄鑫, 梁剑平, 高旭东, 郝宝成. 苦马豆素的来源、药理作用及检测方法研究进展. 畜牧兽医学报, 2016, 47(6): 1075-1085.
HUANG X, LIANG J P, GAO X D, HAO B C. Research advance on sources, pharmacological effects and detection methods of swainsonine., 2016, 47(6): 1075-1085. (in Chinese)
[20] HARRIS C M, CAMPBELL B C, MOLYNEUX R J, HARRIS T M. Biosynthesis of swainsonine in the Diablolocoweed. () ., 1988, 29: 4815-4818.
[21] MUKHERJEE S, DAWE A L, CREAMER R. Development of a transformation system in the swainsonine producing, slow growing endophytic fungus,., 2010, 81(2): 160-165.
[22] 杨国栋. 疯草内生真菌合成苦马豆素的研究[D]. 杨凌: 西北农林科技大学, 2012.
YANG G D. Study on biosynthesis of swainsonine by the locoweed's endophytic fungi[D]. Yangling: Northwest A&F University, 2012. (in Chinese)
[23] Li H L, Yu Y Y, Gao R, Wang J H, Yang G D, Yang Z J, Baucom D, Creamer R. Analysecreted proteins fromby two dimensional gel electrophoresis and liquid chromatography–mass spectrometry/mass spectrometry., 2012, 11(11): 1881-1889.
[24] 李海利. 产苦马豆素疯草内生真菌蛋白质双向电泳及蛋白质组学研究[D]. 杨凌: 西北农林科技大学, 2012.
LI H L. Two dimensional electrophoresis and proteomics analysis of Producing swainsonine endophytic fungi proteins from locoweed[D]. Yangling: Northwest Agriculture and Forestry University, 2012. (in Chinese)
[25] 白晓南, 余永涛, 赵清梅, 何生虎. 苦马豆素生物合成研究进展. 动物医学进展, 2016, 37(5): 92-98.
BAI X N, YU Y T, ZHAO Q M, HE S H. Advances in biosynthesis of swainsonine., 2016, 37(5): 92-98. (in Chinese)
[26] LU H, QUAN H Y, REN Z H, WANG S, XUE R X, ZHAO B Y. The genome ofprovides insights into swainsonine biosynthesis and locoism., 2016, 6: 30760.
[27] Ren Z, Song R, Wang S, Quan H, Lu L Y, Zhao B Y, Lu H. The biosynthesis pathway of swainsonine, a new anticancer drug from three endophytic fung., 2017, 27(11): 1897-1906.
[28] 武晓雨, 邓百万, 陈文强, 解修超. 紫外诱变选育耐高温香菇新品种. 浙江农业学报, 2017, 29(12): 2015-2022.
WU X Y, DENG B W, CHEN W Q, XIE X C. Breeding thermo-tolerant strains of lentinula edodes by UV mutation., 2017, 29(12): 2015-2022. (in Chinese)
[29] 乔桦, 陈波, 朱天骄, 张国刚, 李长伟, 崔承彬. 产黄青霉S-3-25的硫酸二乙酯诱变突变株3d10-01的次级代谢产物研究. 国际药学研究杂志, 2017, 9: 871-877.
QIAO H, CHEN B, ZHU T J, ZHANG G G, LI C W, CUI C B. The secondary metabolites from a mutant 3d10-01 derived fromS-3-25 by diethylsulfate mutagenesis., 2017, 9: 871-877. (in Chinese)
[30] 左芳, 许超, 陈铭德. 应用果皮提取液探究紫外线诱变原理的实验活动. 生物学通报, 2009, 44(12): 50-52.
ZUO F, XU C, CHEN M D. Experimental activity of applicating pericarp extract to explore the principle of UV mutagenesis., 2009, 44(12): 50-52. (in Chinese)
[31] 程明, 崔承彬, 李长伟, 田从魁, 杜智敏. 化学诱变技术在微生物育种研究中的应用. 国际药学研究杂志, 2009, 36(6): 412-417.
CHENG M, CUI C B, LI C W, TIAN C K, DU Z M. Chemical mutation technique applied in microorganism breeding., 2009, 36(6): 412-417. (in Chinese)
[32] 李旭媛, 王刚, 费卓群, 陈光. 紫外-亚硝基胍复合诱变筛选高产淀粉酶菌株. 中国生物制品学杂志, 2012, 25(11): 1543-1546.
LI X Y, WANG G, Fei Z Q, CHEN G. Screening of high amylase-producing strains by mutagenesis with ultraviolet ray and nitrosoguanidine., 2012, 25(11): 1543-1546. (in Chinese)
[33] 李戈, 余凤玉, 曾会才, 王文华, 彭燕. 链霉菌LA5高产菌株诱变育种研究初报. 微生物学杂志, 2007, 27(5): 10-13.
LI G, YU F Y, ZENG H C, WANG W H, PENG Y. Preliminary research on mutation breeding of streptomyces sp. LA5 strain for high-yield antibiotics., 2007, 27(5): 10-13. (in Chinese)
[34] Adelberg E A, Mandel M, Chen G C. Optimal conditions for mutagenesis by N-methyl-N′-nitro-N-nitrosoguanidine incoli K12., 1965, 18(5): 788-795.
[35] 白晓南. 变异黄芪内生真菌的诱变及SW合成突变菌株的筛选[D]. 银川: 宁夏大学, 2017.
BAI X N. Mutagenesis ofBunge endophytic fungi and screening of SW mutant strains [D]. Yinchuan: Ningxia University, 2017. (in Chinese)
[36] SANDESH K B, VIDHYAVATHI R, SARADA R, RAVISHANKAR G A. Enhancement of carotenoids by mutation and stress induced carotenogenic genes inmutants., 2008, 99(18): 8667-8673.
[37] 易小畅, 蒋智, 李娜, 陆兵, 谌斌. 红芝漆酶高产菌株的诱变选育. 食品研究与开发, 2014(24): 139-142.
YI X C, JIANG Z, LI N, LU B, CHEN B. Mutational screening of ganoderma lucidum strain with high yield of laccase., 2014(24): 139-142. (in Chinese)
Mutagenesis and Screening of Endophytic FungusSectionProducing Swainsonine from Locoweed
HAO BaoCheng1, SONG XiangDong1, 2, Gao Yan1, 2, WANG XueHong1, LIU Yu1, LI YuanXi1, 2, LIANG Yan1, CHEN KeYuan1, HU YuYao1, XING XiaoYong2, HU YongHao2, LIANG JianPing1
(1Key Laboratory of New Animal Drug Project, Gansu Province/ Key Laboratory of Veterinary Pharmaceutics Discovery, Ministry of Agriculture/ Lanzhou Institute of Husbandry and Pharmaceutical Sciences of Chinese Academy of Agriculture Sciences, Lanzhou 730050;2College of Veterinary Medicine, Gansu Agricultural University, Lanzhou 730070)
【】Locoweed is referred to as theandof poisonous plants,Sectionis a kind of fungus with the ability to produce swainsonine (SW) isolated from locoweed. On one hand, Swainsonine exhibits good inhibition of tumor cell growth, invasion and metastasis, and potential anti-HIV and other medicinal activities. On the other hand, cattle and sheep can be poisoned by eating a large number of locoweed grass by mistake, which has caused serious harm to the healthy development of grassland animal husbandry and attracted extensive attention of researchers. However, the biosynthesis mechanism of producing SW in the endophytic fungusSectionis not clear, which seriously restricts the subsequent research and clinical application of swainsonine for anti-tumor mechanism by biological fermentation. And by means of genetic engineering of locoweed detoxification breeding, make locoweed edible and non-toxic natural forage for cattle and sheep.【】it is urgent to clarify the biosynthesis mechanism of swainsonine- producing ofSectionby using effective research methods.【】UsingSectionas the starting strain, ultraviolet irradiation mutagenesis, chemical mutagenesis of nitrosoguanidine and ultraviolet irradiation-NTG mutagenesis were used respectively. The mutagenic screening was carried out under the conditions of different mutagenesis time and mutagenesis dosage. By measuring the lethal rate of strains under different mutagenesis conditions, fermentation culture, continuous subculture of 5 generations and using alpha-mannosidase activity analysis method to detected the changes of swainsonine content, the optimal mutation conditions of different mutagenesis methods were optimized. The dominant mutant strains were inoculated into Potato Dextrose Agar (PDA) and Modified Czapek-Dox Medium, and the growth cycle curves of mutant strains D4 and UD1 were determined and plotted.【】After treatment with the above three mutagenesis methods, three mutant strains of U4, D4 and UD1 were obtained, which can be cultured steadily and continuously, and the content of swainsonine varies greatly. The optimum mutagenesis conditions were as follows: ultraviolet irradiation for 160 seconds, chemical mutagenesis of nitrosoguanidine for 6 μL and 5 min, ultraviolet irradiation-NTG mutagenesis for 20 seconds and 2 μL for 5 min. U4, D4 and UD1 mutant strains were smaller in colony morphology and protruded in the middle than original strains, and the color of colony was pink or white. And the content of swainsonine in the production of swainsonine had significant changes. Among them, the production of swainsonine of U4 mutant strain increased by 16.02% (<0.01), D4 mutant strain decreased by 23.58% (<0.01), and UD1 mutant strain increased by 21.87% (<0.01). However, the growth cycle of D4 and UD1 mutant strains were the same as that of the original strain, which were 24 days.【】By using ultraviolet irradiation, chemical mutagenesis of nitroguanidine and ultraviolet irradiation-NTG mutagenesis, U4, D4 and UD1 of mutant strains were successfully screened out, whose content of swainsonine was different from that of the original strain. This provides a basis for the subsequent use of molecular biological means to explain the key genes of EndophyticSectionand key enzymes in its biosynthesis mechanism of swainsonine.
Section; locoweed endophytic; Swainsonine (SW); mutation screening; biosynthesis mechanism
2018-06-14;
2019-05-19
中央级公益性科研院所基本科研业务费专项资金项目、兽用天然药物创新团队项目、中央级公益性科研院所基本科研业务费专项资金项目
郝宝成,E-mail:haobaocheng@caas.cn。宋向东,E-mail:18298349782@163.com。郝宝成与宋向东为同等贡献作者。
胡永浩,E-mail:yhh0817@126.com。通信作者梁剑平,E-mail:liangjp100@sina. com
(责任编辑 林鉴非)
