巨噬细胞极化及IL-6、IL-10对COPD大鼠肺血管重塑的作用机制研究
2019-08-13
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种可逆的以进行性气流受限和肺实质的破坏为特征的慢性炎症性疾病。到2020慢性阻塞性肺疾病将成为全球第三大死因[1],并将成为第五大致残病因[2]。慢性缺氧、高碳酸血症和酸中毒可通过引起COPD病人肺血管重塑的广泛收缩导致肺动脉高压。慢性炎症刺激还可导致血管内皮和平滑肌增生以及肺血管结构变化,例如狭窄、闭塞和纤维化导致进一步的肺血管重塑。在COPD晚期,最常见的心血管并发症是肺动脉高压,进一步导致慢性肺心病、右心衰竭,甚至全心衰竭。最近,一些研究表明肺血管重塑和肺动脉高压是COPD病人引发肺心病的最关键因素[3-4]。因此,早期COPD肺动脉高压和肺血管重塑的缓解可以延缓心血管并发症的发生,但用于治疗由COPD诱导的肺动脉高压的靶向药物很少。
目前为止,COPD的发病机制尚不清楚。已知吸烟、遗传因素、呼吸道感染和蛋白酶失衡与COPD的发病机制密切相关。吸入气体或物质会引起肺部的氧化应激,破坏蛋白酶和抗蛋白酶之间的平衡,最终导致炎症,这是COPD发病机制中最重要的因素之一。在呼吸道内,慢性暴露于刺激物,特别是香烟的刺激会激活炎性细胞同时激活肺泡巨噬细胞[2]。活化的巨噬细胞在肺微环境中释放炎性细胞因子和趋化因子,诱导肺部慢性炎症,黏液增多,最终导致气道重塑和阻塞,造成肺泡和支气管损伤形成肺气肿[3,5-6]。巨噬细胞接受炎症因子刺激逐渐极化为经典活化巨噬细胞(M1)和选择性活化巨噬细胞(M2)。其中M1高表达诱导型一氧化氮合酶(iNOS)[4],M2高表达甘露糖受体(CD206)[7]。随着COPD病程严重程度的增加,M1 和M2 的比例逐渐增加[8-9]。Lu 等[10]研究发现,肺气肿小鼠模型CD68+气道巨噬细胞表达数量增加,这种巨噬细胞没有遵循经典的M1/M2 分型。可见巨噬细胞表面抗原的变化与COPD疾病的严重程度密切相关,并且巨噬细胞的主要功能之一是趋化因子的分泌,这一功能直接影响了炎症因子的分泌[11]。故可通过观察香烟暴露制作的COPD大鼠肺组织的形态变化以及相关抗原、炎性因子的表达变化,探讨巨噬细胞在COPD肺血管重塑和肺动脉高压发生发展的相关机制,为肺源性心脏病提供新的研究策略。
1 材料与方法
1.1 实验动物及分组 清洁级雄性SD大鼠24只(山西医科大学实验动物中心提供),动物合格证编号SXYK(晋)2015-0001,体重(200±20)g,鼠龄10周。将大鼠随机分为对照组、COPD组,每组12只。建立COPD 大鼠模型,每日将大鼠置于自制染毒箱内,暴露于16支香烟中2次(对照组大鼠也置于染毒箱内做伪暴露),每次30 min,2次之间相隔不少于4 h;开始燃烧8支香烟,随后每次4支香烟,每支香烟燃烧约12 min,换烟间歇3 min。COPD组吸烟3个月。
1.2 实验试剂及仪器 芙蓉牌香烟(湖南中烟工业有限责任公司,每支含尼古丁1.0 mg、焦油12 mg);iNOS(ab15323)、CD206(ab64693)、CD68(ab955)购自Abcam(美国);抗β-actin抗体、总蛋白提取试剂盒、BCA 蛋白浓度检测试剂盒购自武汉博士德生物公司;免疫组化试剂盒、辣根过氧化物酶标记的Ⅱ抗、DAB 显色剂购自北京中杉金桥生物公司;Western Blot化学发光剂购自江苏南通柯侎克生物科技公司;蛋白电泳系统和ChemiDoc XRS+凝胶成像仪购自Bio-Rad;Lionheart FX 智能活细胞成像分析系统购自美国BioTek;ASP6025型脱水机购自德国Leica;5235 型石蜡包埋机购自日本Sakura;CP225D电子分析天平购自德国Sartorius;Scope A1型显微成像系统购自德国ZISS;BD368498 SSTII分离胶促凝管;ELISA试剂盒购自E-EL-R0015c[白介素-6(IL-6),Elabscience];E-EL-R0016c[白介素-10(IL-10),Elabscience]。
1.3 方法
1.3.1 组织标本的留取 将对照组和COPD组麻醉后生理盐水灌流处死,将气管与双肺暴露,将左肺取出,OCT冰冻切片包埋剂包埋,冰冻切片后,4%多聚甲醛[含0.1%焦碳酸二乙酯(DEPC)]中固定,常规石蜡包埋。将右肺取出置于液氮中速冻,用于Western Blot检测。
1.3.2 肺组织苏木精-伊红(HE)染色 4%多聚甲醛灌流固定肺组织,再常规浸泡于此固定液中72 h,石蜡包埋。切成6 μm厚度的切片。烤片后,脱蜡、水化,苏木精染色5 min,盐酸酒精分化数秒,氨水浸泡15 min,伊红染色2 min,蒸馏水冲洗,梯度酒精脱水,二甲苯透明,中性树脂封片。
1.3.3 肺组织免疫组化染色 取石蜡包块切片,厚度5 μm,二甲苯、乙醇脱蜡至水,用3%H2O2封闭10 min,高压抗原修复2.5 min,冷却至室温后滴加封闭液。兔抗iNOS、兔抗CD206用抗体稀释液稀释(1∶250),4 ℃过夜。滴加相应二抗,DAB 显色,阳性结果为棕黄色。正置显微镜拍照,Image-Pro Plus 6.0图像分析软件分析。
1.3.4 肺组织免疫荧光共染 取冰冻组织切片,厚度5 μm,丙酮固定10 min,将切片置于0.1%Triton X-100溶液中10 min破膜,磷酸盐缓冲溶液(PBS)清洗3次;将切片置于湿盒中,滴加5%羊血清封闭液室温孵育30 min,去血清;分别滴加一抗:小鼠抗CD68、兔抗iNOS、兔抗CD206;4 ℃过夜,PBS冲洗3次,每次10 min;滴加荧光二抗:山羊抗小鼠FITC、山羊抗兔RBIC,室温放置1.5 h;PBS洗3次,每次10 min;DAPI工作液滴加于切片上,染色10 min;PBS 清洗10 min×3次,荧光封片剂封片,Lionheart FX智能活细胞成像分析系统获取图像。
1.3.5 Western Blot实验 于液氮中取出大鼠肺组织,用RIPA(P0013B,碧云天)提取大鼠肺组织总蛋白质,制备成50 μL蛋白上样缓冲液(1 μg/μL)用于Western印迹。将蛋白质样品进行变性(95 ℃ 5 min)处理,制成待测样本。用10%伯乐免染胶分离不同分子量大小的蛋白质,并转移到PVDF膜检测。膜在5%脱脂牛奶中封闭,兔抗iNOS、CD206按1∶500稀释,β-actin按1∶1 000稀释,4 ℃孵育过夜,二抗1∶7 000稀释,室温孵育2 h。使用ChemiDoc XRS+凝胶成像仪成像并进行半定量分析。
1.3.6 ELISA实验 实验大鼠腹腔注射7.5%的水合氯醛(1 mL/kg)进行麻醉。将大鼠的四肢和头部按仰卧姿势固定,使用 1 mL注射器进行心脏采血,静置于促凝管中30 min 后,1 500 r/min、4 ℃离心 10 min,取上清液液氮保存。
在各孔中加入标准品和样品各100 μL,37 ℃孵育90 min;倒去孔内液体,加入100 μL 生物素化抗体工作液,37 ℃孵育60 min;洗涤3次;加入100 μL酶结合物工作液,37 ℃孵育30 min;洗涤5次;加入90 μL底物溶液,37 ℃孵育15 min;加入50 μL终止液,立即在450 nm波长处测量OD值。建立标准曲线,进行计算。

2 结 果
2.1 COPD大鼠肺组织病理变化 与对照组相比,COPD组大鼠肺泡结构紊乱,支气管肺内出现以淋巴细胞为主的炎症细胞浸润,支气管壁杯状细胞数目增多,腺体增生肥大,部分肺泡出现破裂。详见图1。
2.2 大鼠肺组织中巨噬细胞M1、M2型极化 免疫荧光显示COPD组大鼠肺组织中M1(CD68+iNOS+)、M2(CD68+CD206+)型巨噬细胞数量较对照组增加。通过对肺组织免疫组化的灰度值分析,COPD组大鼠M1型及M2型巨噬细胞较对照组明显升高(P<0.05)。详见图2~图4。
2.3 大鼠肺组织中M1、M2型巨噬细胞相关蛋白表达变化 Western blot 结果显示,与对照组相比,COPD组大鼠iNOS和CD206蛋白水平明显升高(P<0.05)。详见图5。
2.4 大鼠血液中炎性因子IL-6、IL-10表达变化 ELISA结果显示,与对照组相比,COPD组IL-6含量显著升高(P<0.05),IL-10含量则显著下降(P<0.05)。详见图6。
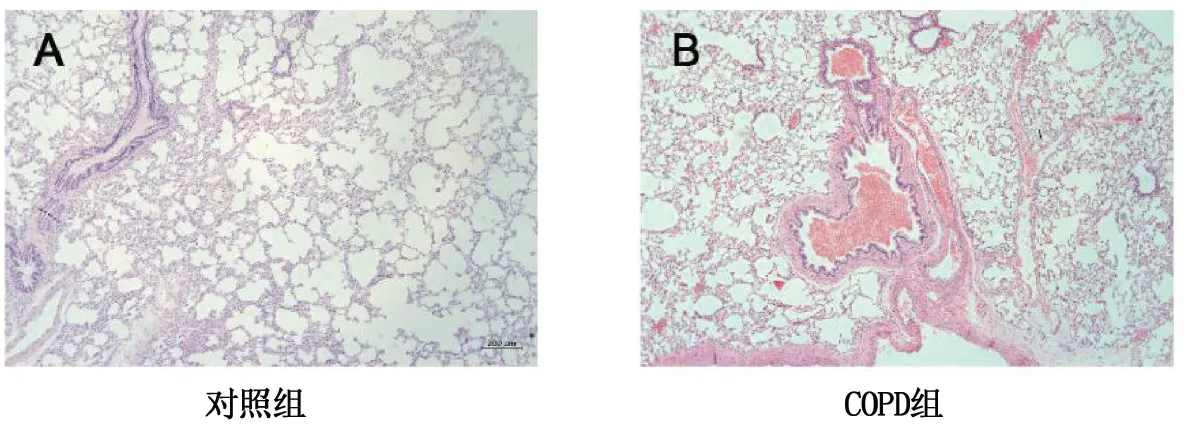
图1 两组大鼠肺组织HE染色
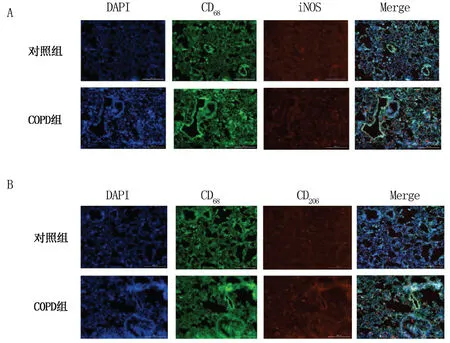
A图中蓝色荧光标记细胞核,绿色荧光标记CD68抗原,红色荧光标记iNOS抗原;B图中蓝色荧光标记细胞核,绿色荧光标记CD68抗原,红色荧光标记CD206抗原
图2两组大鼠肺组织免疫荧光共染比较
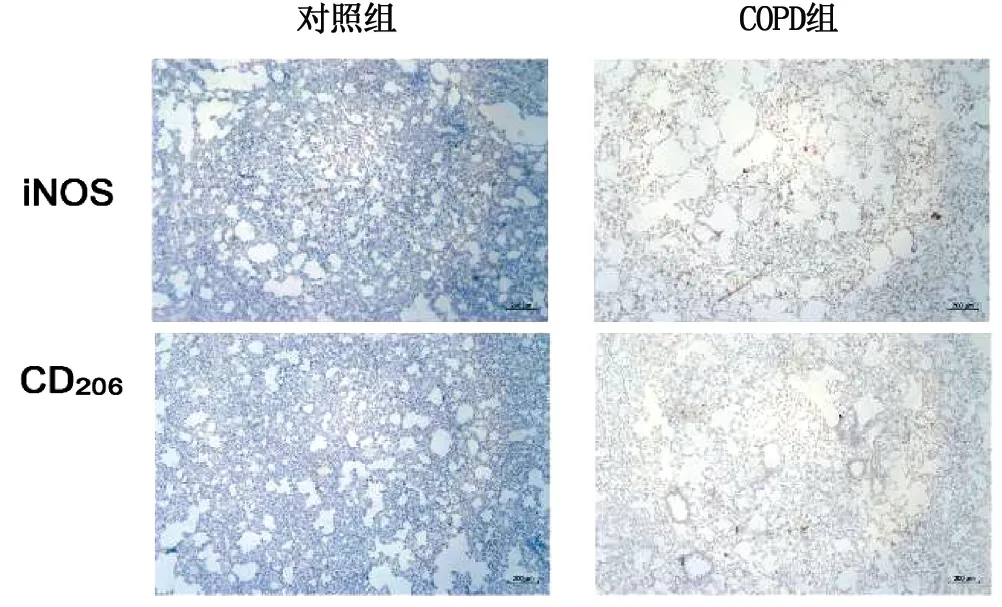
图3 两组大鼠肺组织免疫组化染色结果
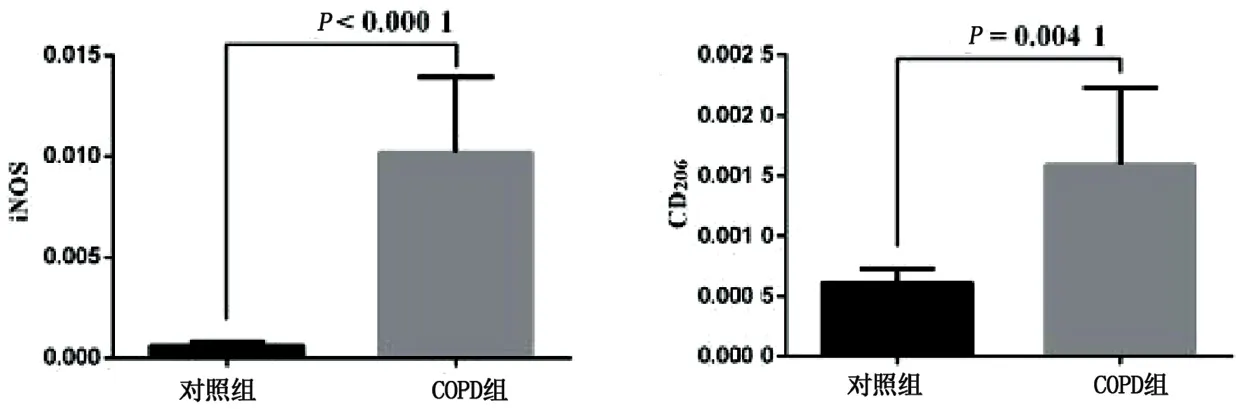
图4 两组大鼠肺组织表面抗原iNOS、CD206比较
3 讨 论
COPD是由于有毒颗粒或气体(主要是烟草)在呼吸道内造成慢性炎症增加的一类以气流受限为特征的疾病。最近几项研究表明,肺动脉高压和肺血管重塑是COPD发展成肺源性心脏病最重要和最关键的环节[12]。因此,控制肺部血管重塑和肺动脉高压诱导COPD对于延缓其心血管并发症很重要。
既往研究表明,缺氧、炎症和其他刺激可以导致支气管和肺血管的损伤和修复过程一次又一次地发生,最终将导致肺血管重塑及肺源性心脏病[13]。
在COPD 与气道和肺实质的慢性炎症中,香烟烟雾是激活固有免疫系统细胞的最初触发器。对COPD 病人肺组织和气道分泌物的研究表明,固有免疫系统和适应性免疫系统的细胞数量增加和活化发生了变化[14]。它以肺泡巨噬细胞、中性粒细胞、T 淋巴细胞和来源于循环的固有淋巴细胞增加为特征[3]。其中巨噬细胞是构成固有免疫系统细胞的异质群体[15],可吞噬和杀死摄入的微生物。除此之外,可产生许多促炎抗炎介质和效应分子,因此巨噬细胞在功能上不仅能促进炎症和组织损伤,也能通过释放一系列抗炎介质以及通过胞吞作用清除凋亡细胞来控制和消除炎症,修复损伤[16]。研究巨噬细胞以及相关联的炎症因子对于COPD的研究具有非常重要的作用。
在肺组织中主要有3种巨噬细胞,分别为支气管巨噬细胞(BM)[17]、间质巨噬细胞(IM)和肺泡巨噬细胞(AM)[18]。其中AM被认为是在协调与之相关的炎症事件中起着关键作用,与COPD的病理生理密切相关[19-20]。可塑性是AM巨噬细胞的一个明显特征,可分为两个亚群,其中M1保护宿主抵御外源微生物,抗肿瘤,产生大量炎症因子如IL-6、肿瘤坏死因子-α(TNF-α)等,激活抗微生物防御机制,包括有助于杀死入侵生物体的氧化过程和抗肿瘤等[21]。与M1功能不同,M2呈现出抗炎特征,与碎片清除和组织修复有关[22]。M2 可产生大量IL-10、转化生长因子-β(TGF-β)。特点是高表达CD206[7]。香烟等外部刺激气体会导致COPD病人巨噬细胞极化,M1/M2表面抗原表达增加,炎性因子增多。但也有文献报道,香烟烟雾使COPD 吸烟者的M1 巨噬细胞相关基因表达显著下调,而不是上调[8],有趋向M2表达的趋势。同样,有些研究也发现COPD 病人中,与戒烟者相比,吸烟者的M2 巨噬细胞减少,与COPD 病人戒烟及巨噬细胞抗炎表型的极化有关[23]。以上结果表明,吸烟可引起肺部免疫反应的复杂抑制,包括巨噬细胞激活和宿主防御功能的失活以及组织重塑的发展[24]。在病程的发展过程中M1/M2型巨噬细胞在COPD中表达增高还是降低是不断变化的,需要进一步细化研究。香烟烟雾刺激制作的COPD大鼠肺组织经过HE染色表明,COPD组大鼠肺气肿明显,肺间质淋巴细胞、中性粒细胞浸润明显,还存在支气管壁大量淋巴细胞增生、细支气管管壁平滑肌增生、管壁平滑肌部分断裂、杯状细胞增生等病理改变。证实熏烟暴露构建肺气肿大鼠模型形成。在此基础上,对COPD大鼠的肺组织进行免疫组化实验,分析可知,iNOS (M1型巨噬细胞表面特征性抗原) 和 CD206(M2型巨噬细胞表面特征性抗原)表达与正常肺组织AM细胞相比显著升高。免疫荧光实验表明,CD68的表达也同时升高。Western Blot实验也证明了这个变化。说明有香烟烟雾刺激的COPD发展到肺组织损伤、结构改变,炎症细胞浸润,支气管壁杯状细胞数目增多这一阶段时,巨噬细胞可塑性增强、极化显著、分型复杂。
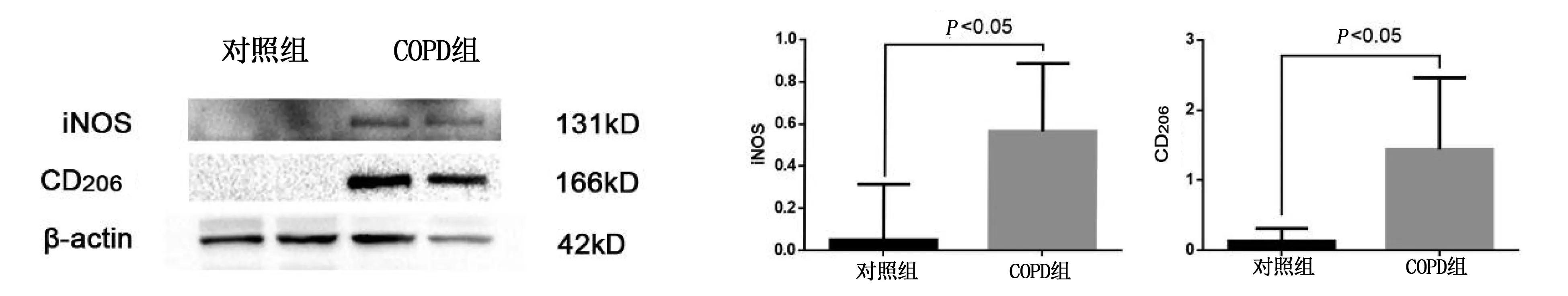
图5 Western Blot检测大鼠肺组织iNOS、CD206
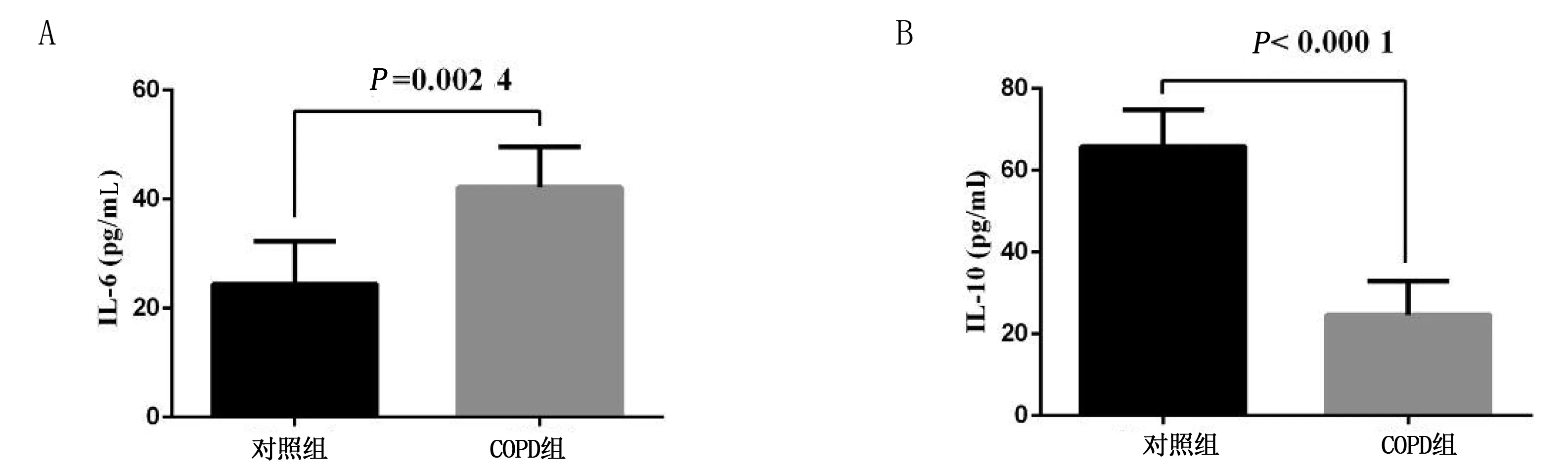
图6 两组大鼠血液中IL-6、IL-10含量比较
与巨噬细胞M1/M2极化抗原表达变化不统一,相应的与此相关的炎性介质表达也不一致。ELISA结果显示IL-6在COPD大鼠模型血液中表达更多。这可能与此阶段COPD病人T细胞、巨噬细胞以及中性粒细胞的数量明显增加、浸润现象明显有关。上述这些可以在支气管内诱导产生释放多种细胞因子如 IL-6、TNF-α等[25]。与前述不同的是,虽然M2 可产生IL-10,但是ELISA结果表明,COPD大鼠血液中的IL-10含量显著低于正常大鼠。这可能是由于IL-10 是一种细胞的抗炎因子,主要由机体的单核细胞和淋巴细胞产生和分泌,属于如 IL-6、肿瘤坏死因子家族等细胞因子合成的抑制性因子[26]。在此阶段,大鼠模型的炎症因子变化与人群COPD炎症因子变化趋势相似,故模型可以在一定程度上模拟人COPD疾病的发生发展过程。
综上所述,在香烟诱导产生的COPD大鼠模型中,肺组织已发生实质性改变,炎症反应明显;巨噬细胞可塑性增强,极化现象明显;可用iNOS、CD206以及CD68作为检测指标;结合血液中IL-6升高,IL-10含量减少,可共同为COPD的诊断提供依据,大量的研究证据表明,巨噬细胞被募集到受损的血管部位,进一步产生活性氧,分泌炎症因子,促进血管细胞的免疫激活、增殖和迁移。这种正反馈和相互作用的机制造成恶性循环,加速炎症反应随后的血管重塑以及更严重的肺源性心脏病,这些结果均提示,炎症反应在巨噬细胞参与COPD疾病的发展过程中发挥着巨大而复杂的作用,两者相结合的研究,可以为进一步解释COPD及并发症的发展机制以及开发新的治疗策略提供依据。
