弥散加权成像高信号完全可逆的急性缺血性卒中病例临床及影像学特征分析
2019-08-13杨蓉荆利娜高培毅隋滨滨沈宓王海阔秦海强陈丽
杨蓉,荆利娜,2,高培毅,2,3,隋滨滨,2,沈宓,2,王海阔,秦海强,陈丽
DWI是急性缺血性卒中MRI中最敏感的序列,在卒中发生的几分钟内DWI就能显示为高信号,急性缺血性卒中最先出现细胞毒性水肿,由于水分子弥散受限故DWI呈高信号。临床上对急性缺血性卒中再灌注治疗时间窗内的影像进行评估时,用DWI高信号代表梗死核心,用PWI评估缺血半暗带,由于梗死是不可逆的,因此治疗的主要目的是及时挽救缺血半暗带,同时认为代表梗死核心的DWI高信号是不可逆的,但是实际临床工作中急性缺血性卒中发生后DWI显示的高信号区并非一成不变,一项meta分析显示约四分之一的患者在发病几天内会出现DWI高信号部分可逆[1]。但是目前这样的文献报道很少,DWI高信号可逆分为部分可逆与完全可逆,但是目前国内未见有这方面报道,因此我们回顾了再灌注治疗时间窗内的急性缺血性卒中病例,结合基线与随访数据评估完全可逆性DWI高信号病例,分析其临床与影像学特征。
1 研究对象与方法
1.1 研究对象 回顾性选择2012年1月-2015年12月连续入组的在首都医科大学附属北京天坛医院住院并完成MRI检查的急性期缺血性卒中(发病时间<8 h)患者。入选标准:①年龄18~80岁;②临床症状、体征、影像表现均符合缺血性卒中的诊断;③基线与复查MRI检查图像清晰可用于评估(无明显运动伪影等)。排除标准:①颅内出血和肿瘤;②血糖<2.7 mmol/L或>22.2 mmol/L;③既往卒中遗留明显后遗症,且发病前mRS评分>2分。
1.2 检查方法 采用德国Siemens Magnetom 3.0 T MRI扫描仪进行检查。检查包含但不限于DWI、FLAIR和MRA。DWI采用多层单发射回波平面成像序列,弥散敏感系数b值分别为0和1000 s/mm2,b=1000异常区域用来识别病灶,具体参数如下:重复时间(repetition time,TR)3000 ms,回波时间(echo time,TE)75 ms,视野(field-of-view,FOV)23 cm×23 cm,采集矩阵128×128,层厚5 mm,层间距1.5 mm。FLAIR具体参数如下:TR 8000 ms,TE 94 ms,翻转时间2500 ms,FOV 20 cm×17.6 cm,采集矩阵256×179,翻转角150°,层厚5 mm,层间距1.5 mm。MRA采用三维时间飞跃法(time of flight,TOF),TR 28 ms,TE 3.2 ms,FOV 20 cm×18 cm,采集矩阵256×179。
所有入组患者进行基线MRI检查和7 d MRI复查,接受静脉溶栓的患者除上述MRI检查外溶栓治疗24 h后进行MRI复查,基线与复查MRI检查使用同一台MRI扫描仪,每个序列不同时间段内的扫描参数相同。
1.3 图像分析与临床信息评估 将所有扫描数据上传至工作站进行分析。由两位高年资神经影像医师采用双盲法对所有影像资料进行评估,当出现结果不一致时经协商后达成一致意见。
影像学评估包括:DWI高信号是否完全可逆、病灶基线DWI体积、病灶位置、基线FLAIR信号、病灶为单发或多发、责任血管有无狭窄及狭窄分级。DWI可逆病灶指基线时观察到与症状相符的责任病灶,24 h或7 d MRI复查示DWI与FLAIR均呈阴性。DWI体积测量软件为3D Slicer软件(http://www.slicer.org)。利用TOF-MRA图像评估血管狭窄程度,根据改良的TICI(thrombolysis in cerebral ischemia,TICI)分级标准将血管分为4级,具体如下:0级为血管闭塞,无前向血流通过闭塞段;1级指严重狭窄,有前向血流,远端血管分支显示稀疏;2级指轻度狭窄,见前向血流,远端有部分血管分支显示;3级为血管无狭窄,前向血流快速通畅,远端血管分支显示正常[2]。
患者临床信息包括基线NIHSS评分、从发病到接受影像检查的时间、TIA史、高血压、高血脂、糖尿病、心房颤动史、治疗方式、中国缺血性卒中亚型(Chinese ischemic stroke subclassfication,CISS)、90 d内有无再次卒中或TIA发生、90 d mRS评分。
其中CISS分型共5型,包括大动脉粥样硬化(large artery atherosclerosis,LAA)、心源性卒中、穿支动脉疾病、其他病因和病因不明(undetermined etiology,UE)[3]。结合临床与相关检查进行分型,其中LAA病因下根据发病机制又分为4种亚型,分别为穿支动脉闭塞、动脉到动脉栓塞、低灌注/栓子清除下降及混合型机制[3]。
基线临床信息由神经内科医师在患者住院时进行评价,随访信息包括90 d内有无再次卒中或TIA发生、90 d mRS评分由神经内科医师通过电话随访评价,当mRS评分≤2分认为临床预后良好。
1.4 统计学分析 利用SPSS 19.0统计学软件进行数据统计处理。计量资料先进行正态性检验,符合正态性分布者采用表示,不符合正态分布者的计量资料或者计数资料采用中位数(四分位数间距)。
2 结果
本研究共评估急性缺血性卒中患者229例,最终入组DWI高信号完全可逆者9例,其中男性8例,女性1例,平均年龄为(53.44±16.99)岁,从发病到进行磁共振检查的时间为219(155~338)min,基线DWI高信号体积为0.94(0.28~2.39)mL,基线NIHSS评分为1(1~2.5)分,90 d mRS评分为0(0~1)分,临床与影像学资料分别见表1、表2。具体图例分别见图1~图3。
3 讨论
急性缺血性卒中早期梗死核心DWI呈高信号,ADC呈低信号,而FLAIR呈等信号或稍高信号,称为DWI-FLAIR不匹配,其中FLAIR稍高信号可以用定量方法进行判定,当FLAIR病灶区与对侧正常组织的信号比值≤1.18或≤1.20可以用来辨认发病6 h或8 h内的急性缺血性卒中[4]。比值≤1.18识别发病6 h内缺血性卒中的敏感性为86%,特异性为79%;比值≤1.20识别发病8 h内缺血性卒中的敏感性为89%,特异性为76%。本研究中所有的DWI高信号可逆病例均符合DWI-FLAIR不匹配。

表1 急性缺血性卒中完全可逆性DWI高信号病例临床资料

表2 急性缺血性卒中完全可逆性DWI高信号病例影像学评估
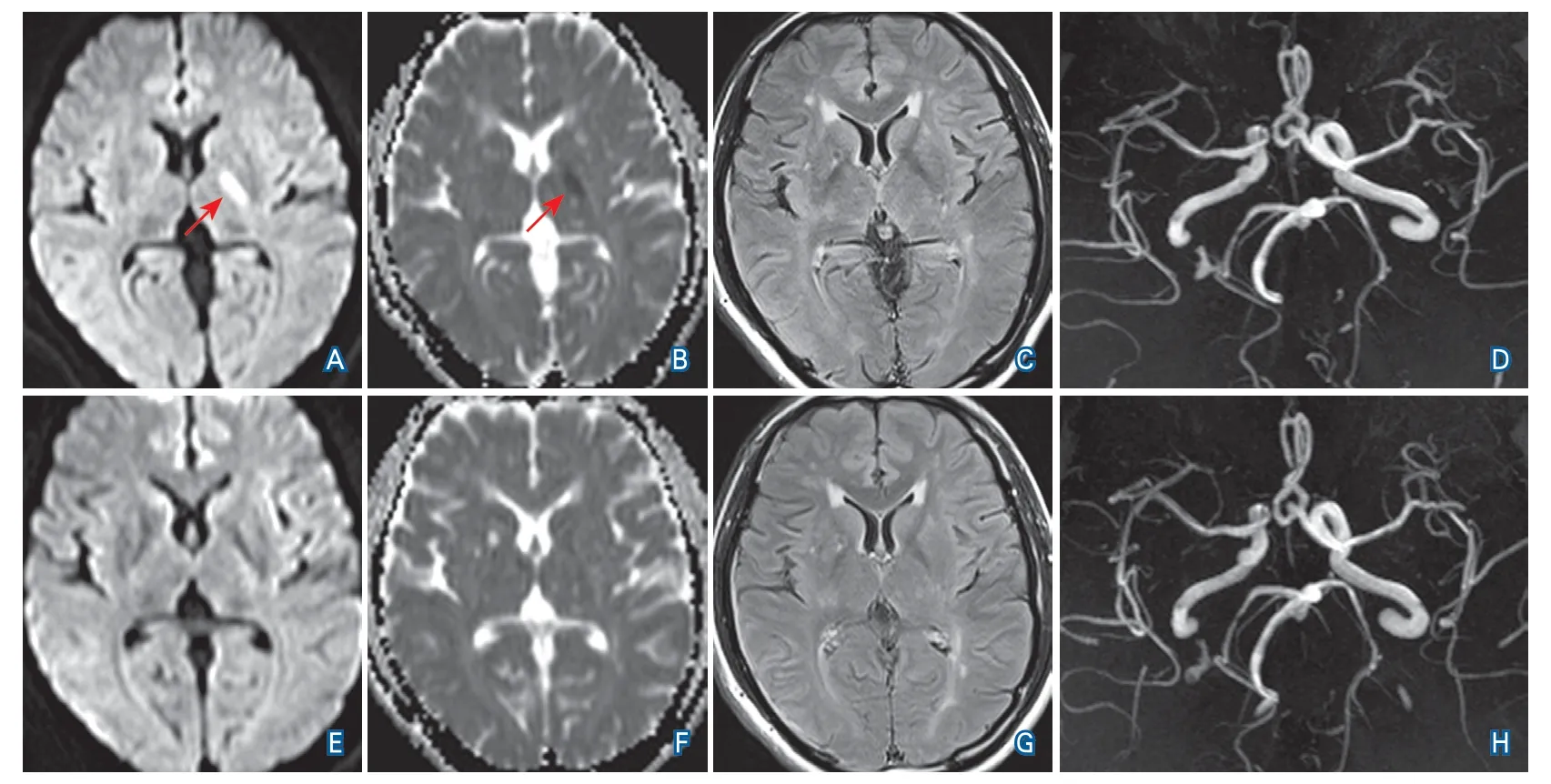
图1 病例2
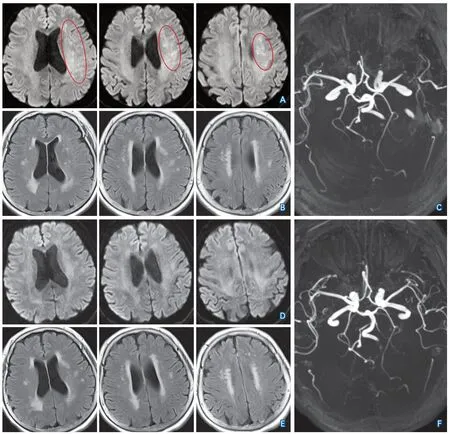
图3 病例8
虽然临床工作中用DWI高信号来识别梗死核心,但是通过本研究病例发现DWI高信号并非完全代表梗死核心灶,急性缺血性卒中DWI出现高信号的具体机理如下:急性缺血性卒中早期由于ATP依赖性Na+-K+泵障碍,造成了细胞内水分子弥散受限,除此之外还有细胞外水分子减少,或者无氧代谢引起了pH值改变,后者可能是DWI高信号可逆的原因,因此DWI高信号可能包含了梗死核心与缺血半暗带,而DWI可逆性病灶可能代表了缺血半暗带[5]。
Marc-Antoine Labeyrie等[6]发现50%的急性缺血性卒中患者可以肉眼观察到DWI高信号可逆,17%的患者DWI可逆病变的体积>10 mL,可逆性DWI高信号多为部分可逆。Mahesh Pundlik Kate等[7]分析了轻型卒中病例发现63%的病例磁共振复查时表现为DWI体积较基线时减少,而完全DWI可逆病例罕见,只占5.3%。相对于部分可逆,完全DWI高信号可逆病例特别罕见。本研究229例急性缺血性卒中病例中仅有4.37%为DWI高信号完全可逆病例。
Negar Asdaghi等[5]认为DWI可逆常发生于TIA或轻型卒中,这样的病例梗死面积小,本研究基线DWI高信号体积为1.40 mL,与Negar Asdaghi等的研究相似,这样的病例通常预后较好,本研究DWI高信号完全可逆病例的90 d mRS评分为0分。Yasufumi Gon等[8]报道称30%~50%的TIA病例可以见到DWI高信号。TIA传统定义为脑缺血引起的局灶性神经功能障碍,于24 h内(大多于1 h内)完全消失。虽然后来经过几次修正,但是临床工作中TIA与缺血性卒中常常缺乏明确的界限。目前根据国际疾病分类第十一版(International Classification of Diseases,11th Revision,ICD-11),缺血性卒中的最新定义为当神经影像学显示出与症状/体征相符的责任缺血病灶时,无论症状/体征持续时间长短都可诊断缺血性卒中,但在影像上无法得到明确的责任病灶证据时,仍以症状/体征持续超过24 h为时间界限诊断缺血性卒中[9]。而轻型卒中指NIHSS评分≤3分的卒中[7]。因此,本文中基线磁共振图像均见DWI高信号,我们认为这是缺血性卒中而非TIA,而且所有病例的NIHSS评分在1~3分,因此认为是轻型卒中。Fredrik N.Albach等[10]认为急性缺血性卒中DWI高信号完全可逆性病灶多见于小的栓塞性病例中。本研究中应用CISS分型不但能分析卒中的病因,而且揭示了发病机制,发现栓塞性卒中占大部分,与Fredrik N.Albach等的研究结果相似。
目前,认为急性缺血性卒中DWI高信号可逆与血管再通再灌注有关,这可以见于静脉溶栓,也可以见于机械取栓,这也恰好解释了DWI显示的部分高信号可能代表缺血半暗带,当血管再通再灌注后缺血半暗带得到挽救,因此这部分DWI高信号消失[6,11-12]。本研究的病例中有3例患者进行了静脉溶栓治疗,其中2例(病例2,病例4)没有大血管闭塞或严重狭窄,对于作为责任血管的穿支动脉有无再通目前常规TOF-MRA尚无法观察,病例6为双侧大脑中动脉闭塞,虽然静脉溶栓后大脑中动脉未见再通,但为烟雾综合征,说明有良好的侧支代偿。病例8为心源性栓塞所致并见责任血管闭塞,没有进行溶栓治疗,但是常规治疗7 d后复查血管自发性再通。本研究的病例一方面传统MRA不能确定穿支动脉有无再通,一方面存在着即使不溶栓也会发生血管自发性再通的情况,因此不能除外DWI高信号完全消失是由于再灌注引起的。
一些研究者认为急性缺血性卒中DWI高信号可逆病灶位于深部白质,也有其他研究者认为可逆病灶常位于皮层/皮层下[5,13]。而本研究中上述位置均可见,分析原因可能为目前文献中对此类可逆性DWI高信号报道的病例数较少有关。本研究中的病例9为多发病变,病灶大部分位于皮层,起初认为这是一个部分可逆病灶,将DWI与FLAIR信号对比后发现,这些病灶虽然在DWI均呈高信号影,但是FLAIR信号有差异,不可逆病灶的FLAIR明显高于正常脑实质,说明这两者发病时间不同,DWI不可逆病灶发病处于梗死亚急性期,而DWI可逆病灶属于本次再灌注治疗时间窗内的责任病灶。虽然目前没有研究者分析FLAIR信号强度与DWI可逆之间的关系,但是有研究者利用DWI-FLAIR不匹配来筛选发病时间不明或者醒后卒中患者[14]。当然也有研究者观察到某些急性缺血性卒中DWI与FLAIR都呈高信号情况下,病灶在这两个序列上又都消失了,但这种现象通常发生在溶栓后,这时虽然FLAIR会出现高信号,但是FLAIR高信号与血管再通后再灌注损伤有关,而非代表梗死灶[11]。
DWI可逆病灶也可发生于后循环,有研究者总结了发生于脑桥或小脑的急性缺血性卒中病例中的可逆性DWI高信号[12]。对于发生于后循环的可逆性DWI高信号的报道明显少于前循环,本研究的229例急性缺血性卒中病例中虽然既有前循环也有后循环,但是9例可逆性DWI高信号病例均发生于前循环,分析原因还是可能与病例少有关。
本研究存在以下几点不足之处。第一,由于急性缺血性卒中DWI高信号完全可逆罕见,本研究入组病例少,因此没有进行统计学分析。第二,本研究的随访影像学评估为7 d,对于7 d以后这些病灶有无再次出现高信号并不清楚,虽然从临床随访数据可以发现90 d内2例出现卒中或TIA症状,但总体说来这些病例的90 d临床预后都良好。
综上所述,急性缺血性卒中完全可逆性DWI高信号多见于轻型卒中,病灶梗死体积小,好发位置可见于皮质,也可见于深部白质,多与血管再通再灌注有关,且此类病例临床预后良好。以后研究中随着此类病例数增多,相关的临床与影像学特征有待于进一步证实与更新。
【点睛】传统观点认为急性缺血性脑卒中DWI高信号代表不可逆的梗死核心,而本研究的病例分析刷新了我们对传统观点的认识。急性缺血性脑卒中病例可以出现DWI高信号完全可逆,这样的病例通常见于轻型卒中,梗死体积小而且临床预后良好。
