非小细胞肺癌患者术后慢性疼痛的危险因素分析
2019-08-12张芳芳许琦琦曹君利
张芳芳 许琦琦 刘 琛 韩 园 曹君利
术后慢性疼痛(chronic post-surgery pain, CPSP)是指临床上在排除其他原因引起的疼痛前提下(如恶性肿瘤复发,慢性感染等),发生在术后至少持续3个月以上的疼痛综合征[1]。胸科手术被认为是最容易导致术后慢性疼痛的手术之一[2]。之前的研究表明,胸科CPSP的发生率高达14%~83%[3,4],胸科CPSP增加了肺不张、分泌物滞留、低氧血症和术后肺炎等肺部并发症的发生,同时也增加了医疗成本,降低患者术后生存质量,甚至和病死率的增加有关[5,6]。虽然有研究表明多模式镇痛方式减少CPSP的发生,但是近10年CPSP的发生率仍然未见明显降低,因此明确危险因素并进行早期干预尤为重要[7]。目前国内尚缺乏此方面系统性的研究。本研究旨在了解我国胸科CPSP的发生情况,同时通过术前、术中及术后相关因素的分析,寻找胸科CPSP独立危险因素,为CPSP的预防或治疗提供依据。
资料与方法
1.一般资料:本研究为回顾性单中心研究,通过医院伦理学委员会审核,选取笔者医院2017年11月~2018年5月期间择期行肺病损切除术的非小细胞肺癌患者。最终实际随访288例患者,其中男性168例,女性120例,ASAⅡ~Ⅲ级。纳入标准:患者年龄≥18岁,组织病理学或细胞学诊断为非小细胞肺癌,择期行肺病损切除手术,临床资料完整。排除标准:术前有精神类障碍者,无法用汉语沟通者,小细胞肺癌,术后二次手术者,同时行胸腔镜手术及开胸手术的患者。
2.数据收集:病例收集由两名麻醉医生根据纳入及排除标准收集笔者医院2017年11月~2018年5月期间择期行肺病损切除术的非小细胞肺癌患者。数据收集和电话随访时间为2018年6月~8月。通过既往病历查询获得患者一般资料,收集的资料主要包括术前,术中及术后3个方面。术前资料主要包括年龄、性别、BMI、既往病史、手术史、术前胸背部疼痛史。术中资料包括手术时长、术中出血量、手术类型、肺癌类型及分期、肿瘤部位、术中激素及非甾体抗炎药(NSAIDs)使用情况、是否有区域阻滞等。术后资料包括术后住院时长、引流管放置时长、术后镇痛泵使用情况、引流管根数、术后住院期间消耗吗啡当量(不同种类的镇痛药物消耗量根据吗啡等效剂量计算)、术后是否放、化疗。由于目前缺少诊断疼痛的客观指标,疼痛的有无通过患者的主观感受来获取。电话随访获取患者术后慢性疼痛发生情况已被多项研究采用,并且简单有效[3, 4]。若随访者在不同日期电话联系3次无人应答,则记录该患者失访。电话随访内容包括:(1)请问你现在手术切口处疼痛吗?并且这种疼痛和手术前的疼痛相同吗?(2)这种疼痛持续超过3个月吗?0分代表无痛,10分代表最痛。0~10分,安静平卧下几分?咳嗽时几分?活动状态下几分?(3)手术切口处有感染吗?切口处有红肿热痛的症状吗?(4)手术后有再次手术吗?或者有其他治疗吗?如化疗或者放疗?(5)有因为疼痛进行相关治疗吗?自行服用止痛药或者医院复诊吗?患者诉切口处疼痛超过3个月,且与术前疼痛不同,切口处无感染即可诊断为存在慢性疼痛(CPSP)。
3.麻醉、手术方法及围术期镇痛:所有入选的患者均采用全身麻醉,部分患者联合采用区域阻滞麻醉。其中,全身麻醉行气管插管机械通气的患者,均采用静吸复合麻醉。静吸复合麻醉均是麻醉诱导后以七氟烷复合丙泊酚及瑞芬太尼静脉维持。术中均有BIS监测麻醉深度,维持BIS值在40~60。区域神经阻滞麻醉包括超声引导下肋间神经阻滞或竖脊肌阻滞两种方式,均于麻醉诱导后完成。手术方式为开胸或胸腔镜下的肺癌根治术。开胸手术包括前外侧和后外侧切口两种方式,切口长度约10~15cm。术毕在手术切口处放置1或2根胸腔引流管。术后镇痛方式主要通过静脉自控镇痛方式(patient controlled intravenous analgesia,PCIA),笔者医院采用的镇痛泵名称是一次性输注泵(规格:WZ-6523C-4)。根据患者千克体质量进行个体化配置,加入0.9%氯化钠注射液配置成100ml。配方为有两种:(1)盐酸右美托咪定注射液0.1μg/(kg·h)+枸橼酸舒芬太尼注射液0.04μg/(kg·h)+盐酸托烷司琼注射液6mg。(2)盐酸右美托咪定注射液0.1μg/(kg·h)+酒石酸布托啡诺注射液0.08mg/(kg·d)+盐酸托烷司琼注射液6mg。手术结束前10分钟左右先从配好的药物中抽取2~3ml作为负荷量,随后以每2ml/h的速度,一般术后48h内泵完。患者根据自身疼痛情况(如NRS评分≥4分),可自行按压镇痛泵,每次按压剂量0.5ml。本研究中最终有272例患者使用PCIA,使用配方为右美托咪定+舒芬太尼+托烷司琼的患者有196例,使用配方为右美托咪定+酒石酸布托啡诺+托烷司琼的患者有76例。不管患者是否使用PCIA,术后前3天每12h静脉滴注50mg氟比洛芬酯,对于NRS评分≥7分患者,静脉注射或者肌内注射阿片类镇痛药,根据镇痛效果酌情追加。术后入ICU或者回病房的患者均由管床医生进行严密的术后疼痛管理,促进患者的早期康复。
4.观察指标:电话随访患者术后慢性疼痛发生情况。(1)疼痛发生有无:CPSP的判断标准为:①手术后出现的疼痛且疼痛至少持续3个月以上;②目前的疼痛与术前疼痛(如术前存在慢性疼痛史患者)性质不同;③排除其他原因引起的疼痛,如恶性肿瘤复发、切口的慢性感染。(2)疼痛程度:包括静息、活动、咳嗽时疼痛程度,采用数字评分量表NRS(0~10)进行评估,以患者报告的最重的严重程度作为CPSP的疼痛程度,并将疼痛程度分为无痛(NRS=0)、轻度疼痛(NRS 1~3)、中度疼痛(NRS 4~6)和重度疼痛(NRS 7~10)4个等级。
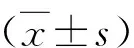
结 果
本研究最终纳入288例非小细胞肺癌肺叶切除术的患者,发生慢性疼痛的患者有136例(47.2%),未发生疼痛患者152例(52.8%)。136例发生慢性疼痛的患者中,轻度疼痛患者有96例,中度疼痛患者有33例,重度疼痛患者有7例。根据患者是否发生慢性疼痛分为术后慢性痛组(CPSP组),无慢性疼痛组(N-CPSP组)。
术前一般情况比较示两组患者的性别、年龄、BMI、ASA分级、吸烟史、饮酒史、高血压病史、糖尿病史、术前疾病史、术前放、化疗史比较,差异无统计学意义(P>0.05);术前胸背部疼痛史比较,差异有统计学意义(P<0.05,表1)。
术中两组情况比较示术中出血量、肺癌类型及分期、术中激素及非甾体抗炎药(NSAIDs)使用情况、是否区域阻滞、术中瑞芬太尼用量、术中舒芬太尼用量比较,差异无统计学意义(P>0.05),手术类型比较,差异有统计学意义(P<0.05,表2)。

表1 CPSP与N-CPSP患者术前一般情况比较
术后两组情况比较示术后PCIA使用情况、引流管根数、术后是否入ICU比较,差异无统计学意义(P>0.05);术后住院时长、引流管放置时长、术后住院期间消耗吗啡当量、术后是否放、化疗比较,差异有统计学意义(P<0.05,表3)。
将单因素分析中P<0.1的8个因素(术前胸背部疼痛史、手术类型、肿瘤分期、术后入ICU、术后住院时长、引流管放置时长、术后住院期间消耗吗啡当量、术后放、化疗)作为自变量,以是否发生慢性疼痛为因变量,进行Logistic回归分析,结果显示术前胸背部疼痛史、开胸手术、引流管放置时长、术后住院期间消耗吗啡当量是非小细胞肺癌患者发生术后慢性疼痛的独立危险因素(P<0.05,表4)。

表2 CPSP与N-CPSP患者术中情况比较[n(%),M(IQR)]

表3 CPSP与N-CPSP患者术后情况比较[n(%),M(IQR)]

表4 非小细胞肺癌术后慢性疼痛危险因素Logistic回归分析
讨 论
术后慢性疼痛是肺癌根治术最常见的术后并发症之一[8]。既往研究表明,各个中心所报道的胸科CPSP的发生率各有不同,在14%~83%不等[3]。本研究结果显示CPSP的发生率为47.2%,这与近年国内报道的结果相似。胸科CPSP以其高发生率及严重程度影响着患者的长期预后。因此,明确CPSP发生的影响因素尤为重要。本研究表明术前存在胸背部疼痛史、开胸手术、较长的引流管放置时间、术后住院期间镇痛药消耗量增多是非小细胞肺癌患者发生术后慢性疼痛的独立危险因素。
围术期疼痛管理不当是CPSP发生的重要原因[9]。已有大量研究表明术后急性疼痛控制不佳、术后急性疼痛严重程度与CPSP的发生有关,这可能与外周及中枢的持续性敏化有关[10,11]。本研究通过对术后住院期间所使用的镇痛药进行吗啡当量换算,发现术后镇痛药物使用量的的增加与CPSP的发生有关[12]。Kinney等[13]研究发现胸科术后前3天阿片类镇痛药消耗量的增多可导致术后CPSP发生率增高。研究者给出的推测是术后住院期间镇痛药物需求量的增多可能由于术后发生了较为严重的急性疼痛,若术后急性疼痛控制不佳,很可能导致慢性疼痛的发生。另有一项前瞻性研究表明术后前3天疼痛程度越高的患者术后发生CPSP风险越高[4]。由于本研究属于回顾性研究,未能获取患者术后急性疼痛发生情况,未来还需更多的前瞻性研究来证明术后镇痛药物消耗量与急慢性疼痛之间的关系。术前疼痛是患者入院治疗的常见原因,术前手术部位疼痛史与CPSP的相关性的研究较少。本研究纳入的胸背部疼痛史是指术前胸背部存在至少1个月以上的中重度疼痛,已有的研究发现疝气修补、子宫切除术和胸科手术CPSP的发生与术前疼痛史的相关性,这与本研究结果相符[14]。Humble等[1]研究发现癌症患者术前疼痛控制不佳是CPSP发生的独立危险因素。因此,对于术前存在中重度疼痛史的患者,加强术前疼痛管理尤为重要。
肋间神经损伤是胸科CPSP发生的主要原因之一[9]。传统的开胸手术与胸腔镜手术比较,肌肉组织和神经损伤程度更为严重,已有研究表明开胸手术CPSP及神经病理性疼痛的发生率和严重程度更高,这与本研究结果相符[15]。随着加速康复外科(ERAS)逐渐普及,传统的开胸手术方式逐渐被胸腔镜取代,然而,即使是切口较小的胸腔镜手术,术后也需要在手术切口处持续放置胸腔引流管,引流管放置的切口处往往是术后患者主诉的疼痛部位[16]。Miyazaki等[17]认为胸腔引流管的放置对肋间神经中的有髓纤维(Aδ和Aβ纤维)和无髓鞘C纤维持续性损伤导致了CPSP的发生。因此,术后胸腔引流管放置时间越长,肋间神经损伤越重,CPSP发生风险也就越高。本研究纳入的均为肺癌患者,部分患者术后会有进一步的放、化疗治疗,本研究发现术后进行放、化疗不增加CPSP发生的风险。术后放、化疗与CPSP的相关性研究较少,Steegers等[18]发现CPSP患者放疗比例较高,但未做进一步的多因素分析。但也有研究未发现术后放、化疗与CPSP的相关性,因此放、化疗与CPSP的关系尚不清楚,未来还需要开展更深入的研究来探讨。
综上所述,术前存在胸背部疼痛史、开胸手术、较长的引流管放置时间、术后住院期间消耗吗啡当量的增加是CPSP发生的独立危险因素。对于此类患者应早期干预,采取多模式的镇痛方式,加强围术期的疼痛管理,从而减少CPSP的发生,提高患者术后生活质量。
