Burkholderia cepacia中具有解脂作用的胆固醇酯酶的酶学特性
2019-08-12孙柳青吴梦棋张玲武迪辛瑜杨海麟
孙柳青,吴梦棋,张玲,武迪,辛瑜,杨海麟
(工业生物技术教育部重点实验室(江南大学),江苏 无锡,214122)
胆固醇酯酶(EC 3.1.1.13 cholesterol esterase,CHE)也被称为甾醇酯酶,可以在水相中催化胆固醇酯的水解,转化为胆固醇与脂肪酸,也可以在有机溶剂的存在下进行酯化与转酯反应,其广泛存在于哺乳动物与微生物中。哺乳动物来源的CHE属于胞内酶,主要存在于胰脏、血液、肝脏、肾脏等细胞中[1]。1976年UWAJIMA等首次报道分离出1株产CHE的荧光假单胞菌[2],之后更多微生物来源的CHE被发现,如链霉菌属、酵母菌属、金黄色葡萄球菌等[3]。CHE在食品[4]、诊断试剂[5]、污水处理[6]、制浆造纸工业[7]、织物脱脂等领域有广泛的应用。
CHE属于α/β水解酶家族中的酯类水解酶(EC 3.1.1.X,lipolytic enzyme),该类酶中还包括了脂肪酶(EC 3.1.1.3 triacylglycerol hydrolase,lipase)[8-9]。CHE和脂肪酶结构上有很明显的差异,脂肪酶的活性中心被“盖子(lid)”结构包住,而部分CHE中会有固定在N-末端的“帽子(cap)”结构[10];这两类酶最大的区别在其水解底物种类的不同,脂肪酶主要作用于长链脂肪酸形成的酯键,CHE主要作用于短链脂肪酸形成的酯键,而少部分CHE也可以水解脂肪酶的底物[11]。
在制浆造纸、皮革脱脂或污水处理等含有多种酯类或甘油三酯类物质的环境,要求CHE具有良好的耐受性与广泛的底物谱。本课题组在克拉玛依油田油污染严重的土壤中筛得1株对高温与有机溶剂耐受性较好的菌株,经鉴定为洋葱伯克霍尔德菌(Burkholderiacepacia),保藏号为CCTCC M2017661,在其发酵液中检测到明显的CHE的活性。本文探讨了所产CHE(以下简称CHEBur)对温度、有机溶剂及表面活性剂的耐受性,并重点研究了该酶的胆固醇酯酶活性及其解脂能力(可水解对硝基苯酯类底物和三酰基甘油酯类底物的能力),期望能为工业领域提供一种具有优良特性的胆固醇酯酶,并为其工业应用提供参考与借鉴。
1 材料与方法
1.1 材料与试剂
1.1.1 生产菌株
BurkholderiacepaciaZWS15由实验前期筛选得到,并成功保藏在武汉大学菌种保藏中心,保藏号为CCTCC M2017661。
1.1.2 培养基
种子培养基(LB培养基,g/L):蛋白胨 10,酵母粉 5,NaCl 10;
发酵培养基(g/L):蛋白胨 10,酵母粉 5,K2HPO4·3H2O 2,KCl 0.5,葡萄糖 0.1,卵磷脂0.6,MgSO410 mmol/L。
1.1.3 试剂
胆固醇油酸酯、胆固醇亚油酸酯、胆固醇苯甲酸酯、胆固醇辛酸酯、对硝基苯乙酸酯和对硝基苯棕榈酸酯:梯希爱公司;三丁酸甘油酯:上海麦克林生化科技有限公司;胆固醇氧化酶、辣根过氧化物酶:蓝园酶制剂公司。
1.2 实验方法
1.2.1 菌种培养及发酵
挑取BurkholderiacepaciaZWS15单菌落,接种于LB液体培养基37 ℃过夜培养。将对数生长期的种子液按5%(体积分数)接种到100 mL发酵培养基,28 ℃、200 r/min发酵培养24 h。
1.2.2 酶活测定方法
1.2.2.1 胆固醇酯酶酶活测定方法
胆固醇酯酶酶活测定方法参考文献[12],反应体系由0.11 mol/L磷酸钾缓冲液、0.2 mmol/L胆固醇亚油酸酯、1.5 mmol/L 4-氨基安替吡啉、22 mmol/L苯酚、10 U/mL胆固醇氧化酶(cholesterol oxidase,COD)、5.1 U/mL辣根过氧化物酶(horseradish peroxidase, POD)组成,反应在37 ℃下进行,于500 nm下测定3~4 min的变化值,绘制成曲线后计算线性部分每分钟OD变化值,如公式(1):
酶活/(U·mL-1)=
ΔOD/min×4.282×df
(1)
式中:△ODtest、△ODblank表示样品与空白在500 nm下的吸光值;OD/min表示每分钟内OD的变化值;Vt表示反应体系总体积,2.95 mL;Vs表示样品体积,0.1 mL;df表示稀释倍数。
1.2.2.2 解脂能力测定方法
采用脂肪酶的测定方法分析解脂能力,选取三酰基甘油酯和对硝基苯酯为底物。具体方法参考文献[13]。
1.2.3 胆固醇酯酶的纯化
取BurkholderiacepaciaZWS15发酵液在4 ℃、8 000 r/min离心5 min取上清,即得粗酶液;(NH4)2SO4沉淀后,重溶于50 mmol/L的Tris-HCl缓冲溶液(pH 7.5)中,并用相同的缓冲溶液透析过夜;使用pH 7.5、50 mmol/L的Tris-HCl缓冲液平衡DEAE离子交换柱,上样后用含有1 mol/L NaCl的同样缓冲液以1 mL/min 的流速进行线性洗脱,对紫外检测到的峰值进行收集。
1.2.4 蛋白浓度的测定及聚丙烯酰胺凝胶电泳
以牛血清白蛋白为标准,参考Bradford的方法测定蛋白质浓度。
SDS-PAGE凝胶电泳采用5%的浓缩胶与12%的分离胶,具体配置方法参照索莱宝SDS-PAGE试剂盒。
1.2.5 飞行时间质谱分析
切下SDS-PAGE中需要验证的目的条带,使用MALDI-TOF/TOF(matrix-assisted laserdesorption/ionization time of flight mass spectrometry)基质辅助激光解析电离串联飞行时间质谱仪,根据文献[13]中所述方法,测定目的条带中肽段质量,将结果与数据库中已有序列进行比对。
2 结果与分析
2.1 B. cepacia胞外胆固醇酯酶的分离提取
B.cepacia在葡萄糖作为唯一碳源、卵磷脂作为诱导物的液体培养基中进行发酵,获得的发酵液在4 ℃、8 000 r/min离心5 min,取上清即为所需的粗酶液。使用饱和度为70%的(NH4)2SO4沉淀粗酶液,过夜透析, DEAE离子层析,结果如表1所示,得到比酶活为32.94 U/mg的纯酶,纯化倍数为39倍,回收率为17.78%。
收集纯化各步样品进行SDS-PAGE蛋白电泳分析,结果如图1所示,获得单一的条带,SDS-PAGE检测表明该纯酶分子质量约为37 kDa。

表1 B. cepacia胆固醇酯酶的各步纯化分析Table 1 Purification of cholesterol esterase from Burkholderia cepacia
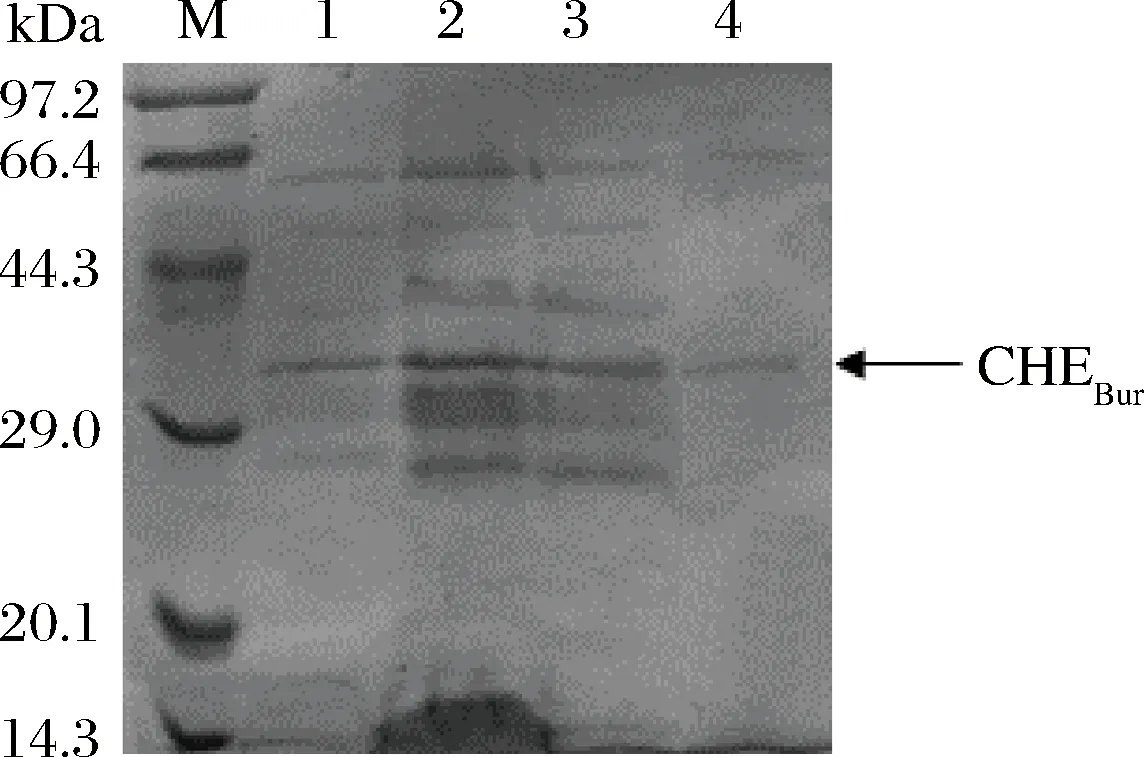
M-marker;1-发酵粗酶液;2-70%(NH4)2SO4沉淀;3-透析24 h;4-DEAE阴离子交换层析图1 胆固醇酯酶各步纯化的SDS-PAGE图Fig.1 SDS-PAGE of B. cepacia cholesterol esterase after purification
2.2 B. cepacia胆固醇酯酶的酶学性质测定
2.2.1 胆固醇酯酶的最适pH和pH稳定性分析
在不同的pH缓冲溶液中,于37 ℃测定CHEBur降解胆固醇油酸酯的残留酶活,用于稀释酶液的缓冲液体系包括:0.2 mol/L醋酸钠缓冲液(pH 3.0~5.5)、 0.2 mol/L磷酸钾缓冲液(pH 5.5~7.5)、0.2 mol/L Tris-HCl缓冲液(pH 7.5~9.0)、0.2 mol/L Na2CO3-NaHCO3(pH 9.0~11.0)、0.2 mol/L NaOH-NaCl(pH 11.0~12.0)。纯化后CHEBur的pH稳定性和最适pH在图2中呈现。CHEBur在pH 5.5~9.0 保持稳定(图2-a)。放置16 h后,酶活最大残留率出现在pH值为8.0的条件下。该酶的最适反应pH值在7.5 ~9.0(图2-b)。
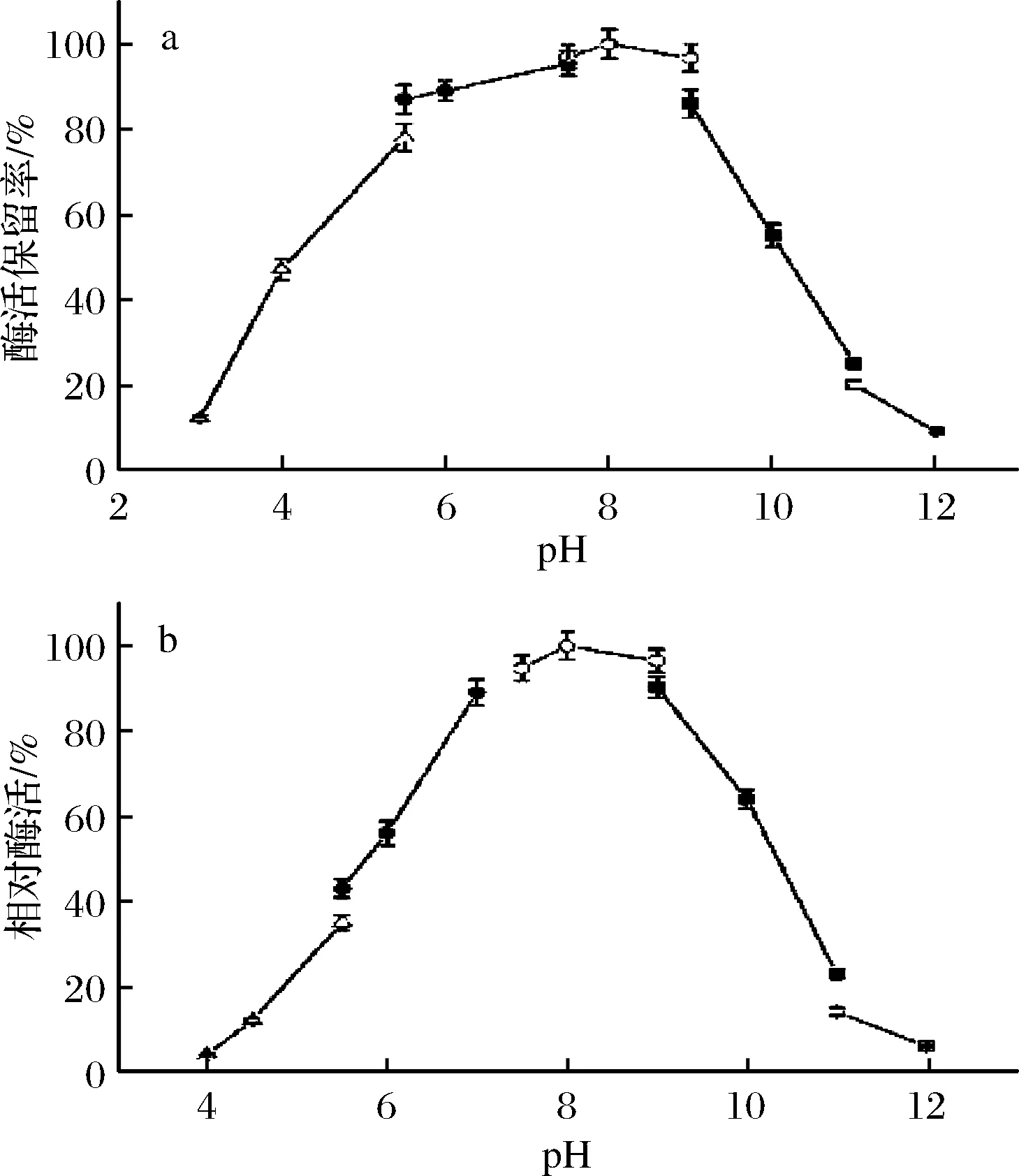
a-胆固醇酯酶的pH稳定性(在25 ℃、不同pH条件下温育16 h);b-胆固醇酯酶的最适反应pH图2 pH对胆固醇酯酶活性及稳定性的影响Fig.2 Effects of pH on activity and stability of B. cepacia cholesterol esterase
2.2.2 胆固醇酯酶的最适温度和温度稳定性分析
以胆固醇油酸酯为底物,在pH 7.0、0.2 mol/L磷酸盐缓冲体系中,不同温度下测定残留的胆固醇酯酶活性。CHEBur在20~60 ℃维持稳定,放置2 h能保留90%以上的酶活,具有显著的耐热性(图3-a)。该酶在pH 7.0的条件下最适反应温度为40 ℃(图3-b)。
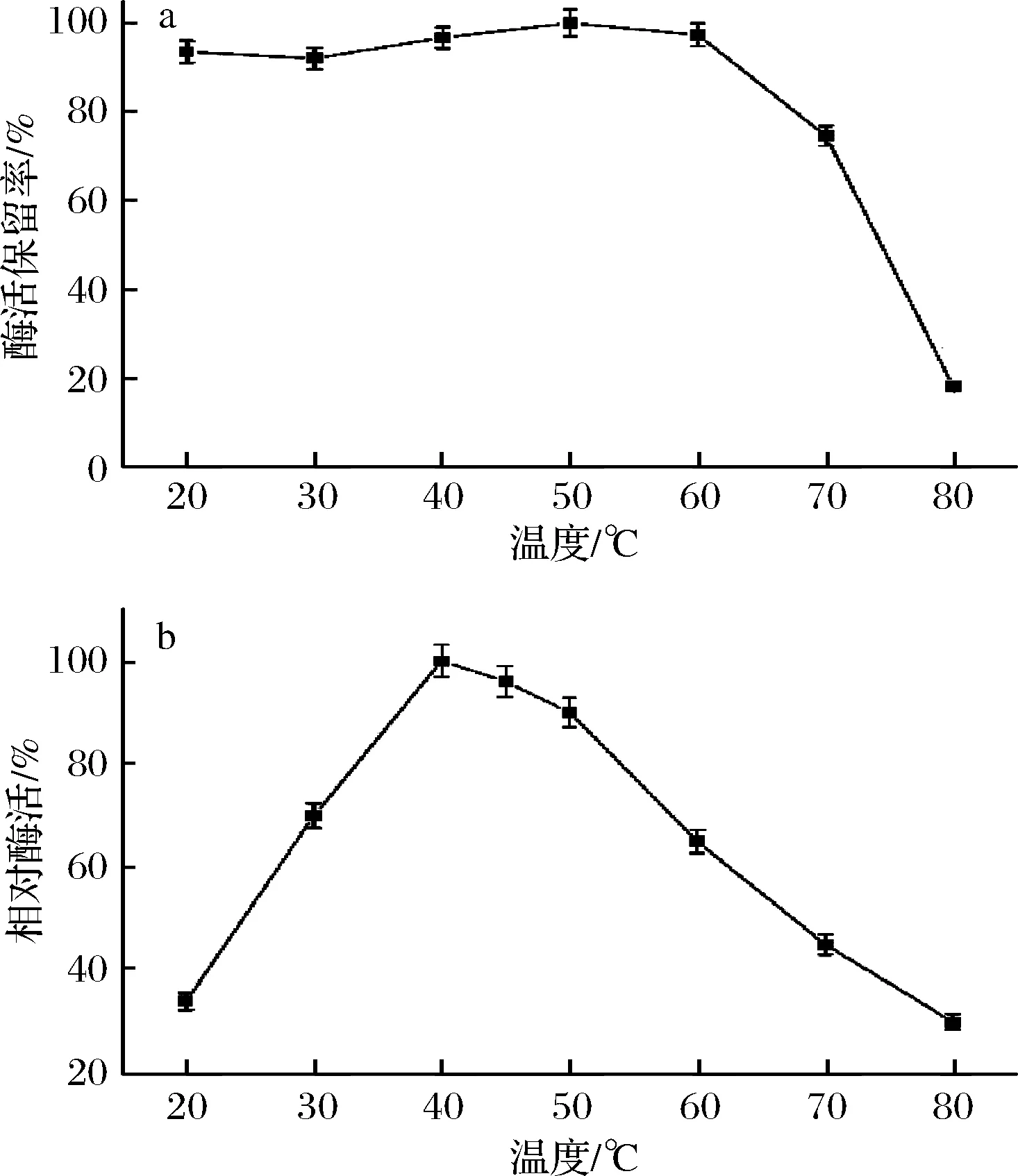
a-胆固醇酯酶的温度稳定性(使用pH 7.0、0.2 mol/L的磷酸钾缓冲液稀释酶液,不同的温度条件下温育2 h); b-胆固醇酯酶的最适反应温度图3 温度对胆固醇酯酶活性及稳定性的影响Fig.3 Effects of temperature on activity and stability of B. cepacia cholesterol esterase
目前已报道的CHE最适反应温度大部分都在37~45 ℃,与本文实验测得数值相似。BurkholderiacepaciaST-200来源[14]的CHE,在65 ℃温育30 min保留95%以上酶活,而在70 ℃酶活残留率仅为10%左右。本文CHEBur在70 ℃温育2 h后,酶活残留率维持在70%以上,具有更好的温度耐受性。
2.2.3 表面活性剂对B.cepacia胆固醇酯酶稳定性的影响
工业生产中会考虑加入一些表面活性剂去除难除去的杂质,但同时表面活性剂会引起酶构象的改变,影响酶的活性,要求酶蛋白具有一定的表面活性剂耐受性[15]。本实验选取常用的吐温类表面活性剂和曲拉通研究CHEBur稳定性,结果如表2所示,实验均进行3次平行。
将酶液与不同的表面活性剂混合置于37 ℃下1 h后,使用胆固醇油酸酯作为底物测定混合后残留的酶活。实验组的残留酶活均大于对照组,添加适量的表面活性剂能够明显的促进CHEBur对底物的水解作用。当体系中含有5%(体积分数)的表面活性剂时,与对照组相比,曲拉通X-100、吐温60和吐温80处理过的CHEBur仍能维持1倍以上的酶活,曲拉通X-100对CHEBur的激活作用最为明显。
2.2.4 有机溶剂对B.cepacia胆固醇酯酶稳定性的影响
污水处理、制浆造纸和皮革织物脱脂处理中不仅可能存在会影响酶活性的表面活性剂,大多还含有高浓度的有机溶剂[16]。考察常用有机溶剂对CHEBur酶活的影响很有必要本实验选用了5种亲水性有机溶剂及11种疏水性有机溶剂,分别测定了其与CHEBur混合后酶活的变化(结果未列),选择其中CHEBur较耐受的9种有机溶剂,考察不同的体积分数(0、15%、30%、50%)有机溶剂对CHEBur水解胆固醇油酸酯稳定性的影响(表3)。
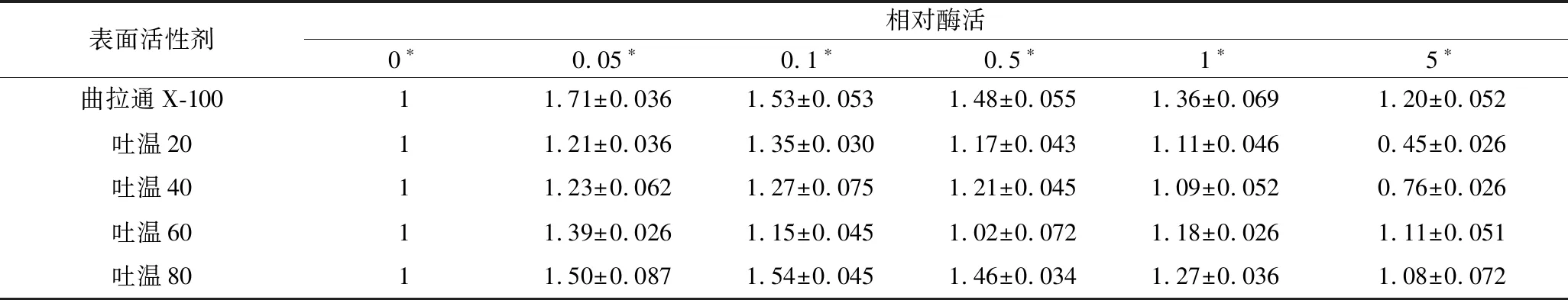
表2 不同浓度的表面活性剂对B. cepacia胆固醇酯相对酶活性的影响Table 2 Effects of detergent contents on the activity of B. cepacia cholesterol esterases
注:*为混合体系中不同种类表面活性剂的体积分数。所有数据取3次实验平均值。下同。
相较于未添加有机溶剂的组,体系中含有15%(体积分数)的有机溶剂能提高CHEBur相对酶活≥2倍,石油醚甚至能达到2.5倍左右。在50%有机溶剂存在下,仅DMSO、甲苯和正辛烷出现减弱现象,酶活残留率维持在1倍左右,其余试剂仍能激活酶的水解能力,且乙醇和环己烷能达到1.25和1.21倍的效果。可见该酶对有机溶剂有较强耐受性,与对照组相比,在50%(体积分数)有机溶剂存在下仍然具有较高酶活。
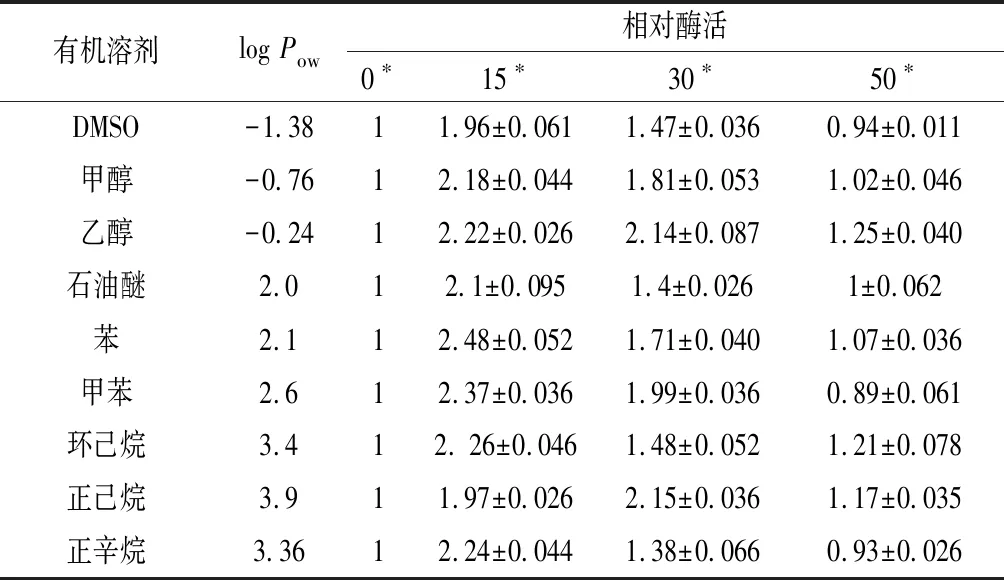
表3 不同浓度的有机溶剂对B. cepacia胆固醇酯酶活性的影响Table 3 Effects of organic solvents on the activity of B. cepacia cholesterol esterases
注:*为混合体系中不同种类有机溶剂的体积分数;亲水对照使用1 mL、pH 7.0、0.2 mol/L的磷酸钾缓冲液稀释2 mL CHEBur,疏水对照为2 mL CHEBur,样品使用1 mL有机溶剂与2 mL CHEBur混合。
2.3 B. cepacia胆固醇酯酶的肽谱分析
将SDS-PAGE上的单一条带切割用于飞行时间质谱鉴定,确定该蛋白的分子质量及具体信息。MALDI-TOF的结果如图4所示,经过系统比对得到匹配度较高的两个蛋白分别为三酰基甘油脂肪酶(lipase)与胆固醇酯酶(cholesterol esterase)。
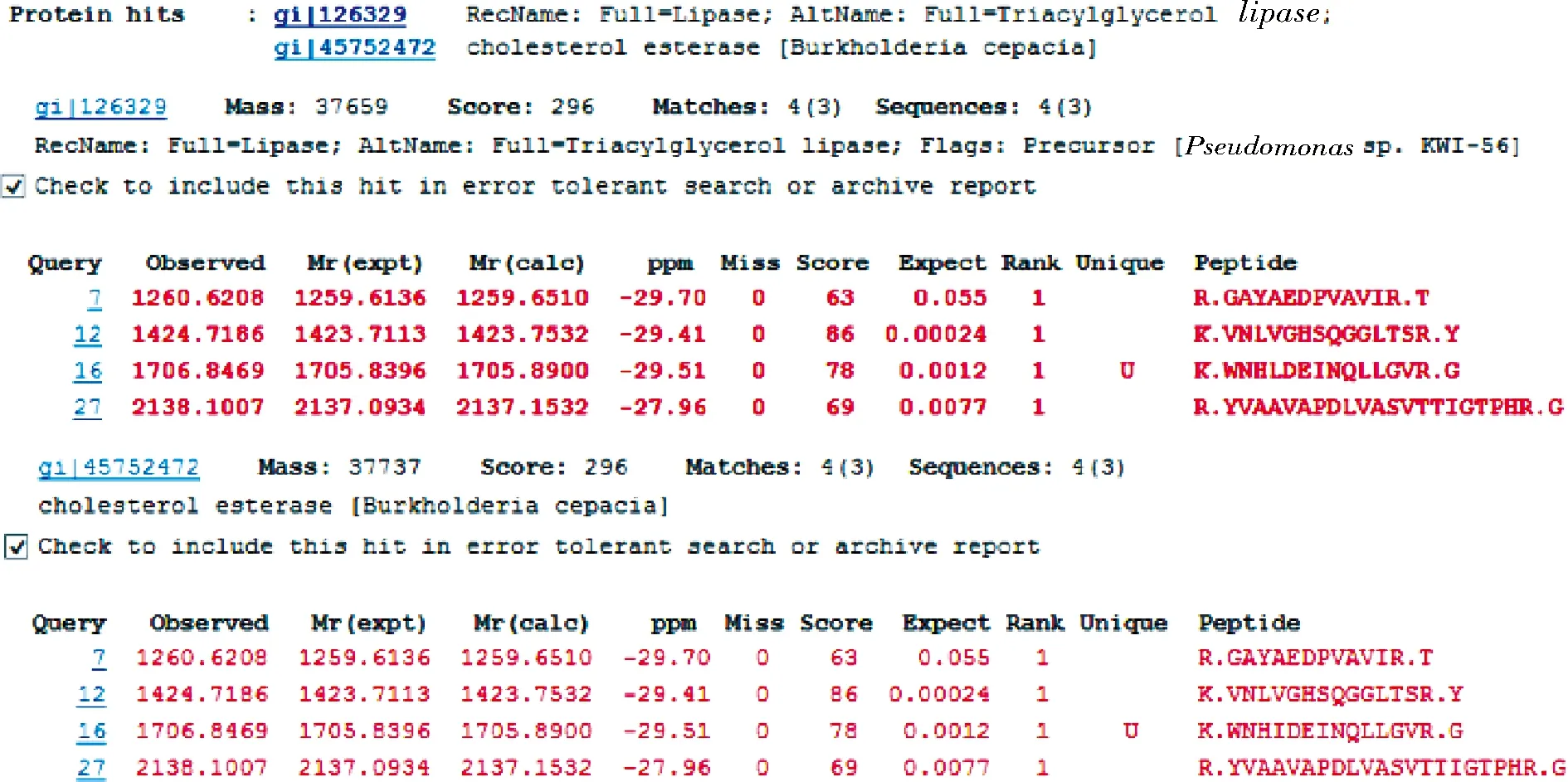
图4 纯化后胆固醇酯酶的飞行时间质谱结果Fig.4 Flight mass spectrometry identification of B. cepacia cholesterol esterase after purification
其中lipase来源于Pseudomonassp. KWI-56,GenBank号为P25275,分子质量为37 659 Da,有4个肽段与样品完全重合;胆固醇酯酶来源于Burkholderiacepacia,GenBank号为BAD13379,分子质量为37 737 Da,与lipase一样有4个肽段与样品完全重合。根据GenBank号在NCBI中获得全部的序列,经过DNAMAN比对后,发现CHEBur与两种蛋白同源性高达90%以上。根据以上两个匹配度较高的蛋白分类,推测该CHEBur可能同时具有胆固醇酯酶特性和解脂特性。
2.4 胆固醇酯酶与商品化酶的酯酶活性和解脂能力的比较分析
CHE通常以胆固醇酯类物质为底物,解脂作用通常以三酰基甘油酯类和对硝基苯酯类为底物。为了研究该酶的酯酶特性和解脂特性,本实验选用CHEBur与3种商品化酶(蓝园Pseudomonassp. CHE、天野微生物来源的lipase和动物胰脏源的lipase),重点比较它们的胆固醇酯酶活性和解脂能力。按照1.2.2 的方法测定各活性,进行3次平行实验,结果列举在表4中。
考察胆固醇酯酶活性,选取4种胆固醇酯类底物,水解能力高低为:胆固醇油酸酯(18∶1)>胆固醇亚油酸酯(18∶2)>胆固醇苯甲酸酯>胆固醇辛酯(8∶0), 对胆固醇油酸酯的活性最高,达到1 038 U/L,该底物酰基残基为18∶1,胆固醇辛酸酯的活性最低,仅有294 U/L,胆固醇辛酸酯的酰基残基为8∶0,可以看出CHEBur在水解选用的几种底物时,对长链胆固醇酯类底物水解能力最强。
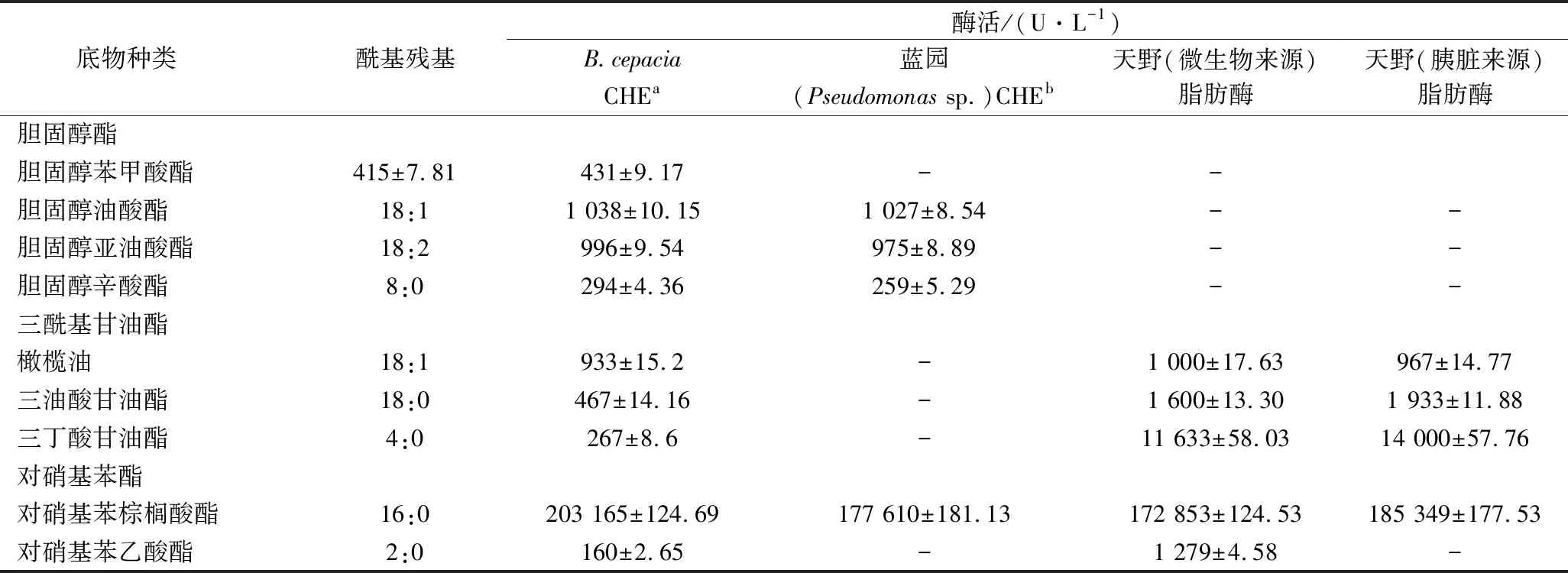
表4 B. cepacia胆固醇酯酶对不同底物的水解能力及与商品化酶的比较Table 4 Hydrolysis ability of B. cepacia cholesterol esterase with different substrate and comparison with commercial enzymes
注:a为本实验发酵得到的胆固醇酯酶,分子质量为37 kDa;b为来源于Pseudomonassp.的胆固醇酯酶,分子质量为300 kDa。“-”表示没有检出。
考察解脂能力,选取三酰基甘油酯类底物和对硝基苯酯类底物来表征。CHEBur水解三酰基甘油酯类底物的顺序为:橄榄油(18∶1)>三油酸甘油酯(18∶0)>三丁酸甘油酯(4∶0)。CHEBur水解对硝基苯酯类底物的顺序为:对硝基棕榈酸酯(16∶0)>对硝基乙酸酯(2∶0)。说明CHEBur同样对长链三酰基甘油酯类底物和对硝基苯酯类底物水解能力最强。
综上所述,B.cepacia所产CHE既能降解胆固醇酯类底物,也具有解脂活性。
3 结论
本文以课题组筛得的BurkholderiacepaciaZWS15(保藏号为CCTCC M2017661)所产CHE为研究对象,在(NH4)2SO4沉淀和DEAE离子交换后获得分子质量为37 kDa的纯酶,该酶比酶活为32.94 U/mg,纯化倍数为39倍。该酶的最适反应pH为7.5~9.0,在pH 5.5~9.0保持稳定;最适反应温度为40 ℃, 70 ℃温育2 h后仍能保留70%以上的酶活,具有显著的耐热性;该酶还具有良好的表面活性剂与有机溶剂耐受性,5%表面活性剂(吐温60、吐温80和曲拉通X-100)和50%有机溶剂(DMSO、甲醇、乙醇、石油醚、苯、甲苯、环己烷、正己烷和正辛烷)对其具有一定的酶活作用。经过飞行时间质谱的肽段同源性比对分析及底物水解实验,确定该酶属于具有解脂作用的胆固醇酯酶,既有胆固醇酯酶活性,又有解脂能力,且对长链底物具有明显的偏好性。该酶的优良性能可为食品、临床诊断、污水处理、制浆造纸工业、织物脱脂等提供新型的酶制剂,具有很大的商业价值。
