轻微加工即食对虾优势腐败菌鉴定及碳源代谢动力学
2019-08-12王晓晋郭全友姜朝军
王晓晋 郭全友 姜朝军
(1中国水产科学研究院东海水产研究所 农业部海洋与河口渔业重点开放实验室 上海 200090
2上海海洋大学食品学院 上海 201306)
南美白对虾(Penaeus vannamei Boone)年产88万t,每年以7.74%的涨幅增长[1],与其它食品原料相比,具有水分高,肉嫩,易消化等特点,深受消费者喜爱。轻微加工水产品 (Lightly preserved fish products)常指低盐(盐度<6%)、高 pH(pH>5.0)、添加少量防腐剂(如山梨酸脂等)、真空包装和低温流通的一类水产品[2]。即食南美白对虾采用低温干燥、温和杀菌和真空包装等轻微加工手段,具有水分含量高,质地柔软、口感好等优点,符合人们追求新鲜、天然、营养和健康的需求,具有广阔的市场前景和显著的经济效益。然而也存在腐败菌残留和增殖的潜在风险,贮藏过程中可能会发生胀袋变质,因此探究优势腐败菌种类及生长代谢规律至关重要。
国内外对食品优势腐败菌的分离、鉴定研究较多,如娄永江等[3-4]用传统微生物检测法和PCR测序法,确认真空包装即食海蜇及鲍汁的优势腐败菌为芽孢杆菌、假单胞菌和腐败希瓦氏菌等。Jiang等[5]使用PCR-DGGE和RT-PCR技术研究切片包装猪肉冷藏期间微生物群落组成变化,确定优势腐败菌为假单胞菌,而对轻微加工即食水产品中腐败菌的研究较少。微生物脂肪酸鉴定法及测序法是广为应用的鉴定法[6]。MIDI脂肪酸鉴定系统通过将未知细菌细胞膜脂肪酸种类和含量(C9~C20)与已知细菌脂肪酸数据库进行比对,可鉴定2 000多种微生物,并在微生物脂肪酸特征研究中具有较广泛应用。杨超等[7]利用脂肪酸鉴定技术区分两种不动杆菌,显示脂肪酸18∶1ω9与18∶2ω6,9间的比例,被认为是一种厌氧菌的特征指标[8]。测序法是基于不同种属微生物的序列保守性进行的分子生物学鉴定,常作为生物进化过程的标尺揭示细菌分类的系统发育[9]。例如:潘康成等[10]采用测序法区分3株芽孢杆菌。MIDI与测序法相比各有特点,常采用多项法对微生物菌株进行鉴定,微生物群落及生长特性等探究[11-12]。
食品微生物生长代谢与其环境条件密切相关,通过改变环境条件对目标微生物进行调控,实现微生物生长/非生长之间的转化,如地衣芽孢杆菌在NaCl质量分数大于3%的营养肉汤中,低于30℃或高于40℃时急剧骤减[13]。微生物能源利用种类(如碳源、氮源和生长因子等)也是重要影响因素之一。碳源代谢测定有微生物培养法、呼吸法和酶活性检测法等,这些方法存在培养条件难控制,操作复杂和消耗较大等问题[14]。Biolog GENⅢ微孔板,通过微生物对特定底物的代谢,产生自由电子,与四唑盐发生显色还原反应,形成可识别的代谢指纹,分析微生物对单一碳源的代谢能力(Sole Carbon Source Utilization,SCSU),能实时监测吸光度变化来表征其生理特征,具有方便和省时等特点[15]。微生物碳源代谢能力及其动力学受菌种和外界环境的影响,常用积分面积和动力学模型表征。采用微生物生长模型能预测腐败菌代谢速率。朱彦祺等[17]对3种预测模型修正Logistic、修正Gompertz及Baranyi方程进行对比,结果修正的Gompertz模型对微生物生长代谢曲线拟合度最佳。
本文在对轻微加工即食对虾加工工艺研究的基础上,对常温贮藏制品品质特征及货架期终点时的优势腐败菌进行分离纯化,采用菌落形态、细胞脂肪酸和测序等多项鉴定法,16SrRNA序列结合MIDI脂肪鉴定系统确定优势腐败菌,并用Biolog GENⅢ微孔板培养法测试其不同碳源代谢能力,用修正的Gompertz模型对代谢动力学进行拟合,为靶向抑制水产品优势腐败菌和改进产品配方提供理论依据。
1 材料与方法
1.1 主要材料、试剂与仪器
新鲜南美白对虾购自某水产市场,活虾运达宁德市某水产公司进行试制。工艺流程:鲜活对虾或冻虾→预煮→脱壳去肠腺→调味→轻微干燥(微波干燥、95℃)→真空包装→红外线二次杀菌(95℃、20 min)→快速冷却,将成品放入高精度培养箱 (25±1)℃贮藏,对南美白对虾制品初始及贮藏9个月的品质进行测定。
营养琼脂培养基(BR)、革兰氏染液,上海国药集团化学试剂有限公司;BUG培养基,美国Biolog公司;PCR扩增试剂盒、细菌基因组DNA提取试剂盒,生工生物工程(上海)股份有限公司。
Biolog微生物鉴定仪,美国Biolog公司;MIDI微生物脂肪酸鉴定仪,美国安捷伦公司;PCR扩增仪(PCR System 9700),美国 ABI公司;UVP 凝胶成像仪(GelDoc-It),美国 UVP 公司。
1.2 试验方法
1.2.1 品质指标测定 水分含量采用PMB-35水分分析仪测定;水分活度用台式水分活度仪(AW LAB-Touch PMB35)测定;pH 采用酸度计(pHS-3C)测定;NaCl含量参照GB/T 12457-2008测定;TVBN(挥发性盐基氮):参照 SC/T 3032-2007测定;TBA(硫代巴比妥酸):参照马丽珍法[18]测定。菌落总数和商业无菌:参照GB 4789.2-2010和GB4789.26-2013测定。
1.2.2 优势腐败菌的分离与纯化 取货架期终点发生胀袋的即食对虾,无菌室开袋称量10 g加入90 mL生理盐水,加塞密封,震荡5 min,10倍稀释至合适梯度,涂布于营养琼脂平板上。在30℃恒温培养(72±3)h(参考 GB 4789.2-2010),选取菌落分布均匀的平板,依据菌落形态进行分组,并分离纯化。
1.2.3 菌株鉴定 MIDI脂肪酸鉴定[19]:①挑取分离所得菌在营养琼脂上进行4区划线28℃恒温培养24 h,挑取菌落活性较好的第3区菌落称量40 mg(湿重),通过皂化、甲基化、萃取、洗涤等步骤获取含有细菌脂肪酸的萃取液;②采用气相色谱仪结合氢火焰离子化检测器及MIDI分析系统分析测试结果。
16SrRNA序列鉴定[20]:提取基因组DNA,挑取菌落于营养肉汤中25℃过夜培养。取该菌液1.5 mL于EP管中,5 000 r/min离心5 min,按照试剂盒步骤提取菌株DNA,并进行PCR序列扩增,将所得序列送往生工生物工程(上海)股份有限公司测序。
1.2.4 碳源代谢测定 将所得菌株在BUG培养基上33℃培养24 h。按照Biolog微生物鉴定芽孢杆菌处理步骤[21]:采用干管分散法,用接菌棒挑取菌落于无菌试管中上、下滑动使得菌体分散,滴加少量接种液,混匀,加入IF接种液中,调节浊度为(95±3)%。 倒入V型槽,加入GENⅢ 微孔板,25℃培养40 h,间隔2 h测量吸光值。
1.3 优势腐败菌代谢能力计算及动力学模型构建
1.3.1 优势腐败菌不同碳源代谢 参照郑华等[21]的分类方法,将BilogGENⅢ 微孔板板的碳源分为4类,包括糖类、羧酸类、氨基酸类、脂肪酸/酯类。采用积分面积与修正Gompertz模型对碳源代谢能力和代谢动力学进行分析。
1)GENⅢ微孔板中总体碳源代谢能力分析采用平均颜色变化率(AWCD)[22]公式计算:

式中:C——测试孔吸光值;C0——对照孔吸光值;n——测试碳源总孔数。
2)碳源代谢能力采用积分面积S[23]表示:
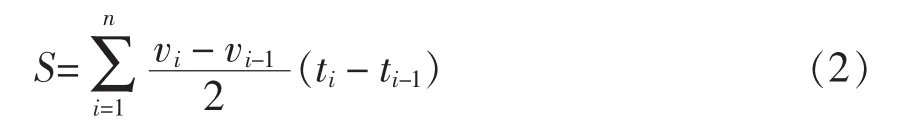
式中:vi——i时的吸光值;ti——时间,h。
1.3.2 生长代谢动力学模型构建 GENⅢ 微孔板中不同孔碳源代谢变化的吸光值(OD),采用修正的Gompertz模型[23]进行拟合:

式中:t——时间,h;Yt——t时 (C-C0) 值;λ——迟滞期,h;μmax——颜色变化最大比生长速率,h-1;e——2.718;A——最小吸光值;C——最大OD值和最小OD值之差。
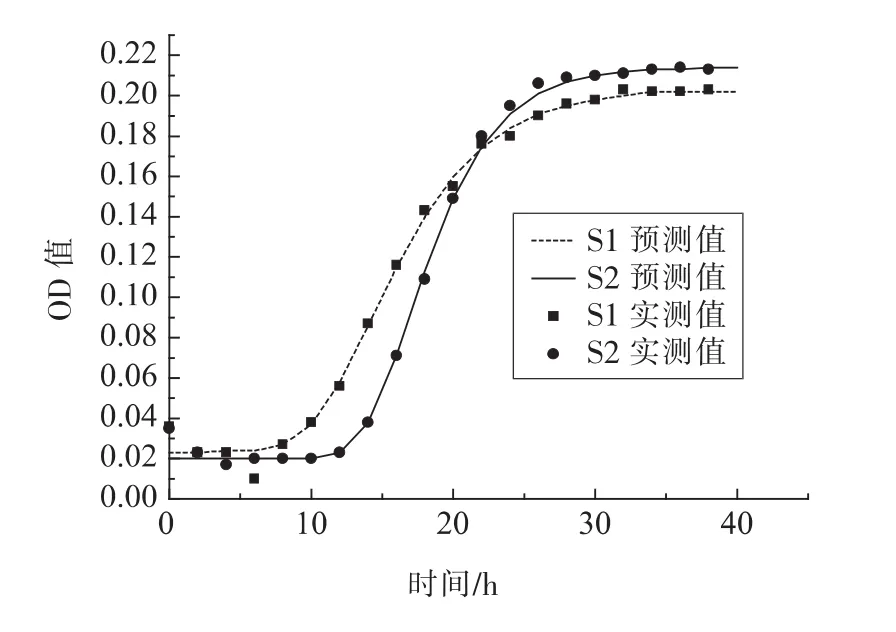
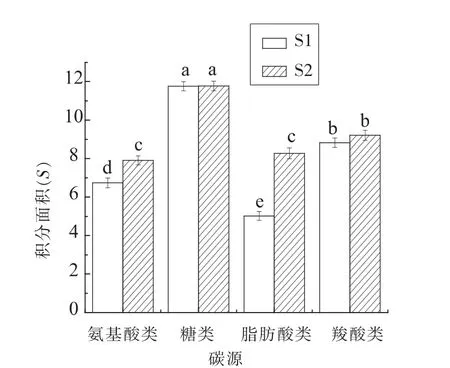
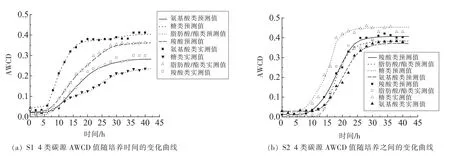
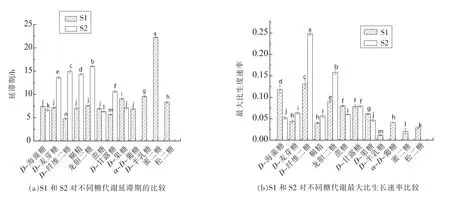
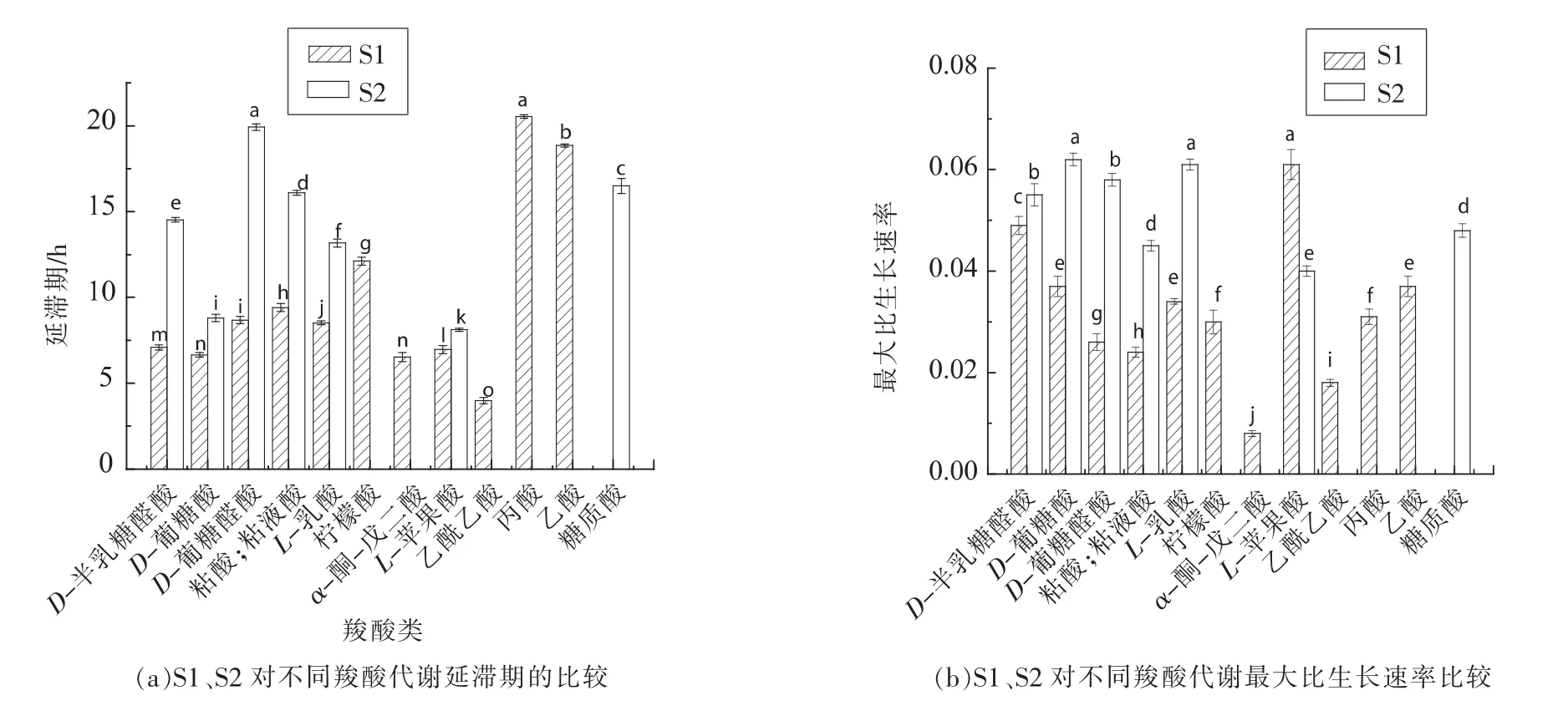
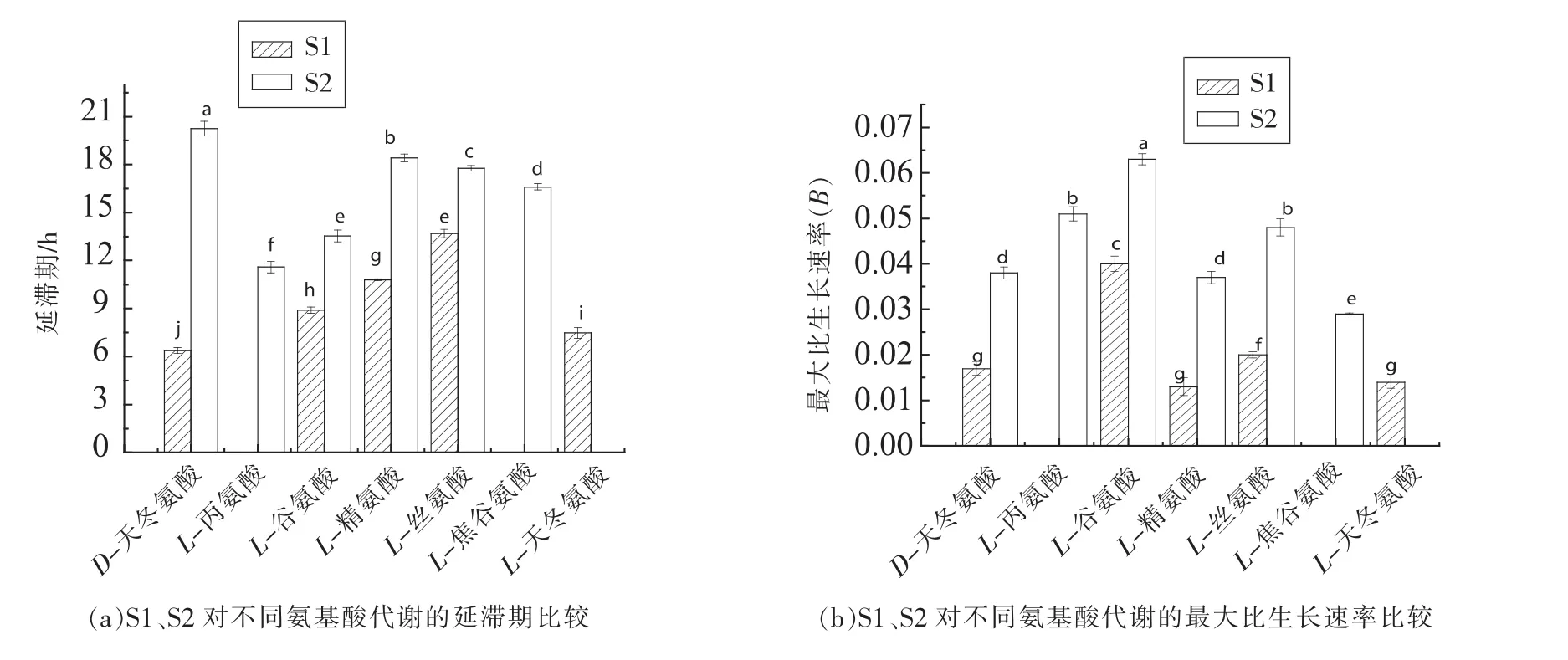
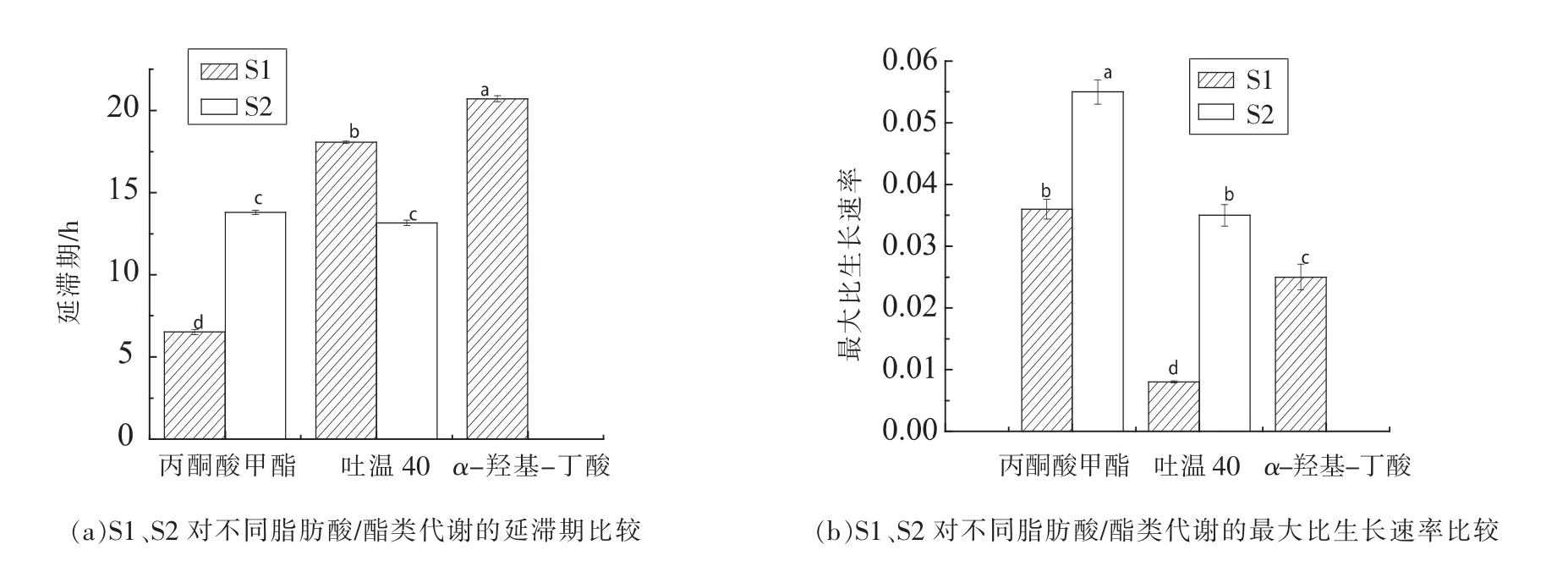
1.3.3 模型拟合评价 采用拟合优度(R2)、均方误差(MSE)、准确度(Af)、精确度(Bf)对拟合模型评价。 R2(0 16SrRNA测序结果使用Blast比对,采用MEGA6.06构建系统发育树。采用SPSS18.0(PASW Statistics,inc)对不同时间测得的Biolog各孔的吸光值按照 Gompertz模型进行拟合,采用OriginPro 8.0分析数据。代谢参数的比较采用最小显著性差异法,P<0.05时的差异显著。 表1为轻微加工即食对虾常温 【(25±1)℃】贮藏初始和贮藏9个月时的品质特征。轻微加工即食的水分高(约50%),盐分低(≤3.00%),符合人们的消费需求。其Aw<0.93,利于抑制芽孢杆菌的生长,产品达到商业无菌要求。 表1 轻微加工即食对虾品质特征变化Table1 The quality characteristics change of lightly preserved ready-to-eat shrimp 优势腐败菌包括两种形态的菌株S1和S2,分别占55%和35%。S1呈圆形,乳白色,较小,边缘整齐,表面光滑,革兰氏阳性,杆菌,有芽孢;S2呈叶状,边缘乳白色,表面褶皱,革兰氏阳性,杆菌,有芽孢。16S rRNA系统发育树(图1)显示,S1与地衣芽孢杆菌,S2与枯草芽孢杆菌的同源性分别为100%,99%。MIDI脂肪酸测试结果显示,S1与地衣芽孢杆菌,S2与枯草芽孢杆菌的相似指数分别为 0.411±0.0200,0.842±0.011,与刘国红[24]对地衣芽孢杆菌、枯草芽孢杆菌的脂肪酸测试结果基本一致,见表2。 图1 16S rRNA序列系统发育树Fig.1 Phylogenetic tree of 16S rRNA sequences 表2 脂肪酸指纹测试结果Table2 The results of fatty acid fingerprint test 2.3.1 可利用碳源代谢种类 Biolog仪器显示结果,S1与S2可利用的糖类有D-海藻糖、D-麦芽糖、D-纤维二糖、糊精、龙胆二糖、蔗糖、D-甘露糖及D-果糖,其中S1还可利用α-D-葡糖、D-半乳糖、蜜二糖、松二糖。二者可利用的氨基酸有D-天冬氨酸、L-谷氨酸、L-精氨酸、L-丝氨酸。S2还可利用L-焦谷氨酸、L-天冬氨酸、L-丙氨酸。二者可利用的羧酸有D-半乳糖醛酸、D-葡糖酸、D-葡糖醛酸、粘酸、L-乳酸、L-苹果酸。S1可利用D-苹果酸、柠檬酸、乙酰乙酸、丙酸、乙酸、α-酮戊二酸,S2还可利用糖质酸。二者可利用的脂肪酸/酯类有丙酮酸甲酯、吐温40,S1还可利用α-羟基-丁酸。 2.3.2 总体碳源代谢AWCD曲线 AWCD是表征微生物对碳源代谢强度的一个重要指标,不同微生物对单一碳源代谢能力不同[21]。图2为S1与S2的碳源代谢动力学曲线,二者代谢延滞期λS1(9.708h±0.513h)<λS2(13.939h±0.116h),而二者的最大比生长速率 μmaxS1(0.015±0.002)与 μmaxS2(0.022±0.003),积分面积 SS1(5.109±0.513)与 SS2(4.894±0.433)之间差异性不显著(P>0.05)。 二者在25℃培养30 h时达到稳定期,这与地衣芽孢杆菌在25℃营养肉汤中达到稳定期所需时间一致[14]。可见,地衣芽孢杆菌的延滞期较枯草芽孢杆菌短,而二者的最大比代谢速率及积分面积接近,表明二者碳源总体代谢能力相似。 2.3.3 4类碳源代谢能力比较 图3显示S1与S2对4类碳源的代谢状况。S1代谢能力依次为S糖类(11.774±0.251)>S羧酸(9.213±0.259)>S氨基酸(7.909±0.233h)>S脂肪酸/酯类(5.023±0.227)。S2 代谢能力依次为 S糖类(11.762±0.226)>S羧酸(8.823±0.249)>S脂肪酸/酯类(8.274±0.254)>S氨基酸(7.909±0.251),这与木糖葡萄球菌的碳源代谢能力一致[16]。可见,二者对糖类和羧酸的代谢能力都较强,且代谢能力差异性不显著(P>0.05),而二者对脂肪酸/酯类及氨基酸的代谢能力差异性显著(P<0.05),S1对氨基酸与脂肪酸/酯类的代谢能力明显弱于S2。 图2 AWCD值随培养时间的变化曲线Fig.2 The curve of average well color development value along with the change of incubation time 图3 不同碳源代谢的代谢情况Fig.3 The different metabolic capacity in carbon source 表3为S1与S2的碳源代谢曲线拟合结果评价,可见,修正的Gompertz模型对碳源代谢曲线拟合良好,微生物碳源代谢曲线均呈现S型 (图4),存在明显的延滞期(Lag phase)、指数增长期(Growth phase)和稳定期(Stationary phase)。 不同腐败菌对不同碳源代谢状况不同,同一微生物对不同碳源的代谢状况亦不同,代谢曲线动力学参数是反映代谢过程的直观因子[16]。延滞期(λ)和最大比生长速率(μmax)是反映微生物生长代谢的重要参数,延滞期越短,最大比生长速率越高,对碳源代谢速率越强。 表3 代谢曲线拟合评价Table3 The evaluation of the metabolic fitted curve 图4 4类碳源AWCD值随培养时间变化情况Fig.4 Variation of AWCD value of four carbon sources with culture time 2.4.1 糖类代谢动力学分析 图5为S1与S2对糖类的代谢参数。可知,S1的延滞期除糊精、蔗糖、ɑ-D-葡糖、D-麦芽糖、D-海藻糖及龙胆二糖外,其它糖类间都存在显著性差异(P<0.05),顺序依次为 λ蜜二糖(22.282h ± 0.136h)>λD-半乳糖(9.56h ± 0.152h)>λD-果糖(9.06h±0.187h)>λ松二糖(8.308h±0.2h)>λD-甘露糖(5.68h±0.112h)>λD-纤维二糖(4.816h±0.233h)。其最大比生长速率存在显著性差异(P<0.05),且顺序依次为 μmaxD-纤维二糖(0.131±0.0103)>μmaxD-海藻糖(0.118 ± 0.0089)>μmax龙胆二糖(0.091 ± 0.0035)>μmax蔗糖(0.08±0.0002)>μmaxD-甘露糖(0.079±0.0037)>μmaxD-果糖(0.061±0.001)>μmaxD-麦芽糖(0.044±0.002)>μmaxα-D-葡糖(0.041±0.002)>μmax糊精(0.004±0.001)>μmax松二糖(0.029±0.00275)>μmax蜜二糖(0.021±0.006)>μmaxD-半乳糖(0.01175±0.0010)。 S2对不同糖的延滞期存在显著性差异 (P<0.05),代谢延滞期顺序依次为 λ龙胆二糖(16.022h±0.111h)>λD-纤维二糖(14.935h ± 0.311h)>λ糊精(14.357h ±0.212h)>λD-麦芽糖(13.638h± 0.211h)>λD-甘露糖(10.628h±0.234h)>λD-果糖(7.095h±0.165h)>λD-海藻糖(6.645h±0.235h)>λ蔗糖(6.296h±0.135h)。 其代谢曲线的最大比生长速率除D-纤维二糖(0.248±0.003)、龙胆二糖(0.158±0.005)存在显著性差异,其它均不存在显著性差异(P>0.05)。可见,S2对D-麦芽糖、D-纤维二糖、糊精、龙胆二糖及D-甘露糖的延滞期与最大比生长速率均高于S1,说明S2适应环境的时间长,在其适应环境后生长迅速。而D-海藻糖、蔗糖、D-果糖相反。S1与S2对D-甘露糖的代谢最大比生长速率不存在显著性差异(P>0.05)。 图5 糖类代谢参数的差异Fig.5 The difference between sugar metabolic parameters 2.4.2 羧酸类代谢动力学分析 图6为S1与S2羧酸类代谢曲线。S1对不同羧酸的代谢延滞期存在显著性差异 (P<0.05),延滞期顺序为 λ丙酸(20.533h±0.1h)>λ乙酸(18.85h±0.089h)>λ柠檬酸(12.109h±0.234h)>λ粘酸(9.404h±0.229h)>λD-葡糖醛酸(8.675h ± 0.213h)>λL-乳酸(8.516h ± 0.115h)>λD-半乳糖醛酸(7.088h±0.156h)>λL-苹果酸6.961h±0.231h>λD-葡糖酸6.653h±0.137h>λα-酮-戊二酸6.523h±0.275h>λ乙酰乙酸3.985h±0.174h)。 S1最大比生长速率除D-葡糖酸、乙酸、L-乳酸、丙酸、柠檬酸外,都存在显著性差异(P<0.05)。S1最大比生长速率顺序为 μmaxL-苹果酸(0.061 ± 0.001)>μmaxD-半乳糖醛酸(0.049±0.00179)>μmaxD-葡糖醛酸(0.026±0.00265)>μmax粘酸(0.024±0.0001)>μmax乙酰乙酸(0.018±0.0002)>μmaxα-酮戊二酸(0.008±0.0005)。 S2 对不同羧酸的延滞期存在显著性差异,且顺序依次为λ粘酸;粘液酸(16.093h±0.134h)>λ糖质酸(16.49h±0.432h)>λL-乳酸(13.164h±0.222h)>λL-苹果酸(8.125h± 0.096h)>λD-葡糖酸(8.797h±0.219h)>λD-葡糖醛酸(19.916h±0.198h)>λD-半乳糖醛酸(14.524h±0.131h)。 S2 最大比生长速率μmax D-半乳糖醛酸与 μmax D-葡糖醛酸、μmax D-葡糖酸与 μmax L-乳酸、μmax糖质酸与 μmax粘酸差异性不显著(P>0.05),L-苹果酸与其它羧酸存在显著性差异。可见,S2延滞期及最大比生长速率(除L-苹果酸)均高于S1。两者对粘酸、L-乳酸延滞期较长,而最大比生长速率适中,说明其适应期长,而开始生长后代谢能力相差不大。 图6 羧酸类代谢参数的差异Fig.6 The difference between carboxylic acid metabolic parameters 2.4.3 氨基酸类代谢动力学分析 图7为S1与S2对氨基酸类代谢曲线。由图7可看出,S1的代谢延滞期与最大比生长速率都存在显著性差异(P<0.05),且延滞期顺序为 λL-丝氨酸(13.694h ±0.263h)>λL-精氨酸(10.796h±0.053h)>λL-谷氨酸(8.89h±0.199h)>λL-天冬氨酸(7.468h±0.341h)>λD-天冬氨酸(6.384h ±0.178h),其最大比生长速率除 μmaxD-天冬氨酸、μmaxL-精氨酸、μmaxL-丝氨酸差异性不显著(P>0.05),其它均存在显著性差异。天冬氨酸延滞期短且最大比生长速率较大,可能对S1的生长有促进作用。S2延滞期存在显著性差异,延滞期 λD-天冬氨酸(20.238h±0.455h)>λL-精氨酸(18.413h ± 0.251h)>λL-丝氨酸(17.767h±0.176h)>λL-焦谷氨酸(16.597h±0.198h)>λL-谷氨酸(13.544h ± 0.377h)>λL-丙氨酸(11.591h ±0.356h)。 其 S2 最大比生长速率除 μmaxD-天冬氨酸、μmaxL-精氨酸差异性不显著(P>0.05)外,其它均存在显著性差异。可见,S2对氨基酸的代谢延滞期与最大比生长速率均高于S1。两者对丝氨酸、L-精氨酸的代谢延滞期最长,说明二者适应环境需较长时间。就最大比生长速率而言,L-丝氨酸相对大,L-精氨酸相对小,说明在适应环境后二者对L-丝氨酸的代谢速度较快,对L-精氨酸的代谢速度较慢。 图7 氨基酸类代谢参数的差异Fig.7 The difference between amino acid metabolic 2.4.4 脂肪酸/酯类代谢动力学分析 图8为S1与S2对脂肪酸/酯类的代谢曲线。S1的延滞期存在显著性差异,且顺序为 λα-羟基-丁酸(20.716h ±0.184h)>λ吐温40(18.072h±0.0713h)>λ丙酮酸甲酯(6.511h±0.165h)。最大比生长速率存在显著性差异。 μmax丙酮酸甲酯(0.036 ± 0.00156)>μmaxα-羟基-丁酸(0.025±0.0021)>μmax吐温40(0.008±0.0002)。 S2 对延滞期 λ丙酮酸甲酯与 λ吐温40差异性不显著(P>0.05),最大比生长速率 μmax丙酮酸甲酯与 μmax吐温40之间存在显著性差异,且 μmax丙酮酸甲酯(0.055)>μmax吐温40(0.035)。可见,S2对丙酮酸甲酯的延滞期及最大比生长速率均高于S1,而两者对吐温40的代谢延滞期S1高于S2,最大比生长速率S2高于S1。 图8 脂肪酸/酯类代谢参数的差异Fig.8 The difference between fatty acid metabolic 通过对轻微加工即食品对虾品质特征及货架期终点时优势腐败菌的研究,以及对优势腐败菌(地衣芽孢杆菌与枯草芽孢杆菌)碳源代谢能力和动力学的比较分析,得出以下结论: 1)货架期终点时,即食对虾品质安全指标均符合国家限量标准。优势腐败菌鉴定结果:MIDI鉴定S1和S2,与枯草芽孢杆菌、地衣芽孢杆菌相似性分别为 0.411±0.200,0.842±0.110。 16S rDNA序列比对结果相似度均为前者为100%,后者为99%。对虾货架期终点优势腐败菌为地衣芽孢杆菌(占55%)与枯草芽孢杆菌(占35%)。 2)S1和S2对碳源整体代谢能力差异性不显著,拟合效果良好(R2=0.980±0.032),二者对糖类代谢能力最强,其次是羧酸类,然而前者对氨基酸及脂肪酸的代谢能力均弱于后者。 3)S1与S2对糖类、羧酸类、氨基酸类、酯类/脂肪酸类的代谢动力学参数存在一定差异。S2的延滞期除蜜二糖外都明显高于S1,S2的最大比生长速率均高于S1,且二者对D-纤维二糖、龙胆二糖的最大比生长速率均较高。S2对氨基酸的代谢延滞期均长于S1,最大比生长速率均高于前者;S2对羧酸的代谢延滞期较长,最大比生长速率更高。S2丙酮酸甲酯的延滞期及最大比生长速率均明显高于S1,而二者对吐温40的代谢延滞期,S1高于S2;最大比生长速率,S2高于S1。1.4 数据处理
2 结果与分析
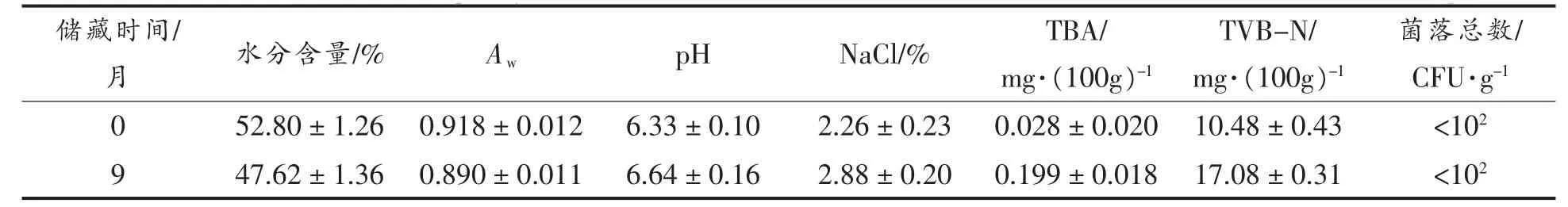
2.1 即食对虾贮藏前、后品质特征变化
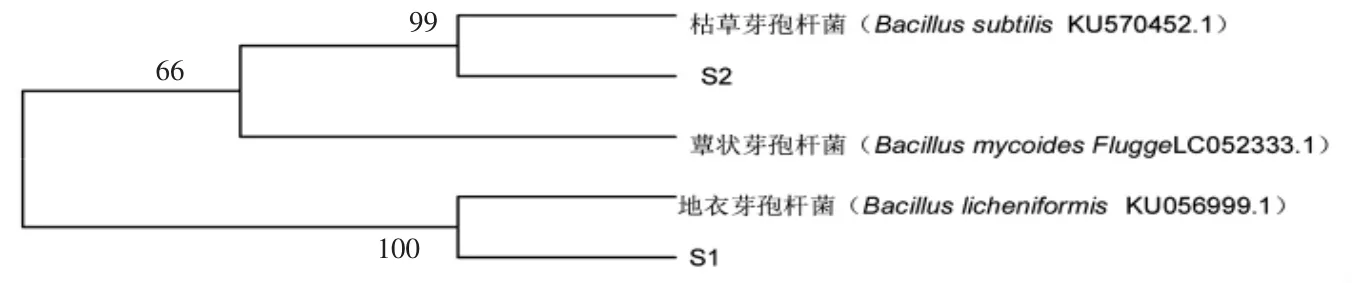
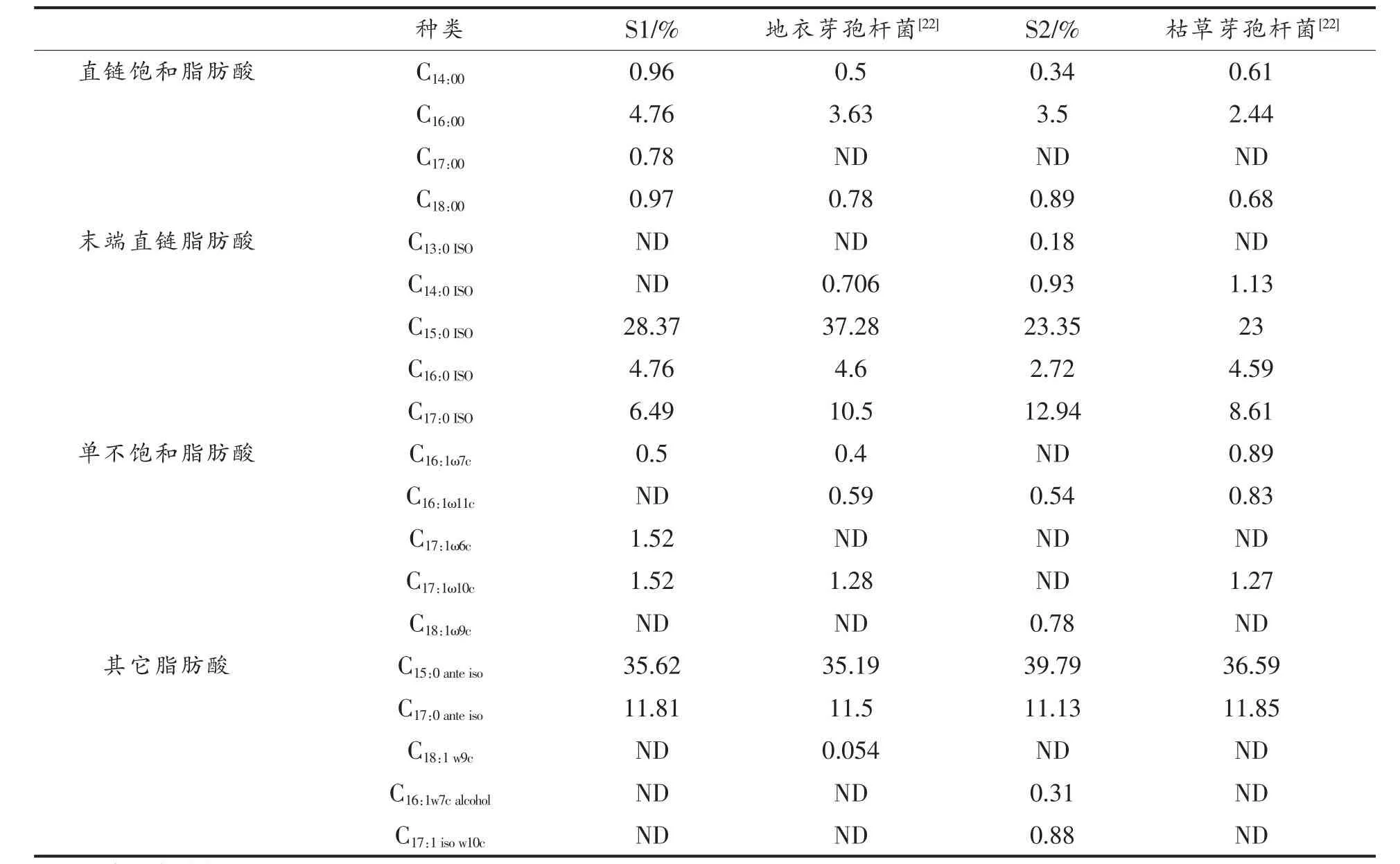
2.2 优势腐败菌鉴定结果
2.3 S1与S2碳源代谢能力
2.4 地衣芽孢杆菌(S1)与枯草芽孢杆菌(S2)的碳源代谢动力学分析

3 结论
