黄粉虫酶解物体内外抗氧化及免疫活性研究
2019-08-12刘竹青崔旋旋朴美子
刘竹青 李 岩 崔旋旋 朴美子*
(1青岛农业大学食品科学与工程学院 山东青岛 266109 2青岛海润农大有限检测公司 山东青岛 266109)
黄粉虫(Tenebrio molitor)又叫面包虫,是一种富含蛋白质的昆虫,干燥的黄粉虫幼虫含蛋白质高达40%,有“蛋白质饲料宝库”的称号。研究发现,黄粉虫能很好地提高人体免疫力,降低人体血脂,延缓器官衰老。李奕冉等[1]研究了黄粉虫蛋白对小鼠免疫功能的影响,结果表明黄粉虫蛋白可以明显增加小鼠免疫器官质量,增强小鼠细胞免疫力。
蛋白质经过酶解后得到分子质量小,具有生物活性的多肽类物质。多肽类物质的活性主要表现在降血压、降胆固醇、抗肥胖、抗氧化和免疫调节等[2-3]。张莉莎等[4]利用阳阴离子交换柱层析以及Sephadex G-25凝胶柱层析对酶解得到的多肽进行分离纯化,发现纯化后的多肽表现出很强的抗氧化性。Jolles等[5]利用胰蛋白酶酶解人乳蛋白,分离出一种具有免疫活性的肽,可以刺激巨噬细胞吞噬绵羊红细胞。徐鑫等[6]采用胰蛋白酶酶解酪蛋白酸钠的方法制备免疫活性肽,获得的多肽刺激脾细胞增殖能力最强,能提高机体免疫力的活性。目前对抗氧化活性肽的研究较多集中在大豆肽和玉米肽上,对黄粉虫的利用还局限在黄粉虫蛋白质的提取上[7],而对黄粉虫酶解物(Tenebrio Molitor Hydrolysate,以下简称TMH)的抗氧化活性及免疫活性的研究还很少。本文对TMH体外抗氧化活性进行研究,并通过小鼠试验研究了TMH的体内抗氧化活性和免疫活性,为黄粉虫功能性食品的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
黄粉虫酶解物(TMH),自制;雄性昆明种8周龄SPF级实验小鼠〔合格证号SCXKL(鲁)20140007〕,青岛大任富城畜牧有限公司;基础饲料,青岛大任富城畜牧有限公司;D-半乳糖,国药集团;MDA、T-SOD、GSH-Px、CAT、·OH 试剂盒、考马斯亮蓝蛋白质测定试剂盒,免疫球蛋白G(IgG)、免疫球蛋白 M(IgM)、白细胞介素 4(IL-4)、γ-干扰素(IFN-γ)小鼠 ELISA 测定试剂盒,南京建成生物工程公司。
1.2 仪器与设备
UV-2000型紫外分光光度计,尤尼克(上海)仪器有限公司;AR1140型电子分析天平,奥豪斯集团;台式酸度测定仪,北京哈纳科仪科技有限公司;ELx808型酶标仪,美国BioTek公司;DSHZ-300A型旋转式恒温振荡器,江苏国华电器有限公司;电热恒温水浴锅,龙口市先科仪器有限公司;RE-6000型旋转蒸发仪,上海亚荣生化仪器厂;FD-1D-80冷冻干燥机,北京博医康实验仪器有限公司;TGL-16M高速台式冷冻离心机,湖南湘仪仪器有限公司。
1.3 方法
1.3.1 TMH的制备 将黄粉虫幼虫干燥后粉碎,过100目筛子,脱脂。利用Arazyme酶酶解,加酶量为517.8 U/g原料,料水比为1∶26.05,酶解时间5.0 h。灭酶15 min后,过滤、离心,取上层离心液即TMH,冷冻干燥后备用。
1.3.2 TMH体外抗氧化活性
1)DPPH自由基清除能力测定 参考文献[8]。
2)超氧阴离子清除能力测定 采用邻苯三酚自氧化法测定[9]。
3)总还原能力测定 采用铁氰化钾法测定[10]。
1.3.3 TMH体内抗氧化活性研究
1.3.3.1 小鼠的分组与饲喂 选取60只初始体重为18~22 g的8周龄雄性昆明种SPF级小鼠,随机分为6组,每组10只,分别为空白组、D-半乳糖致衰老模型组(简称为模型组)、VC阳性对照组以及TMH低剂量组、中剂量组、高剂量组。其中,空白组皮下注射 0.1 mL/(10g·d)生理盐水,其余各组皮下注射 200 mg/(kg bw·d) D-半乳糖[11](D-半乳糖以无菌生理盐水配成20 mg/mL的溶液,使用前用0.22 μm滤膜过滤除菌)。空白组和模型组每日灌胃等体积的生理盐水,VC阳性组小鼠灌胃 VC〔10 mg/(kg bw·d)〕溶液,TMH 的低、中、高剂量组每日按多肽含量100,300,500 mg/(kg bw·d)灌胃小鼠。每日定时灌胃,注射 1次,连续6周。期间观察小鼠体征,每周记录1次小鼠体重。
1.3.3.2 小鼠的处死及血浆准备 对试验小鼠末次注射后,禁食12 h,眼球取血并处死,血液中加入抗凝剂,静置3 h,3 000 r/min离心15 min,小心吸取上层血浆,分装后液氮冷冻备用。
1.3.3.3 肝脏组织匀浆的制备 取解剖后小鼠肝脏,用生理盐水冲洗干净,沥干水分,称取0.2 g放入组织研磨器中,加入9倍生理盐水进行研磨,制成10%肝脏组织匀浆。
1.3.3.4 小鼠肝脏组织蛋白质含量测定 采用蛋白质定量试剂盒(考马斯亮蓝法)测定小鼠肝脏组织的蛋白质含量。
1.3.3.5 小鼠血浆和肝脏组织抗氧化指标的测定按照试剂盒提供的方法,分别测定小鼠血浆和肝脏匀浆中 MDA 含量,CAT、GSH-Px、T-SOD 活力以及抑制羟自由基能力。
1.3.4 TMH免疫活性研究
1.3.4.1 实验动物的分组与饲喂 选取40只初始体质量18~22 g的8周龄昆明种清洁级雄性小鼠,随机分为4个处理组,分别为空白组,TMH的低、中、高剂量组,每组10只。低、中、高剂量组每日按 TMH 中多肽含量 100,300,500 mg/(kg bw·d)灌胃小鼠,空白组每日灌胃等体积的生理盐水,各组小鼠自由取食和饮水,饲养30 d。
1.3.4.2 小鼠致敏及血清制备[12]取公鸡血置于装有玻璃珠的三角瓶中,同一方向摇动脱纤维,用生理盐水清洗 2~3 次,离心(2 000 r/min,10 min),取上清,用生理盐水配制体积分数为2%的鸡红细胞悬液。每只小鼠腹腔注射鸡血红细胞0.2 mL,5 d后眼球取血,将凝固血与离心管壁剥离,使血清充分析出,以2 000 r/min离心10 min,收集血清。
1.3.4.3 肝脏组织匀浆的制备 小鼠饲养30 d后,称小鼠体重,眼部取血后处死,分别摘取小鼠的胸腺与脾脏,用生理盐水冲洗,用滤纸充分吸干内脏表面的水分,称取小鼠各脏器质量并记录数据,计算免疫器官指数(g/kg体重)。
1.3.4.4 小鼠血清中免疫功能指标的测定 采用酶联免疫吸附法测定小鼠血清中的免疫球蛋白G(IgG)、免疫球蛋白 M(IgM)、白细胞介素 4(IL-4)、γ-干扰素(IFN-γ),试验遵循 ELISA 测定试剂盒操作步骤。
1.3.5 数据处理 数据采用x±s表示,采用SPSS 17.0统计软件进行方差分析,统计组间差异。
2 结果与分析
2.1 TMH体外抗氧化活性
2.1.1 TMH对DPPH自由基的清除作用由图1可看出,在2~10 mg/mL质量浓度范围,随着TMH浓度的增大,其对DPPH自由基的清除率也增大,当TMH的质量浓度为10 mg/mL时,其清除率达88.4%,其 IC50为 3.75 mg/mL。

图1 不同浓度TMH对DPPH自由基的清除能力Fig.1 DPPH scavenging ability of TMH with various concentrations
2.1.2 TMH对O2-·自由基的清除作用由图2可以看出,在25~200 mg/mL质量浓度范围,TMH浓度与清除O2-·自由基的能力呈线性关系。随着TMH浓度的增大,其清除率不断增大,当质量浓度为200 mg/mL时,其清除率达61.0%,IC50为138.42 mg/mL。
2.1.3 TMH的还原能力 由图3可以看出,在0.5~6 mg/mL质量浓度范围,随着黄粉虫酶解物浓度的增大,其还原能力不断增大。当质量浓度为6 mg/mL时,其还原能力达到0.653。
2.2 TMH体内抗氧化活性
2.2.1 TMH对小鼠体重的影响 体重的改变反映衰老的程度。对实验小鼠在正常饲喂条件下连续饲喂6周,每周记录小鼠体重1次。数据表明,饲喂期间各组小鼠的体重都有增加,其中模型组小鼠的体重增加量显著小于其它各剂量组。研究发现小鼠体重增加量与TMH剂量的增加呈正比关系,多肽高剂量组的体重增加量与正常组无显著差异,说明TMH可减缓衰老模型小鼠的衰老症状,起到防衰老的效果。

图2 不同浓度TMH对O2-·自由基清除能力Fig.2 O2-·radical scavenging ability of TMH with various concentrations
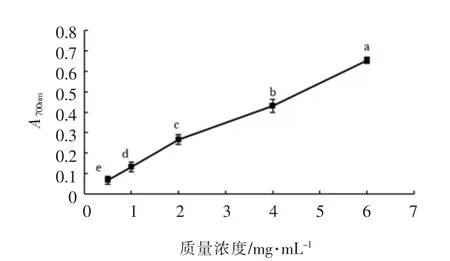
图3 不同浓度黄粉虫酶解物的还原能力Fig.3 Reducing capacity of TMH with various concentrations

表1 TMH对小鼠体重的影响Table1 Effect of TMH on body weight of mice
2.2.2 TMH对小鼠血浆中MDA含量、CAT、GSHPx、T-SOD活力及抑制羟自由基能力的影响 机体组织中的超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶等可以清除体内自由基和脂质过氧化物,并明显抑制组织中的丙二醛,从而抑制自由基的产生。小鼠组织中CAT、GSH-Px、T-SOD 活力及抑制羟自由基能力以及小鼠体重和肝脏中MDA含量变化,可以反映小鼠机体抗氧化情况。由表2可看出,模型组小鼠注射D-半乳糖后,肝脏MDA含量显著升高,同时CAT、T-SOD、GSHPx活力和抑制羟自由基能力显著降低,D-半乳糖建立衰老模型成功。与模型组相比,高剂量组TMH可以显著降低MDA(P<0.05)含量并抑制羟自由基能力;低剂量组TMH就可以显著提高小鼠血浆、肝脏中CAT(P<0.05)活力;中剂量组TMH可以显著提高GSH-Px(P<0.05)活力;当TMH为高剂量组时,可以显著提高小鼠血浆、肝脏中TSOD(P<0.05)活力,其中,随着剂量的增加,各指标与模型组的差异增大,并与空白组的指标接近。
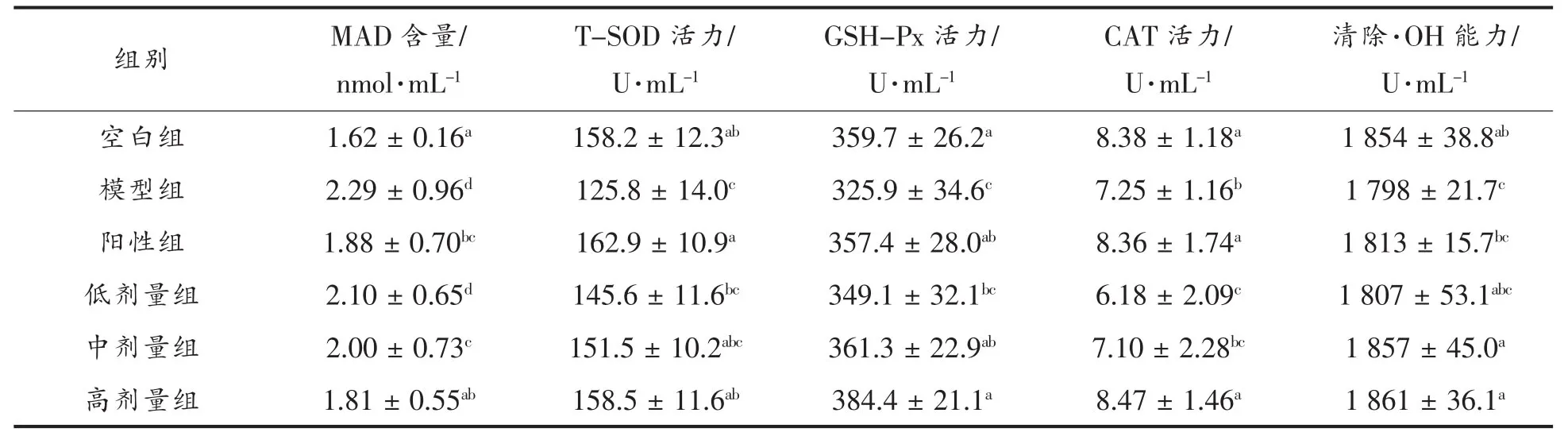
表2 TMH对小鼠血浆中MDA含量、CAT、GSH-Px、T-SOD活力及抑制羟自由基能力的影响Table2 Effect of TMH on MDA,CAT,GSH-Px,T-SOD and OH·in mice’s plasma
2.2.3 TMH对小鼠肝脏中MDA含量、CAT、GSHPx、T-SOD活力及抑制羟自由基能力的影响 由表3可看出,模型组小鼠注射D-半乳糖后,肝脏MDA 含量显著升高,同时 CAT、T-SOD、GSHPx活力和抑制羟自由基能力显著降低,说明用D-半乳糖建立衰老模型成功。与模型组相比,TMH高剂量组的小鼠肝脏中MAD含量和T-SOD活力有显著的变化,低、中剂量组没有显著性改变;CAT活力在低、中、高剂量组中都有所降低,变化均不显著;TMH中剂量组中GSH-Px活力和·OH清除能力比模型组显著提高,与空白组无显著性差异。
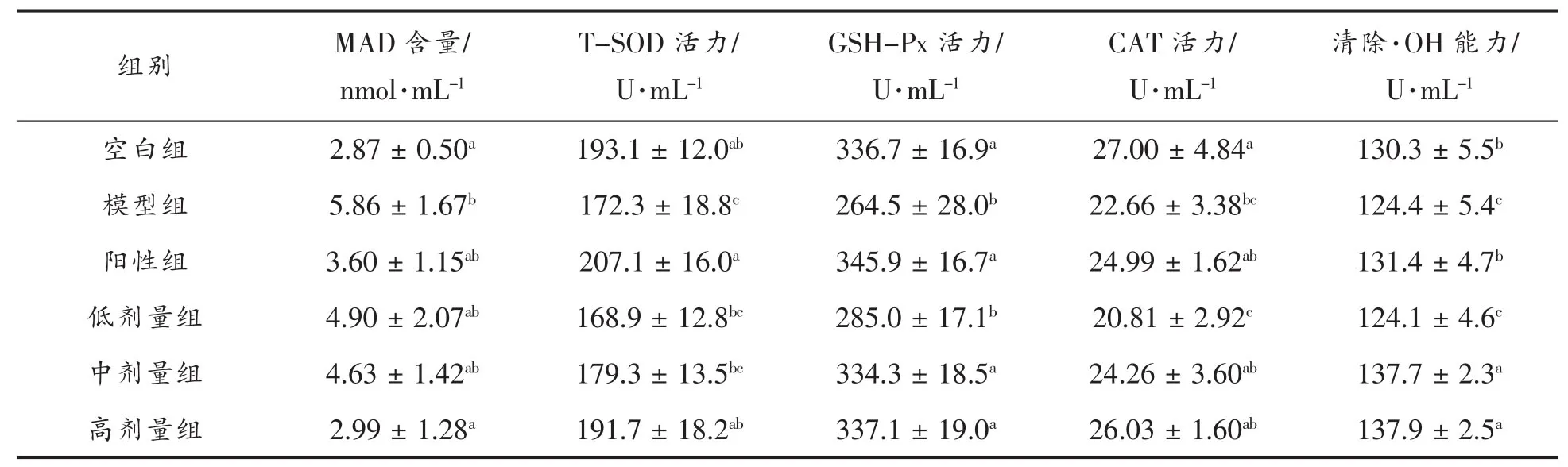
表3 TMH对小鼠肝脏中MDA含量、CAT、GSH-Px、T-SOD活力及抑制羟自由基能力的影响Table3 Effect of TMH on MDA,CAT,GSH-Px,T-SOD and OH·in mice’s liver
2.3 TMH免疫活性研究
2.3.1 TMH对小鼠免疫器官指数的影响 胸腺和脾脏分别属于中枢和外周免疫器官,其增重往往意味着机体淋巴细胞的增殖,直接体现免疫应答的强弱[13]。由表4可知,与对照组比较,随着TMH剂量的增加,小鼠的免疫器官指数也有相应的变化,其中胸腺指数没有显著变化,脾脏指数变化显著。低、高剂量间不存在明显的量效关系,其原因有可能是小鼠的胸腺与脾脏较小,解剖时导致测定结果有一定误差。同时,剂量设计跨度大也有待改进。

表4 TMH对小鼠免疫器官指数的影响Table4 Effect of TMH on the immune organs index of mice
2.3.2 TMH 对小鼠血清中 IgG、IgM、IL-4、IFN-γ含量的影响 血清中的免疫球蛋白G(IgG)、免疫球蛋白M(IgM)的含量代表血清中免疫球蛋白的主要水平,是反映机体免疫功能状态的指标[14]。由表5可知,小鼠血清中的IgG含量在低、中、高剂量组间差异显著,而小鼠血清中的IgM含量在低、中、高剂量组间没有明显差异。与空白组相比,小鼠血清中IgG、IgM含量均有显著性提高。这说明TMH通过提高小鼠血清中IgG、IgM含量,提高小鼠免疫能力的效果。
细胞因子IL-4对于B细胞、T细胞、肥大细胞、巨噬细胞都有免疫调节作用,主要参与B细胞增殖以及体液免疫,抗体的产生。细胞因子IFN-γ主要促进T细胞增殖,介导细胞免疫和炎症反应。由表5可知,与空白组相比,低、中、高剂量组小鼠血清中的IFN-γ含量有显著提升,而中、高剂量组组间并无差异性。与空白组相比,低剂量组小鼠血清中的IL-4含量提高显著。随着饲喂剂量的增加,血清中的IL-4含量也显著提高,并呈正相关性。TMH可以显著提高小鼠血清中IL-4的含量,从而提高IL-4参与体液免疫能力,诱导抗体产生,提高小鼠免疫力。

表5 TMH对小鼠血清中IgG、IgM、IL-4、IFN-γ含量的影响Table5 Effect of TMH on the IgG,IgM,IL-4,IFN-γ concentrations in mice’s plasma tissue
3 结论
利用Arazyme酶酶解黄粉虫,得到富含多肽的酶解液。通过体外抗氧化活性研究发现,黄粉虫酶解液对DPPH自由基、O2-·自由基的清除能力分别达到 88.4%(10 mg/mL),61.0%(200 mg/L),且当其质量浓度为6 mg/L时,还原能力达到0.653。
动物试验表明,TMH可以显著提高小鼠血浆、肝脏中 CAT、GSH-Px、T-SOD(P<0.05)活力,降低MDA(P<0.05)含量并抑制羟自由基能力;显著增加血清中 IgG、IgM、IL-4、IFN-γ(P<0.05)的含量,提高小鼠脾脏和肝脏指数,表现出较强的抗氧化能力以及改善机体免疫的功能。
