雷公藤甲素对子宫内膜癌Ishikawa 细胞的影响
2019-08-11关崇丽王惠玲
关崇丽, 郑 婧, 王惠玲
(甘肃省妇幼保健院,甘肃 兰州730050)
子宫内膜癌是生殖系统最常见的妇科恶性肿瘤之一,近年来随着人们生活节奏加快,生活方式、饮食习惯等改变,发病人群趋于年轻化,发病率逐年升高[1],其病死率在女性恶性肿瘤中仅次于卵巢癌[2],严重威胁女性生命安全。子宫内膜癌按病理特征大致分为与雌激素有关的内膜样癌和与雌激素无关的浆液性癌[3],临床上绝大多数患者处于早期阶段,常规手术切除、术后化疗可获得较好的疗效和较满意的预后,但对于处于早期且要求保留生育能力,或处于中、晚期复发型患者仍缺乏有效治疗措施,亟需相关新型药物出现。
雷公藤甲素是一种具有多种生理作用的三萜类成分,对多种肿瘤具有明显抑制作用,如胰腺癌[4]、乳腺癌[5]、卵巢癌[6]、宫颈癌[7],可能作用机制有通过PI3K-AkTmTOR 诱导肿瘤细胞凋亡[7-9],抑制p53 激活,并与转录因子的亚基共价结合,抑制RNA 聚合酶参与转录,进而诱导肿瘤凋亡与自噬的发生[6,10], 但是否能基于PI3K-AktmTOR 通路对子宫内膜癌Ishikawa 细胞诱导发生自噬、凋亡尚不清楚。因此,本实验探讨雷公藤甲素对子宫内膜癌Ishikawa 细胞的影响。
1 材料
人子宫内膜癌Ishikawa 细胞株购自北京协和医科大学基础医学院细胞中心。雷公藤甲素(批号SMB00354,含有量≥98%) 购自江西省欣和科技开发公司,无菌三蒸水溶解至所需浓度, 过滤灭菌保存。 RPMI 1640 (批号AD15805337) 购自美国Life Sciences 公司;胎牛血清(批号11011-8611)、MTT(批号6041051)、胰蛋白酶(批号J150021)、BCA 试剂盒(批号P0037)、碘化丙啶(批号20160914)、 β-actin (批 号17112701)、 PI3Kp85 (批 号40912)、 p-AkT (批 号70265)、 AkT (批号80354)、 pmTOR(批号30465)、mTOR(批号20179)、兔抗鼠单克隆抗体购自英国Abcam 公司;HRP-山羊抗兔二抗(批号062017170905) 购自美国Cell Signaling Technology 公司;Trizol 试 剂 (批 号AA6901-1)、 逆 转 录 试 剂 盒 (批 号AK4802)、荧光扩增试剂盒(批号AKA905) 均购自日本TaKaRa 公司。引物由宝生物工程(大连) 有限公司合成。
2 方法
2.1 细胞培养 人子宫内膜癌Ishikawa 细胞用含10%胎牛血清的RPMI-1640 培养基于37 ℃、5%CO2培养箱中培养,每2 d 更换一次培养基,待细胞融合至80%时用0.25%胰蛋白酶消化、传代,取对数期细胞用于实验。
2.2 细胞增殖抑制率检测 采用MTT 法。取对数生长期的人子宫内膜癌Ishikawa 细胞,0.25%胰蛋白酶消化,调整细胞密度为1×104/孔,接种于96 孔板内,培养24 h 后加入0、0.5、2.0、8.0、32.0、128.0 nmol/L 雷公藤甲素,设置5 个复孔,加药后24、48、72 h 后吸弃含药上清,更换含10%胎牛血清的PRMI-1640 培养基, 每孔再加入20 μL(5 mg/mL) MTT 溶液,于37 ℃、5%CO2细胞培养箱中培养4 h 后小心吸弃去孔内培养基,每孔加入150 μL二甲基亚砜,酶标仪测定波长490 nm 处各孔光密度(OD)值,计算增殖抑制率。
2.3 细胞周期检测 采用流式细胞术。取对数生长期人子宫内膜癌Ishikawa 细胞,悬液调整细胞密度为1.0×105/mL,置于6 孔板中,每孔2 mL。待细胞贴壁后移去上清液,不含血 清 培 养12 h 后, 加 入0、 0.5、 2.0、 8.0、 32.0、128.0 nmol/L雷公藤甲素,每组平行3 份,培养24 h后胰酶消化细胞使其变成单个细胞,离心收集细胞,弃上清,预冷PBS 清洗3 次,预冷70%乙醇在4 ℃下固定过夜,离心收集 细 胞, 清 洗, 重 悬, 加 入50 μg/mL RNA 酶 和100 μg/mL PI,300 目滤网过滤后,上流式细胞仪检测细胞周期。
2.4 蛋白表达检测 采用Western blot 法。0、0.5、2.0、8.0、32.0、128.0 nmol/L 雷公藤甲素干预对数生长期人子宫内膜癌Ishikawa 细胞24 h,PBS 清洗2 次,加入300 μL细胞RIPA 裂解液,冰上裂解15 min,EP 管收集细胞裂解液,12 000 r/min、4 ℃离心15 min,取上清液,BCA 法进行蛋白定量,按比例加入蛋白上样缓冲液(4 ∶1),沸水浴10 min 使蛋白充分变性。根据蛋白样品浓度计算上样量,12%分离胶、10%浓缩胶转膜90 min,5%脱脂奶粉室温封闭1 h,1 ∶1 000 标记一抗,4 ℃过夜,1 ∶10 000 孵育辣根过氧化物酶标记的二抗,室温孵育2 h,暗室中滴加超敏发光液,感光胶片曝光,采集图片,Image J 软件分析。
2.5 mRNA 表达检测 采用荧光定量PCR 法。0、0.5、2.0、8.0、32.0、128.0 nmol/L 雷公藤甲素干预对数生长期的人子宫内膜癌Ishikawa 细胞24 h,总RNA 提取方法为用PBS 清洗2 次,加入1 mL Trizol 裂解液,吸管吹打后转至EP 管,再加入0.2 mL 氯仿,涡旋振荡,12 000 r/min、4 ℃离心15 min,吸取上清至新EP 管,加入等体积异丙醇,静置、离心、弃上清后加与异丙醇等体积的75%乙醇洗涤沉淀,最后加适量DEPC 处理水溶解RNA。取已提取的总RNA 1 μL,超微量分光光度计检测,测得A260/A280比值为1.8 ~2.0,表明RNA 质量较好,去基因组DNA 后,采用逆转录试剂盒将其逆转录合成cDNA,以cDNA 为模板进行荧光PCR 扩增。采用SYBR Premix Ex TaqⅡ试剂盒,在Agilent(Mx3000P) PCR 仪上进行实时荧光定量,分别扩增PI3Kp85、AKT、mTOR、LC3ⅡmRNA(引物序列见表1),重复3 次。反应条件为预变性,95 ℃2 min,1 个循环;热循环,95 ℃15 s,60 ℃15 s,72 ℃30 s,40 个循环,扩增结束后由扩增曲线和溶解曲线确认数据可信性,计算基因相对表达量2-△△Ct。
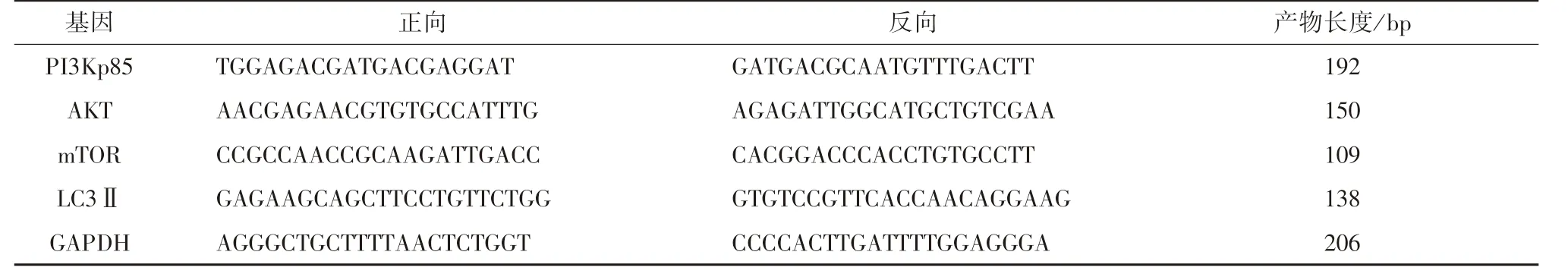
表1 引物序列
2.6 统计学分析 通过SPSS 21.0 软件进行处理,数据以表示,采用单因素方差分析,数据满足正态分布和方差齐性时,采用LSD 法进行多组间两两比较;方差不齐性时,采用Dunnett'T3 法进行多组间两两比较。以P<0.05表示差异有统计学意义。
3 结果
3.1 雷公藤甲素对Ishikawa 细胞增殖的影响 表2、图1显示,与雷公藤甲素0 nmol/L 组比较,其他剂量组均能显著抑制Ishikawa 细胞增殖(P<0.05,P<0.01),并随其浓度增大、作用时间延长,抑制作用也加强。
表2 雷公藤甲素对Ishikawa 细胞增殖的影响(%,n=3)
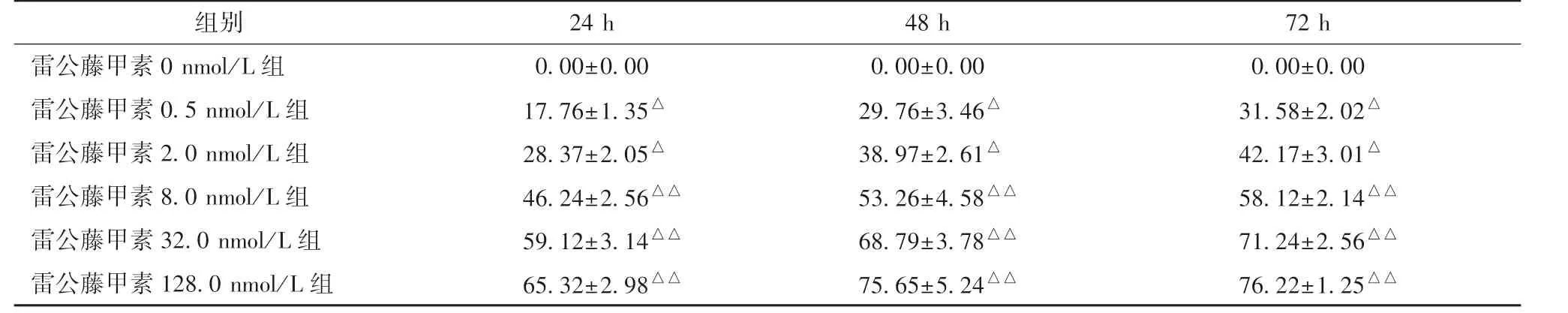
表2 雷公藤甲素对Ishikawa 细胞增殖的影响(%,n=3)
注:与雷公藤甲素0 nmol/L 组比较,△P<0.05,△△P<0.01
组别 24 h 48 h 72 h雷公藤甲素0 nmol/L 组 0.00±0.00 0.00±0.00 0.00±0.00雷公藤甲素0.5 nmol/L 组 17.76±1.35△ 29.76±3.46△ 31.58±2.02△雷公藤甲素2.0 nmol/L 组 28.37±2.05△ 38.97±2.61△ 42.17±3.01△雷公藤甲素8.0 nmol/L 组 46.24±2.56△△ 53.26±4.58△△ 58.12±2.14△△雷公藤甲素32.0 nmol/L 组 59.12±3.14△△ 68.79±3.78△△ 71.24±2.56△△雷公藤甲素128.0 nmol/L 组 65.32±2.98△△ 75.65±5.24△△ 76.22±1.25△△
3.2 雷公藤甲素对Ishikawa 细胞周期的阻滞作用 表3 显示,雷公藤甲素对Ishikawa 细胞周期有阻滞作用,可将其阻滞在S 期和G2/M 期,并随着浓度增加,阻滞在G2 期的比例逐渐增高;与雷公藤甲素0 nmol/L 组比较,2.0、8.0、32.0、128.0 nmol/L 组比例显著增加(P<0.05,P<0.01)。
3.3 雷 公 藤 甲 素 对PI3Kp85、 p-AkT、 AkT、 p-mTOR、mTOR 蛋白表达的影响 表4、图2 显示,与雷公藤甲素0 nmol/L组比较,2.0、8.0、32.0、128.0 nmol/L 组均能显著降低PI3Kp85、p-AkT、p-mTOR 蛋白表达(P<0.05,P<0.01),并随浓度增加而更明显,但各组AkT、mTOR 蛋白表达无显著差异(P>0.05)。
3.4 雷公藤甲素对PI3Kp85、AkT、mTOR、LC3ⅡmRNA 表达的影响 表5 显示,与雷公藤甲素0 nmol/L 组比较,2.0、8.0、32.0、128.0 nmol/L 组均能显著降低PI3Kp85、AkT、mTOR mRNA 表达(P <0.05,P <0.01),显著升高LC3ⅡmRNA 表达(P<0.05,P<0.01),并与其浓度呈正相关。
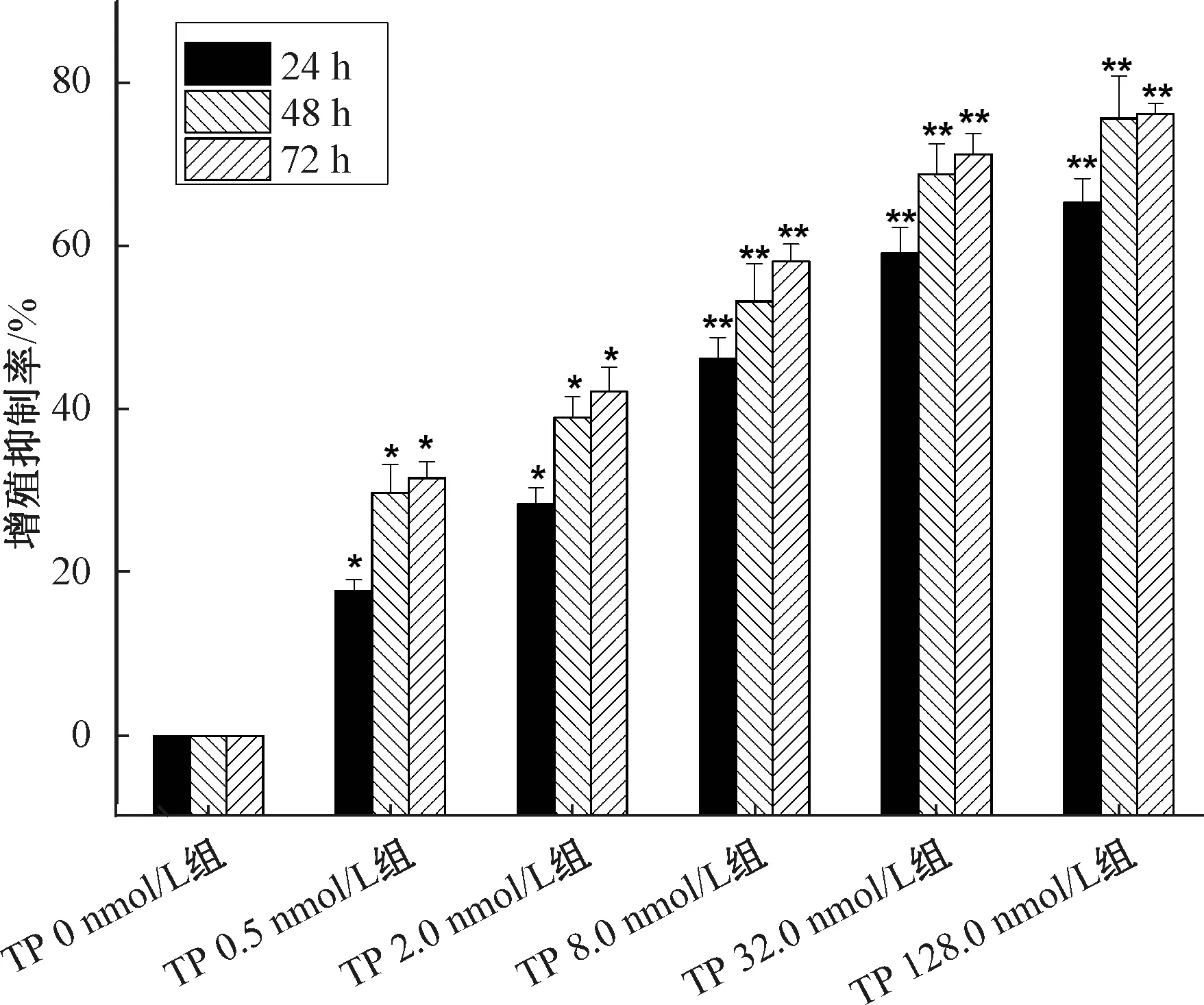
图1 雷公藤甲素对Ishikawa 细胞增殖的影响
表3 雷公藤甲素对Ishikaw 细胞周期的影响n=3)
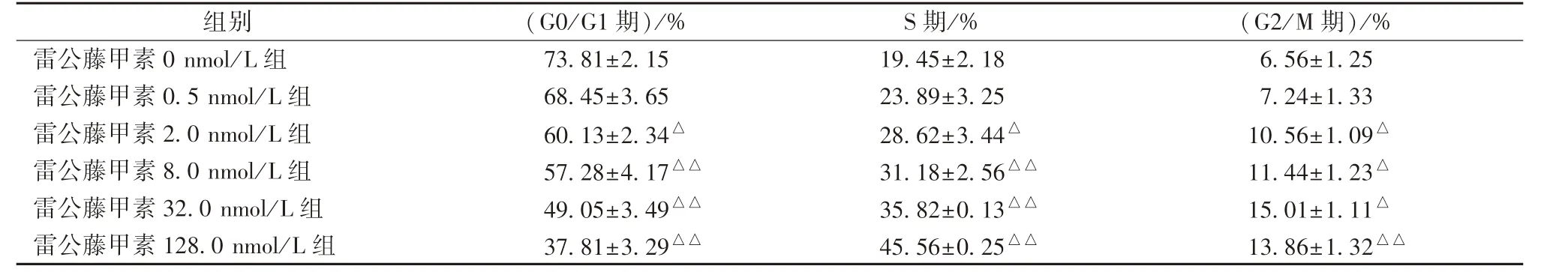
表3 雷公藤甲素对Ishikaw 细胞周期的影响n=3)
注:与雷公藤甲素0 nmol/L 组比较,△P<0.05,△△P<0.01
组别 (G0/G1 期)/% S 期/% (G2/M 期)/%雷公藤甲素0 nmol/L 组 73.81±2.15 19.45±2.18 6.56±1.25雷公藤甲素0.5 nmol/L 组 68.45±3.65 23.89±3.25 7.24±1.33雷公藤甲素2.0 nmol/L 组 60.13±2.34△ 28.62±3.44△ 10.56±1.09△雷公藤甲素8.0 nmol/L 组 57.28±4.17△△ 31.18±2.56△△ 11.44±1.23△雷公藤甲素32.0 nmol/L 组 49.05±3.49△△ 35.82±0.13△△ 15.01±1.11△雷公藤甲素128.0 nmol/L 组 37.81±3.29△△ 45.56±0.25△△ 13.86±1.32△△
表4 雷公藤甲素对PI3Kp85、p-AkT、AkT、p-mTOR、mTOR 蛋白表达的影响n=3)
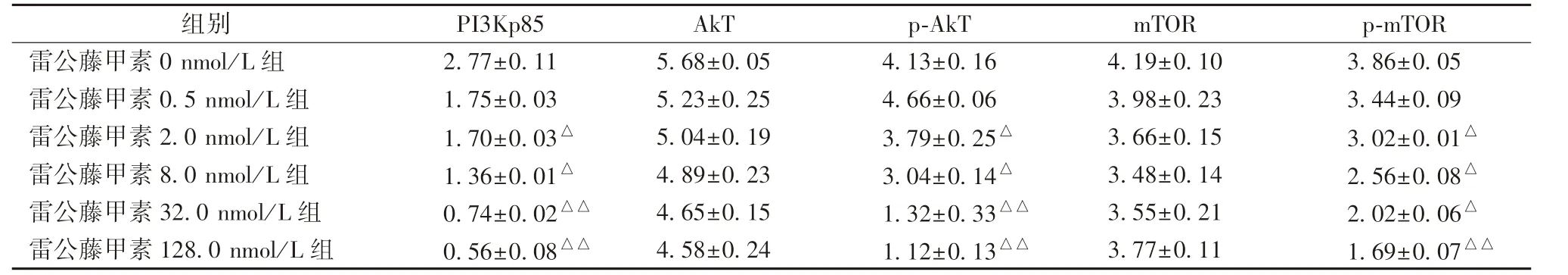
表4 雷公藤甲素对PI3Kp85、p-AkT、AkT、p-mTOR、mTOR 蛋白表达的影响n=3)
注:与雷公藤甲素0 nmol/L 组比较,△P<0.05,△△P<0.01
组别 PI3Kp85 AkT p-AkT mTOR p-mTOR雷公藤甲素0 nmol/L 组 2.77±0.11 5.68±0.05 4.13±0.16 4.19±0.10 3.86±0.05雷公藤甲素0.5 nmol/L 组 1.75±0.03 5.23±0.25 4.66±0.06 3.98±0.23 3.44±0.09雷公藤甲素2.0 nmol/L 组 1.70±0.03△ 5.04±0.19 3.79±0.25△ 3.66±0.15 3.02±0.01△雷公藤甲素8.0 nmol/L 组 1.36±0.01△ 4.89±0.23 3.04±0.14△ 3.48±0.14 2.56±0.08△雷公藤甲素32.0 nmol/L 组 0.74±0.02△△ 4.65±0.15 1.32±0.33△△ 3.55±0.21 2.02±0.06△雷公藤甲素128.0 nmol/L 组 0.56±0.08△△ 4.58±0.24 1.12±0.13△△ 3.77±0.11 1.69±0.07△△
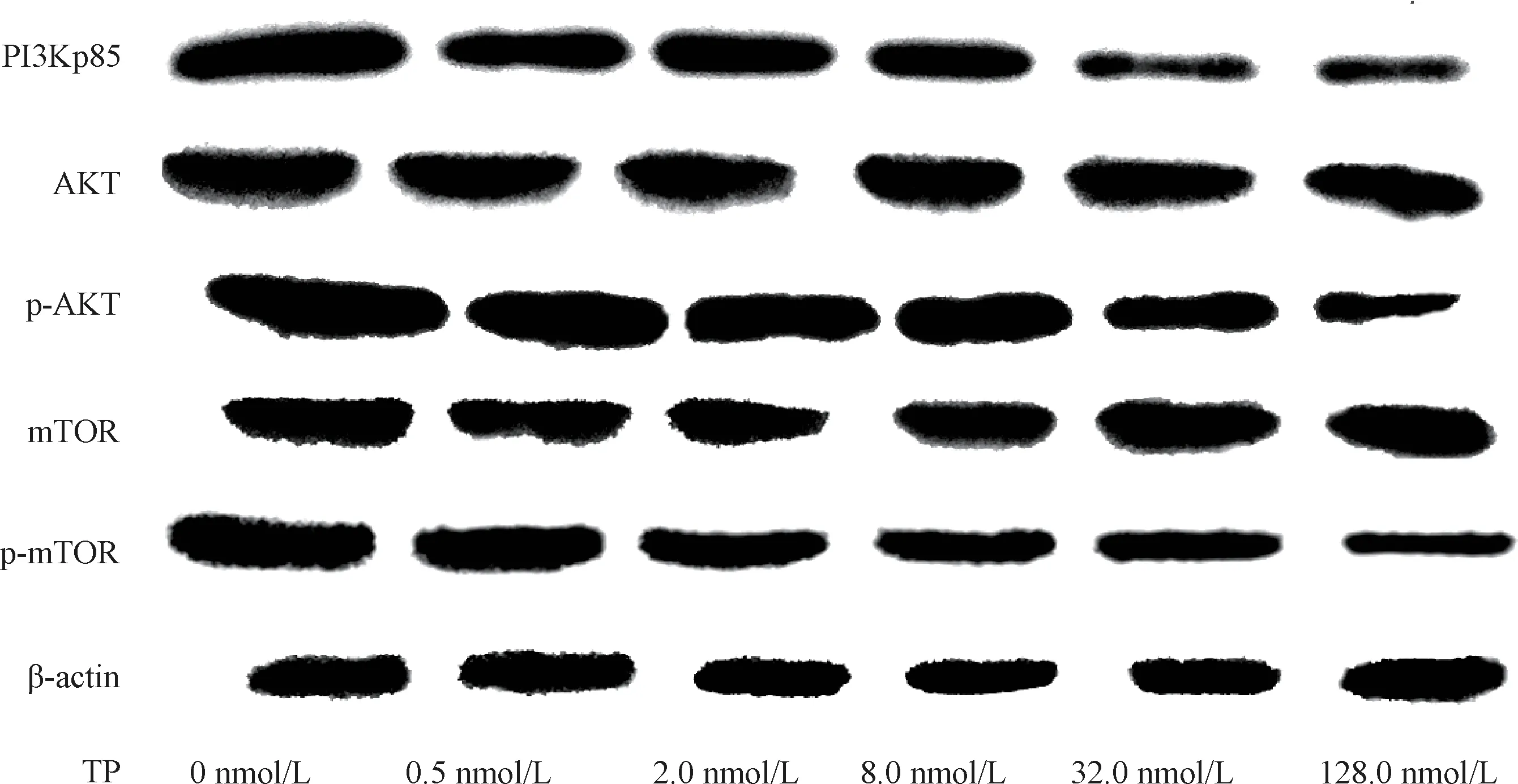
图2 各组PI3Kp85、p-AkT、AkT、p-mTOR、mTOR 蛋白表达
表5 雷公藤甲素对PI3Kp85、p-AkT、AkT、p-mTOR、mTOR mRNA 表达的影响n=3)
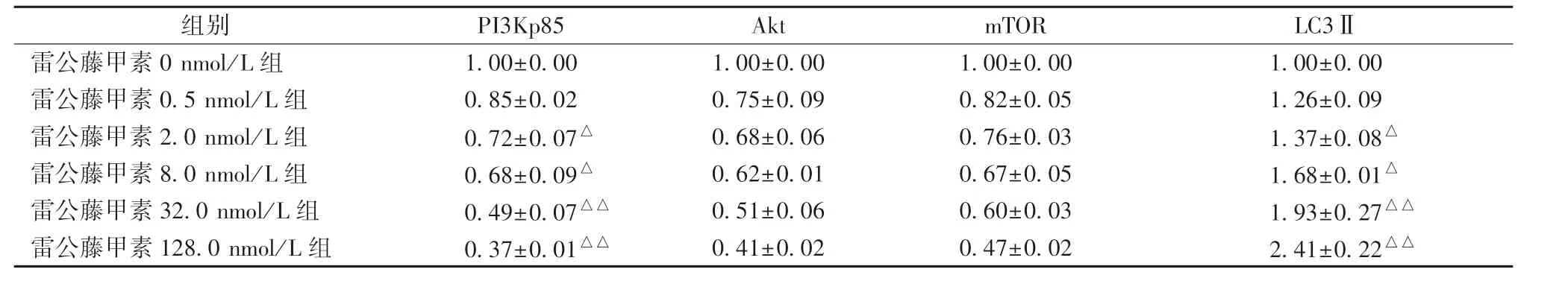
表5 雷公藤甲素对PI3Kp85、p-AkT、AkT、p-mTOR、mTOR mRNA 表达的影响n=3)
注:与雷公藤甲素0 nmol/L 组比较,△P<0.05,△△P<0.01
组别 PI3Kp85 Akt mTOR LC3Ⅱ雷公藤甲素0 nmol/L 组 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00雷公藤甲素0.5 nmol/L 组 0.85±0.02 0.75±0.09 0.82±0.05 1.26±0.09雷公藤甲素2.0 nmol/L 组 0.72±0.07△ 0.68±0.06 0.76±0.03 1.37±0.08△雷公藤甲素8.0 nmol/L 组 0.68±0.09△ 0.62±0.01 0.67±0.05 1.68±0.01△雷公藤甲素32.0 nmol/L 组 0.49±0.07△△ 0.51±0.06 0.60±0.03 1.93±0.27△△雷公藤甲素128.0 nmol/L 组 0.37±0.01△△ 0.41±0.02 0.47±0.02 2.41±0.22△△
4 讨论
近年来科研工作者发现,肿瘤发生发展与细胞异常增殖密切相关,细胞不能程序性生长、凋亡,导致异常发生的原因很多,而自噬异常是重要因素之一。磷脂酰肌醇-3/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(PI3K-Akt-mTOR)信号转导通路受内外界活化信号刺激后异常激活,可抑制肿瘤细胞的凋亡,促进肿瘤细胞增殖、侵袭转移、血管形成,其中磷脂酰肌醇-3(PI3K) 具有丝氨酸/苏氨酸蛋白激酶和磷脂酰肌醇激酶活性蛋白,由调节亚基p85 和催化亚基p110 亚基构成,胞质中PI3K 激活后将胞膜上的磷脂酰肌醇家族成员磷酸化,其累积到一定程度后激活下游信号分子蛋白激酶B(PKB,即AkT),有3 种亚基,是PI3K信号传导途径中的关键靶激酶[11];哺乳动物雷帕霉素靶蛋白(mTOR) 是AkT 重要底物之一,以mTOR1、mTOR2 两种形式存在,其是否被磷酸化会影响转录和翻译;PI3K、AkT 是mTOR 的上游调控因子,前者激活后者后可通过磷酸化mTOR、NF-κB 等一系列底物,进而影响细胞周期、增殖、分化、凋亡、代谢等生理生化过程。研究表明,PI3K-AkT 信号转导通路被视为是调控细胞氧化、生存、凋亡的最关键的信号通路之一[12]。
大量研究表明,中药有效成分能诱导肿瘤细胞发生自噬,抑制肿瘤细胞生长,在直接或辅助抗肿瘤方面发挥着独特的作用。雷公藤甲素亦称雷公藤内酯,是从雷公藤中提取出的三萜类化合物,具有抗炎、免疫抑制、抗囊肿、抗肿瘤等多种功效[13]。Mujumdar 等[14]发现,雷公藤甲素干预胰腺癌S2-013、S2-VP10、Hs766T 细胞株时,呈现出时间、浓度依赖性地细胞周期阻滞和细胞增殖抑制,抑制PI3K-AkT-mTOR 通路上关键基因和蛋白表达,诱导胰腺癌细胞发生自噬性死亡;Xie 等[15]报道,雷公藤甲素将肺癌A549 细胞周期明显阻滞在S 期和G2/M 期,促进肿瘤细胞凋亡;雷公藤甲素可通过PI3K/PKB 通路干预和阻滞子宫内膜癌细胞株HEC-1B 的细胞周期,发挥抗肿瘤作用[16]。本实验应用流式细胞仪检测发现,雷公藤甲素可将子宫内膜癌Ishikawa 细胞阻滞在S 期和G2/M 期,呈现出明显浓度依赖性,与其他学者研究结果一致,表明该成分可阻滞Ishikawa 细胞周期进展,从而抑制其生长增殖。
联合自噬抑制剂3-甲基腺嘌呤和氯喹能增强雷公藤甲素诱导前列腺癌细胞的死亡,通过CaMKKβ-AMPK 信号通路抑制mTOR 磷酸化,并激活ΜLK1 和Beclin1 表达,最终导致前列腺癌细胞自噬能力增强[17]。Kim 等[18]发现,雷公藤甲素联合Hsp90 抑制剂BIIB021 可通过PI3K-AkTmTOR、NF-κB 信号通路对甲状腺癌细胞具有协同杀伤作用;Minjung 等[19]报道,雷公藤甲素对宫颈癌细胞线粒体中的Caspase 3、Caspase 9 表达有明显促进作用,并能改变线粒体膜电位,诱导肿瘤细胞凋亡;雷公藤甲素也可诱导宫颈癌Hela 细胞自噬和凋亡[20-21];仲剑等[22]构造裸鼠模型,将子宫内膜癌细胞种植于皮下,发现它对移植瘤有明显的抑制作用;雷公藤甲素可抑制子宫内膜癌细胞株HEC-1B 侵袭转移[23],上调Bax/Bcl-2 比值[22]。本实验以雷公藤甲素干预子宫内膜癌Ishikawa 细胞,对PI3K-AkT-mTOR信号通路中关键蛋白及基因PI3Kp85、AkT、mTOR 进行研究,发现该成分可下调PI3Kp85、AkT、mTOR mRNA 和蛋白表达,上调LC3ⅡmRNA 表达,从而影响子宫内膜癌Ishikawa 细胞微环境,当其累积到一定程度时,可诱导细胞自噬发生,最终导致细胞凋亡。
综上所述,本实验以雷公藤甲素处理子宫内膜癌Ishikawa 细胞,通过MTT 法观察其对细胞增殖抑制率的影响,流式细胞术检测细胞周期,免疫蛋白印迹研究通路中关键蛋白的活化状态及表达量,RT-PCR 从基因层面验证关键蛋白对应基因表达量变化。结果表明,雷公藤甲素处理子宫内膜癌Ishikawa 细胞可能是通过PI3K-AkT-mTOR 通路诱导关键因子失表达,增强肿瘤细胞自噬能力,导致子宫内膜癌细胞凋亡发生,抑制细胞增殖。
