两种测定植酸酶酶活的方法比较及发酵条件研究
2019-08-10徐丹丹赵邯郸王秀然关淑艳
徐丹丹 赵邯郸 王秀然 关淑艳


摘要:从富含有机质的环境中采集土样,通过植酸钙平板透明圈法初筛得到产植酸酶菌株,进而用钒-钼酸铵法和丙酮-磷钼酸铵法2种方法测定植酸酶酶活力,并进行比较。结果表明,钒-钼酸铵法为准确、可用的方法,通过正交试验确定了最适产酶发酵条件为pH 5,可溶性淀粉用量1.25 g/100 mL,酵母粉用量1.80 g/100 mL,植酸钙用量1.0 g/100 mL。
关键词:植酸酶;酶活;测定;钒-钼酸铵法;丙酮-磷钼酸铵法
中图分类号:Q93-332 文献标识码:A
文章编号:0439-8114(2019)12-0134-04
DOI:10.14088/j.cnki.issn0439-8114.2019.12.031 开放科学(资源服务)标识码(OSID):
Abstract: The soil sample was collected from the organic-rich environment, and phytase production strains were obtained by preliminary screening with calcium phytate plate transparent ring method. Then phytase activity was determined by two different methods vanadium-ammonium molybdate method and acetone-ammonium phosphomolybdate method, and then compared. The results showed that the method of vanadium-ammonium molybdate was accurate and available. The orthogonal fermentation test determines that pH is 5, the yield of soluble enzyme is 1.25 g/100 mL, the optimum dosage of yeast powder is 1.80 g/100 mL, and the amount of calcium phytate is 1.0 g/100 mL.
Key words: phytase; enzyme activity; measure; vanadium-ammonium molybdate method; acetone-ammonium phosphomolybdate method
植酸(肌醇六磷酸)及植酸盐广泛存在于植物体中,是植物磷的主要贮存形式,占植物中总磷的60%~80%[1]。但植酸磷难以被单胃动物吸收利用,随粪便排出体外会造成水体和土壤的严重磷污染[2]。同时,植酸及其盐还是一种抗营养因子,能与多种金属离子螯合并能与蛋白质等形成难溶的复合物,影响动物对矿质元素和蛋白质的吸收利用[3,4]。植酸酶能将植酸及其盐类降解为肌醇和磷酸(或磷酸盐),作为饲料添加剂可以提高植酸磷的利用率,提高植物性飼料的营养价值,减少畜禽粪便中磷的排放,减轻环境污染[5-7]。传统的产植酸酶菌株的筛选方法为透明圈法,该方法利用微生物在植酸酶筛选培养基上降解植酸钙,在菌落周围生成透明圈来初步判断微生物是否产植酸酶,但有些产酸菌株也能降解植酸钙产生透明圈,故平板透明圈法缺乏特异性和绝对性,必须再对产透明圈的菌株进行液体发酵培养,测定发酵液的植酸酶活性,才能判断出该菌株是否能够产植酸酶。植酸酶活性的测定方法较多,有钒-钼酸铵法、硫酸亚铁-钼蓝法、丙酮-磷钼酸铵法、微板法和微量比色法等[8]。本研究从土壤中粗筛出产植酸酶的菌株,通过钒-钼酸铵法和丙酮-磷钼酸铵法2种方法测定酶活力,确定最适宜本试验菌株的酶活测定方法,为后续试验奠定基础。
1 材料与方法
1.1 菌株
试验菌株为前期实验室所筛产植酸酶菌株。
1.2 主要试剂
植酸钠(P8810,Sigma公司);植酸钙(阿拉丁试剂);其余试剂均为分析纯。
1.2.1 丙酮-磷钼酸铵法 丙酮-磷钼酸铵法测定酶活所需试剂如表1所示。
1.2.2 钒-钼酸铵法 钒-钼酸铵法测定酶活所需试剂如表2所示。
1.3 主要设备
721型分光光度计,PHS-3TC型精密数显酸度计,离心机。
1.4 方法
1.4.1 粗酶液的获得 将实验室前期筛选的植酸酶菌株用马丁斜面进行活化,再从活化斜面取孢子接入4瓶盛有100 mL液体发酵培养基的250 mL摇瓶中,置于26 ℃、150 r/min摇床发酵4 d,过滤离心获得发酵上清液。
1.4.2 发酵条件的研究 实验室前期已经筛选出最适碳源为可溶性淀粉,氮源为酵母粉。对二者用量进行发酵优化,以确定最佳碳氮源以及植酸钙用量,同时选出产酶最适的pH,发酵获得的粗酶液分别用2种方法进行酶活测定。
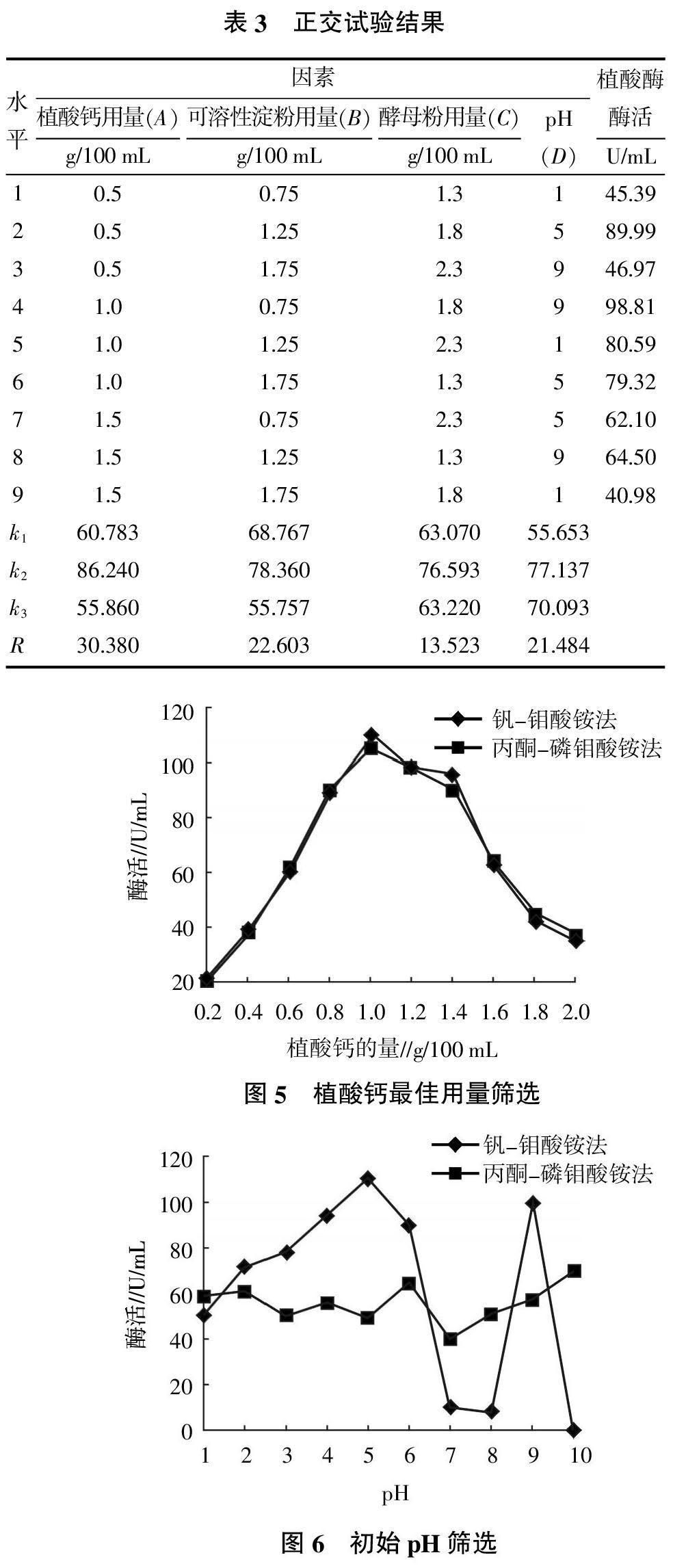
1)可溶性淀粉用量。将淀粉按0.50、0.75、1.00、1.25、1.50 g/100 mL添加到发酵培养基中,确定其最佳用量。
2)酵母粉用量。将酵母粉按1.4、1.6、1.8、2.0、2.2 g/100 mL添加到发酵培养基中,确定其最佳用量。
3)植酸钙用量。调整培养基中植酸钙的用量,在培养基中分别添加0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 g/100 mL,测定酶活,以确定植酸钙的最佳用量。
4)初始pH筛选。调节培养基的初始pH,使其分别为1、2、3、4、5、6、7、8、9、10,测定酶活,以确定产酶最适初始pH。
1.4.3 丙酮-磷钼酸铵法测定不同发酵条件下植酸酶酶活
1)磷标准曲线的绘制。配制浓度分别为0.9、1.2、1.8、2.4、3.0 mmoL/L的磷酸二氢钾溶液,各吸取2 mL,再加入显色液AAP 8 mL,摇匀显色5 min,加入1.0 mL柠檬酸溶液,混匀后在415 nm处比色测定,绘制磷浓度与吸光度的关系曲线,以不加磷酸二氢钾溶液而补加去离子水作为空白。
2)酶活测定。以每分钟从一定浓度的植酸钠溶液中释放1 nmol无机磷为一个酶活单位(U),稀释发酵液到酶活标准曲线范围内,吸取酶液0.5 mL,加入植酸钠溶液0.5 mL。37 ℃水浴60 min,然后加入显色液AAP 8 mL,摇匀显色5 min,加入1.0 mL柠檬酸溶液,以柠檬酸灭活的稀释酶液相同处理作为对照在415 nm處比色测定。
式中,P为对照标准曲线查得的反应液中总磷的浓度;P0为对照标准曲线查得的反应液中本底磷的浓度;20为分析酶液时的总稀释倍数;n为稀释酶液的总稀释倍数;t为酶反应时间。
1.4.4 钒-钼酸铵法测定不同发酵条件下植酸酶酶活
1)磷标准曲线的制备。将磷酸二氢钾母液按照梯度进行稀释,稀释倍数为2、4、8、16、32倍,溶液浓度分别为25.000 0、12.500 0、6.250 0、3.125 0、1.562 5 mol/L,在415 nn波长下测定吸光度,以吸光度为纵坐标,无机磷浓度为横坐标,列出直线回归方程。
2)酶活测定方法。以每分钟从一定浓度的植酸钠溶液中释放1 nmol无机磷为1个酶活单位(U)。取10 mL试管进行操作。首先将0.9 mL乙酸缓冲液与0.2 mL待反应液混合,水浴锅37 ℃预热5 min,然后加入2 mL植酸钠,混匀后水浴锅37 ℃水解30 min,最后加入2 mL终止液。反应后的试样在室温下静置10 min,如出现混浊需在离心机上4 000 r/min离心10 min,取上清液以标准空白调零,在分光光度计415 nm波长处测定样品吸光度,根据公式计算酶活。
式中,U为试样中植酸酶的活性(U/mL);c为根据实际样液的吸光度由直线回归方程计算出的y值;F为试样溶液反应前的总稀释倍数;v为试样反应体积(mL);30为反应时间(min)。
2 结果与分析
2.1 不同方法测定酶活磷标准曲线的绘制
2.1.1 丙酮-磷钼酸铵法磷标准曲线 按照“1.4.3”的方法制作磷标准曲线,以磷浓度为横坐标,OD415 nm的值为纵坐标绘制磷标准曲线,结果如图1所示。
2.1.2 钒-钼酸铵法磷标准曲线 按照“1.4.4”的方法制作磷标准曲线,以吸光度为纵坐标,无机磷浓度为横坐标,结果如图2所示。
2.2 不同方法测定不同发酵条件下植酸酶酶活
2.2.1 可溶性淀粉最佳用量筛选 将加入不同量淀粉的培养基进行振荡培养,用2种方法测定植酸酶酶活,两者之间的差异很小,确定出其最佳用量为1.25 g/100 mL,结果如图3所示。
2.2.2 酵母粉最佳用量筛选 将加入不同用量酵母粉的培养基进行振荡培养,用2种方法测定植酸酶酶活,所得酶活变化趋势相同,确定酵母粉最佳用量为1.80 g/100 mL,结果如图4所示。
2.2.3 植酸钙最佳用量筛选 由图5可知,对加入不同植酸钙的培养基进行振荡培养,用2种方法测定植酸酶酶活,两者之间的差异很小,确定植酸钙的最佳用量为1.0 g/100 mL。
2.2.4 不同初始pH的筛选 改变培养基中pH,用2种发法测定粗酶液酶活力,丙酮-磷钼酸铵法虽然测出了植酸酶的酶活,但均值在60 U/mL左右,没有显示出酶活差异,出现较大误差;通过钒-钼酸铵法测定植酸酶的酶活,可以看出植酸酶酶活最佳pH为5,结果如图6所示。
2.3 正交试验
将所选的最佳碳氮源淀粉用量、酵母粉用量、初始pH及植酸钙用量进行正交试验分析,确定出最佳的培养基成分。由表3可知,影响植酸酶酶活的主次因素为植酸钙用量(A)>可溶性淀粉用量 (B)>pH(C)>酵母粉用量(B),其最佳组合方案为A2B2C2D2,即100 mL液体培养基中含有1.25 g淀粉、1.80 g酵母粉、pH 5、植酸钙1.0 g。
3 小结
通过摇菌获得植酸酶粗酶液,通过2种方法对其进行酶活检测,并进而进行发酵条件的研究,确定出最佳培养基组成。钒-钼酸铵法被确定为本试验最适宜的酶活检测方法。现在测定植酸酶酶活的方法在逐渐改进,但是也没有明确的指定测定方法,本试验采用2种方法测定植酸酶酶活,出现了较大差异,其原因正在进一步验证中。因本次筛选的植酸酶菌株可能为一种新的菌种,其生理生化规律有待进一步研究。
参考文献:
[1] 施安辉,王光玉,李桂杰,等.目前国内外植酸酶研究进展[J].中国酿造,2005,146(5):5-10.
[2] 梁欣,于晓丽.植酸酶在家禽饲料中应用的研究进展[J].山东畜牧兽医,2012,183(4):81-83.
[3] SONI S K,MAGDUM A,KHIRE J M.Purification and characterization of two distinct acidic phytases with broad pH stability from Aspergillus niger NCIM 563[J].World J Microbiol Biotechnol,2010,26(11):2009-2018.
[4] LIEBERT F,PORTZ L.Different sources of microbial phytase in plant based low phosphprus diets of Nile tilapia Oreochromis niloticus may provide different effects on phytate degradation[J].Aquaculture,2007,267(1-4):292-299.
[5] ZHANG R,YANG P L,HUANG H Q,et al.Two types of phytases(histidine acid phytase and beta-propeller phytase) in Serratia sp. TN49 from the gut of Batocera horsfieldi(coleoptera) larvae[J].Curr Microbiol,2011,63(5):408-415.
[6] HUANG H,ZHANG R,FU D,et al. Diversity,abundance and characterization of ruminal cysteine phytases suggest their important role in phytate degradation[J].Environ Microbiol,2011,
13(3):747-757.
[7] FORTES-SILVA R,SANCHEZ-VAZQUEZ F J,MARTINEZ F J.Effects of pretneating a plant-based diet with phytase on diet selection and nutrient uticization in European sea bass[J].Aquaculture,2011,319(3):417-422.
[8] 程海娜.黑曲霉植酸酶菌株選育及其酶的分离纯化和性质研究[D].长沙:湖南师范大学,2003.
收稿日期:2019-01-15
作者简介:徐丹丹(1989-),女,吉林德惠人,在读硕士研究生,研究方向为重要农艺性状基因的分离功能鉴定及品种改良,
