饲料中添加根瘤菌对凡纳滨对虾生长和抗氧化酶活力的影响
2019-08-10管振国窦勇于士国周文礼邵蓬高金伟贾旭颖
管振国 窦勇 于士国 周文礼 邵蓬 高金伟 贾旭颖
摘 要:通过在凡纳滨对虾基础饲料中添加根瘤菌制剂,研究根瘤菌对对虾生长性能和抗氧化酶活力的影响。结果表明,试验组中对虾生长指标及血清、肝胰脏中抗氧化酶活力均比对照组有所提高,其中酚氧化酶(PO)、超氧化物歧化酶(SOD)、碱性磷酸酶(AKP)活性显著增强(P<0.05)。因此,饲料中添加根瘤菌可以促进凡纳滨对虾生长,提高对虾存活率、肥满度和特定生长率,降低饵料系数,提高抗氧化酶活性,增强其抗病能力。通过在饲料中添加不同浓度根瘤菌的对比试验,最终确定饲料中添加根瘤菌的最适剂量为2 g·kg-1。
关键词:凡纳滨对虾;根瘤菌;生长;抗氧化酶
中图分类号:S96 文献标识码:A DOI 编码:10.3969/j.issn.1006-6500.2019.07.010
Abstract: Growth and antioxidase activities of Litopenaeus vannamei were studied through Rhizobium adding in the basic fodder. The results indicated that, the growth indicators and antioxidase activities in serum and hepatopancreas of Litopenaeus vannamei in the test groups were higher than the control group, and especially the activities of PO, SOD and AKP were higher than the control group significantly(P<0.05). According to the results, the survival rate, fullness, specific growth rate and antioxidase activities increased through Rhizobium adding in the basic fodder, while the feed coefficient decreased simultaneously. According to the experiment, the optimal addition in the basic fodder was 2 g·kg-1.
Key words: Litopenaeus vannamei; rhizobium; growth indicators; antioxidase activities
凡納滨对虾(Litopenaeus vannamei),也称为南美白对虾,属有鳃亚门、甲壳纲、十足目、对虾科、对虾属,原产于中南太平洋海岸水域秘鲁北部至墨西哥桑诺拉,于1988年由中科院海洋研究所张伟权教授引进,后来逐渐在我国由南向北进行实验推广并获得成功,现已发展成为我国养殖产量最大的经济虾类[1]。但随着养殖体量的不断提高,带病虾苗和高密度养殖带来的病害给凡纳滨对虾养殖产业造成了严重损失,而使用化学药物防治病害又产生了药残等二次污染,因此,绿色环保的微生态制剂成为化学药物的理想替代品。归纳来说,微生态制剂的功能主要有:调节养殖生物肠道菌群平衡;微生态制剂的生物组份分泌抑菌物质抑制病原菌繁殖;生物组份在特定环境下产生各种消化酶,促进营养物质的消化、吸收及利用;提高饲料利用率;具有良好的免疫原性,可以激活非特异性免疫因子活性[2-3]。目前,水产养殖中使用的益生菌种类繁多,主要有EM菌、乳酸菌(Lactic acid bacteria)、光合细菌(Photosynthetic bacteria)、芽孢杆菌(Bacillus bacteria)、硝化细菌(Nitrifying bacteria)和丁酸梭菌(Clostridium butyricum)等[4-7]。根瘤菌是变形菌门、根瘤菌目、根瘤菌科微生物的统称,可以与豆科植物共生并能固定空气中氮素的一类革兰氏阴性菌。目前,根瘤菌在农业上的应用已有许多研究,但在水产养殖领域的应用至今少见报道,目前仅有李海兵[8]研究发现,根瘤菌对中国对虾(Penaeus chinensis)仔虾的肠道具有保护作用,是对虾养殖过程中的一种潜在益生菌。项目组前期对根瘤菌的培养基进行了优化,大幅提高了细菌培养效率并降低了使用成本。为了进一步挖掘根瘤菌作为微生态制剂的效能,本研究通过在凡纳滨对虾基础饲料中添加根瘤菌制剂,分析对虾生长和抗氧化酶活性变化,为根瘤菌在水产养殖中的合理应用提供一定的数据支持和试验证据。
1 材料和方法
1.1 试验材料与装置
试验于河北省唐山市金鹏养殖基地进行,试验材料选用泰国正大自交系的F1代虾苗,对虾基础饵料购于唐山金鹏饲料有限公司。选取18个养殖池(规格为5 m×6 m×1.4 m)作为试验场所,分成6组,编号分别为对照组C1和试验组C2,C3,C4,C5,C6,每组设3个重复。制作直径为1.3 m、高度1.5 m的网箱18个,分成6组,分别编号为对照组QC和试验组QS0.5、QS1、QS2、QS3和QS4,每组设3个重复。养殖池与网箱相对应,即C1池对应QC组,C2池对应QS0.5组,以此类推。
1.2 饲养管理
虾苗培育至体长3.5 cm左右,虾苗初始体质量(0.72 ± 0.01 )g·尾-1,对虾标粗结束后,随机选取300尾凡纳滨对虾称质量后放入网箱中。为保证网箱试验环境同实际生产环境的一致性,每个网箱距池壁1.5 m。养殖用水为过滤的天然海水,盐度为(29 ±1)‰,水温为(28 ± 2) ℃,溶氧为(7.3±0.3)mg·L-1。每天投饵4次(分别在06:00、10:00、14:00、22:00),投喂量为对虾体质量的6%~10%。养殖前期(0~4周)每天换水量为池水的1/4~1/3,中后期(5~8周)每天换水量为池水的1/3~1/2。整个试验仅在投饵期间停止曝气,投喂饵料1 h后恢复曝气。
1.3 试验设计
投喂饵料2 h前,先将根瘤菌兑水稀释5倍后再和饲料充分搅拌,根瘤菌在饲料中添加的剂量分别为0,0.5%,1.0%,2.0%,3.0%和4.0%,与之相对应的网箱编号为QC组、QS0.5组、QS1组、QS2组、QS3组和QS4组。每次投喂后40 min利用虹吸管收集网箱中残饵,经烘箱70 ℃烘干后记录投喂量和残饵量,每周称质量1次,用以矫正投饵率,记录投饵量。每周检测水体pH值、氨氮、亚硝酸盐,总氮和硝酸盐浓度。试验周期为56 d。
1.4 凡纳滨对虾生长指标测定
称取每个网箱中凡纳滨对虾总质量并记录终末存活数Nf,用于计算成活率;随机抽取15尾对虾称质量,测量体长,用于计算肥满度;在冰盘上解剖分离肝胰脏用滤纸洗掉水分后称质量,用于计算肝体比。各指标计算公式如下:
1.5 凡纳滨对虾血清和肝胰脏中抗氧化酶测定
在网箱中随机抽取15尾对虾取血,取血部位在对虾的第5步足基部血窦中。血液放置于1.5 mL离心管中,为防止凝固,在离心管内加入适量抗凝剂,在冰箱内(4 ℃)放置24 h,然后以5 000 r·min-1离心10 min,取其上清液置于-80 ℃超低温冰箱内待测。再将15尾对虾在冰盘上取出肝胰腺,用滤纸吸干水分后称重后置于10 mL离心管中,加入9倍體积匀浆介质,冰浴匀浆,冷冻离心(4 ℃,10 000 r·min-1,10 min),取上清液分装于1.5 mL离心管中,用于超氧化物歧化酶(SOD)、酚氧化酶(PO)、过氧化氢酶(CAT)和碱性磷酸酶(AKP)测定。
将每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量定义为一个SOD酶活力单位(U);将反应体系中OD490每分钟增加0.001定义为一个PO酶活力单位(U);将每毫克组织蛋白每秒钟分解1 μmol H2O2的量定义为一个CAT酶活力单位(U),将每克组织蛋白在37 ℃与基质作用15 min产生1 mg酚定义为1个AKP酶活力单位(U)。SOD、PO、CAT活性以酶活单位·毫克蛋白-1(U·mg-1)表示,AKP活性以酶活单位·克蛋白-1(U·g-1)表示。所有指标测试方法均参照商品化试剂盒(购自南京建成生物工程研究所)进行,吸光度值使用UV-1240紫外-可见分光光度计测定。
1.6 数据处理
对虾生长指标和抗氧化酶活力数据均以平均值±标准差(Mean±SD)表示。使用SPSS 17.0软件进行统计分析。其中对虾生长指标使用单因素方差分析(one-way ANOVA),抗氧化酶活性使用配对T检验分析。
2 结果与分析
2.1 饲料中添加根瘤菌对凡纳滨对虾生长的影响
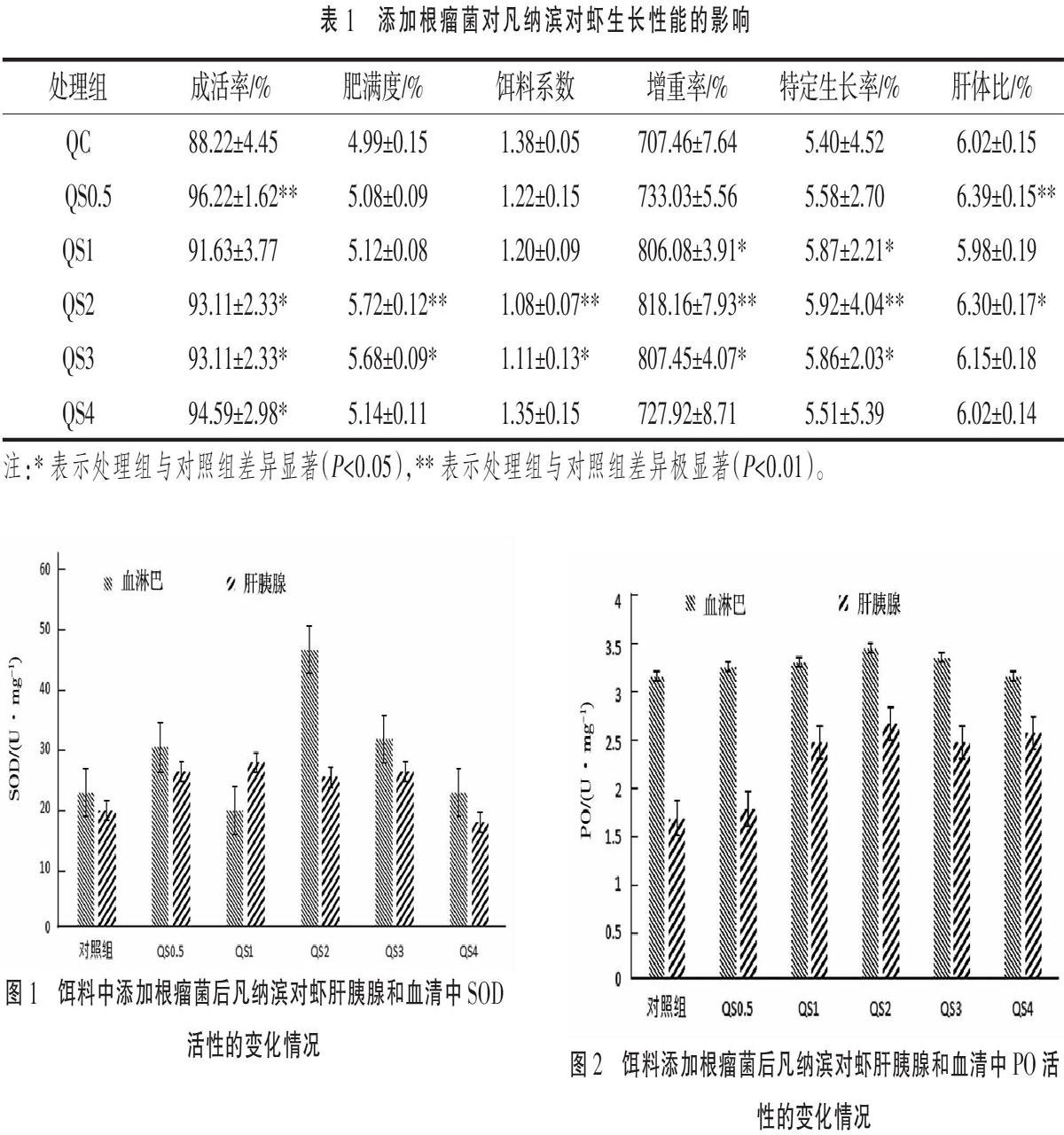
由表1可知,在凡纳滨对虾成活率方面QS0.5组极显著高于对照组(P<0.01),其他试验组虽都有所提高,但没有出现先升高后降低的趋势。在肥满度、增重率、饵料系数和特定生长率方面QS2极显著高于对照组(P<0.01),肥满度、增重率、饵料系数和特定生长率分别为(5.72±0.12)%、(818.16±7.93)%、(1.08±0.07)和(5.92±4.04)%,且肥满度、增重率和特定生长率出现了先上升后下降的趋势。通过以上数据和实际生产的需求,最终确定根瘤菌在饲料中的最适添加量为2 g·kg-1。
2.2 饲料中添加根瘤菌对凡纳滨对虾抗氧化酶活性的影响
2.2.1 对凡纳滨对虾SOD活性的影响 饵料添加根瘤菌对凡纳滨对虾肝胰腺和血清中SOD活性的影响如图1所示。QS2组血清中SOD活力为46.5 U·mg-1,QS1组肝胰腺中SOD活力为27.5 U·mg-1,均显著高于对照组(P<0.05),血清中SOD活性随根瘤菌添加量的变化出现先升高后降低的趋势。
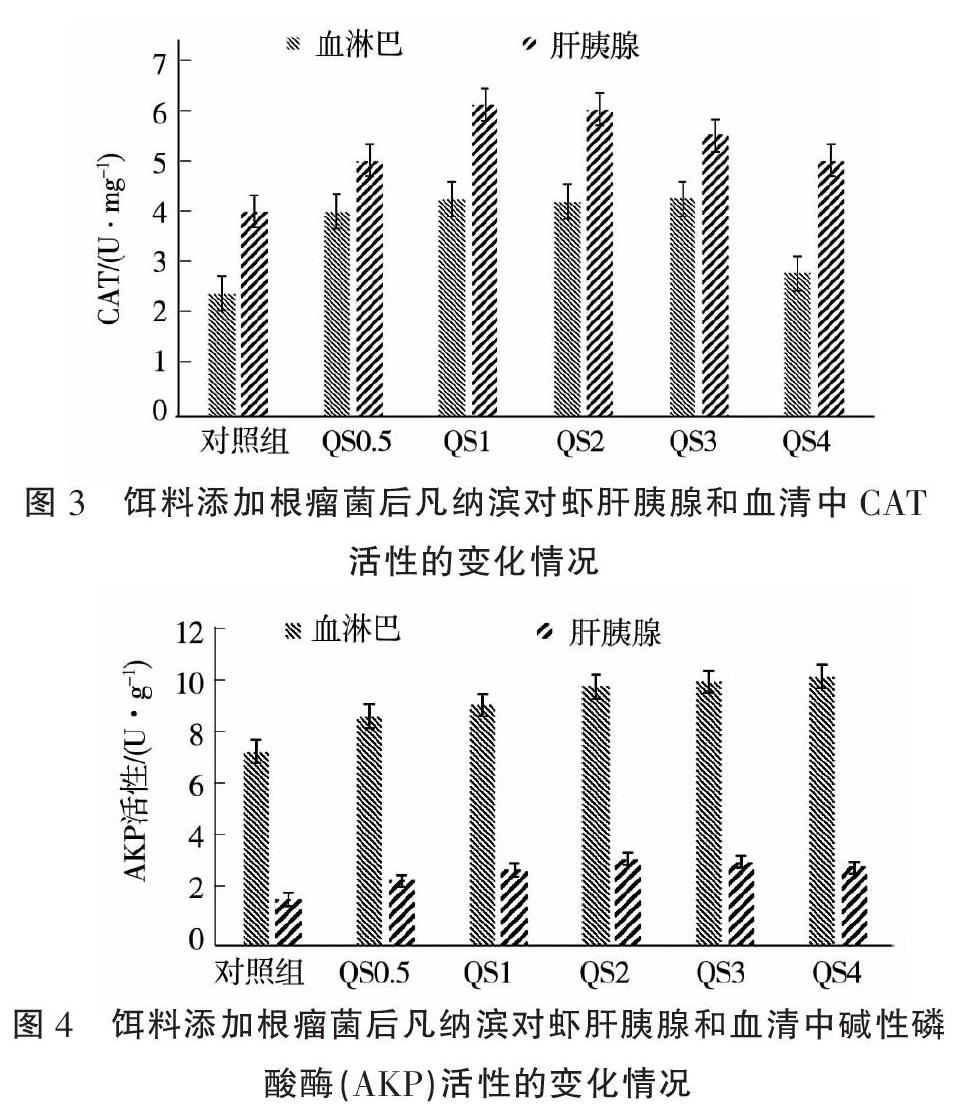
2.2.2 对凡纳滨对虾PO活性的影响 饵料中添加根瘤菌对凡纳滨对虾血清PO活性的影响见图2。随根瘤菌添加量的增加,虽然对虾血清和肝胰腺中PO活性均呈现先升高后降低的变化趋势,但血清中PO活力同对照组相比不显著(P>0.05),而QS2组肝胰腺中PO活性达到最高值为2.71 U·mg-1,进一步验证了根瘤菌在饲料中的最适添加量为2 g·kg-1。2.2.3 对凡纳滨对虾CAT活性的影响 饵料中添加根瘤菌对凡纳滨对虾肝胰腺和血清中CAT活性的影响如图3所示。随根瘤菌添加量的增加,对虾血清和肝胰腺中过氧化氢酶CAT活性均呈现先升高后降低的变化趋势。试验组均显著高于对照组(P<0.05)。CAT活力最高值出现在QS1组,血清中CAT活性最高值为4.25 U·mg-1,而肝胰腺中CAT活性峰值为6.10 U·mg-1。
2.2.4 对凡纳滨对虾AKP活性的影响 饵料添加根瘤菌对凡纳滨对虾肝胰腺和血清中AKP活性的影响如图4所示,血清中AKP活性随根瘤菌添加量的增加不断升高,而肝胰腺中AKP活力随根瘤菌添加量的增加出现先升高后降低的趋势。试验组肝胰腺中AKP活性较对照组差异显著(P<0.05),肝胰腺中AKP活性最强的出现在QS2组,达3.2 U·g-1。
3 讨 论
3.1 饲料中添加根瘤菌对凡纳滨对虾生长性能的影响
在添加不同微生态制剂用于大菱鲆、草鱼、吉富罗非鱼的试验结果均表明,微生态制剂都能促进水产养殖动物生长,提高其生长性能[9-11]。在青鱼基础饲料中添加不同浓度的枯草芽抱杆菌8周后,试验组青鱼终体质量和鱼体增质量均显著高于对照组(P<0.05),而饵料系数显著低于对照组(P<0.05)[12]。有研究证实[13],将两株枯草芽孢杆菌作用于凡纳滨对虾,对虾增重率和特定生长率均显著提高(P<0.05)。有研究指出[14],菌株的品种、活性、培养条件、添加浓度、投喂方式和饲养环境条件等都会使益生菌对水产养殖动物的作用效果产生差异。微生态制剂自身可以提供一部分可吸收蛋白,同时还有利于促进饲料中蛋白质的消化、吸收。有研究者发现[8],根瘤菌有助于改善中国对虾仔虾肠道健康状况,促进营养物质消化吸收,利于对虾生长,这与本研究的结论一致。本研究的试验结果证实,饲料中添加根瘤菌有利于提高凡纳滨对虾的肥满度、增重率、特定生长率并降低饵料系数。在成活率方面,试验组较对照组差异不显著(P>0.05),这与保苗结束后对虾体质相对较好同时成活率较高有关,通过这一点也恰恰反映了养殖初期保苗的重要性[15]。试验组对虾的饵料系数出现了先降低后升高的趋势,说明饲料中添加根瘤菌有利于降低饵料系数,但并不是添加量越多越好,根据试验最终确定根瘤菌的最适添加量为2 g·kg-1。
3.2 饲料中添加根瘤菌对肝胰腺和血清中抗氧化酶活性的影响
本试验研究了饲料中添加根瘤菌对凡纳滨对虾血清和肝胰腺中SOD、PO、CAT和AKP活性的影响。这4种酶在甲壳动物非特异性免疫中发挥了重要作用,其中SOD和CAT是机体内的抗氧化酶,在清除超氧自由基,防止生物大分子损伤方面发挥重要的生理作用[16];酚氧化酶原系统是对虾防御和识别的重要系统[2];AKP是动物体内重要的解毒酶类[17]。已有研究表明,添加益生菌可以提高水产动物的非特异性免疫活力。黄美珍[18]将光和细菌拌入中国对虾的饲料,经过22 d试验发现虾体PO、SOD和溶菌酶活力均比对照组显著提高,本研究也得到了相似的结论。试验结果表明,根瘤菌处理后凡纳滨对虾血清和肝胰腺中SOD、PO、CAT、AKP 4种酶的活力较对照组均有所提高,其中SOD、CAT活性随着根瘤菌添加量的不同表现出先升高后降低的趋势,尤其是SOD活性较对照组差异显示不断上升的趋势,这可能与根瘤菌与肠道内有害菌群竞争有关,其内在作用机理需要进一步研究。这说明凡纳滨对虾饲料中添加根瘤菌,可以提高血清和肝胰腺中相关免疫酶的活性,这与SOD和PO在体内清除超氧自由基,防止生物分子损伤的作用有关,提高了凡纳滨对虾机体免疫力和肝胰腺的消化能力,减少疾病的发生。
参考文献:
[1]王兴强,马甡,董双林.凡纳滨对虾生物学及养殖生态学研究进展[J].海洋湖沼通报,2004(4):94-100.
[2]孟凡伦,张玉臻,孔健.甲壳动物中的酚氧化酶原激活系统研究评价[J].海洋与湖沼,1999,30(1): 110-116.
[3]张洪亮.微生态制剂的作用机理及应用中存在的问题[J].现代畜牧科技,2018 (3):24.
[4]方云东.EM菌在南美白对虾养殖中的应用试验[J]. 北京水产,2004(2): 30-31.
[5]陆家昌,黄翔鹄,李活,等.光合细菌对养殖水质及凡纳滨对虾抗病力的影响[J]. 广东海洋大学学报,2009,29(6): 87-91.
[6]王明阳,田相利,刘龙镇,等.饲料中添加凝结芽孢杆菌对凡纳滨对虾生长、血清非特异性免疫指标及抗病力的影响[J].中国海洋大学学报(自然科学版),2018,48(21): 8-15.
[7]沙玉杰.乳酸菌对凡纳滨对虾益生机理的研究[D]. 青岛:中国科学院研究生院(海洋研究所),2016.
[8]李海兵.对虾肠道益生菌的筛选与免疫物质活性评价指标的建立[D]. 青岛:中国海洋大学,2008.
[9]高凤样,郭文,潘雷.几种益生菌对大菱鲆幼鱼生长及消化酶活性的影响[J].海洋科学,2011,35(1):10-16.
[10]沈文英,傅玲琳,李卫芬.枯草芽孢杆菌表达的VP28对凡纳滨对虾免疫力和抗病毒感染的影响[J].水生生物学报,2012,36(2): 375-378.
[11]刘小玲,曹俊明,邝哲师,等.嗜酸乳酸菌对吉富罗非鱼生长、非特异性免疫酶活性和肠道菌群的影响[J] .广东农业科学,2013,40(1):123-126.
[12]沈斌乾,陈建明,郭建林,等.饲料中添加枯草芽巧杆菌对青鱼生长、消化酶活性和鱼体组成的影响[J] .水生生物学报,2013(1): 48-53.
[13]解颖,吴翔宇,司和,等.芽孢杆菌Hy6在对虾养殖生产中的应用研究[J].现代农业科技,2018(23): 224-225.
[14]黄海洪.凡纳滨对虾(Litopenaeus vannamei)抗哈维氏弧菌(Vibrio harveyi)感染的免疫应答特征研究[D]. 杨凌:西北農林科技大学,2014.
[15]马良骁.工厂化要养好虾,做好水、标好苗是关键[J].当代水产,2018,43(10): 87.
[16]张春玲,胡俊峰,王丕文.苯并(a)芘对鲫鱼肝脏总抗氧化能力的影响[J].环境与健康杂志,2004,21(5): 325-326.
[17]张明明,王雷,王宝杰,等.凡纳滨对虾碱性磷酸酶和酸性磷酸酶基因的克隆、表达及盐度应答效应[J].海洋科学,2017,41(1): 83-84.
[18]黄美珍.光和细菌对致病弧菌的抑制作用[J]. 台湾海峡,1999,18(1):92-94.
