冠突散囊菌发酵黑毛茶提取液的研究
2019-08-08邹敏敏董其惠苏二正
邹敏敏,董其惠,黄 彦,苏二正
(1.南京林业大学轻工与食品学院 ,江苏南京210037; 2.南京林业大学南方现代林业协同创新中心,江苏南京210037)
茯砖茶属黑茶类,历史上主要销往我国的西北部边疆等少数民族地区,故又称为“边销茶”。茯砖茶生产历史悠久,始于唐,盛于明清,在汉族与少数民族的贸易史上占有十分重要的地位。茯砖茶是一种后发酵茶,其中冠突散囊菌是产生其特征风味的优势菌种[1]。
冠突散囊菌,俗称为“金花菌”,是属于散囊菌目发菌科散囊属的一种真菌,对茯砖茶风味品质的形成具有重要作用[2],也是国家标准中黑茶种类里唯一有“冠突散囊菌”这一指标的品种[3]。茯砖茶的营养成分非常多,最主要的是维生素、矿物质,特别是茶碱的含量较高。其中包括维生素B1、B2、C 等多种水溶性维生素以及Na、K、Fe、Cu、P及F等28 种矿物质。茯砖茶中的蛋白质、氨基酸及糖类等营养物质也是饮用者的重要营养来源[4]。长期饮用茯砖茶,不但可以预防心脑血管疾病及癌症,还有明显的免疫调节、延缓衰老等作用[5]。
目前茯砖茶制造中,选用3~4级黑毛茶为原料,通过筛分、汽蒸、沤堆发酵、称茶、蒸茶、压制、包装、发花、干燥、检验等工序精制而成[6]。虽然有关茯砖茶固态发酵制备技术已日渐成熟,但是整个工序步骤繁杂、发酵发花时间长。此外,由于采用固态发酵,发酵环境条件控制困难、管理粗放、卫生条件差。近年来,发酵型茶饮料开始在茶饮料市场崭露头角。与传统的茶饮料相比,发酵型茶饮料有许多突出的优点,比如品质成分得到改善,有效成分增多等。尽管当前还没有发酵茶饮料国家标准,但是市场上已有参照其他发酵饮料标准开发的红茶菌、乳酸菌发酵茶饮料。2016年12月7日,国家卫计委新食品原料受理系统接受了冠突散囊菌(CGMCC NO.8730)新食品原料申请(卫食新申字(2016)第0011号)。
基于上述背景,本研究中,笔者拟以黑毛茶为原料,浸提获得黑毛茶提取液后接种冠突散囊菌,通过培养条件优化,使冠突散囊菌在黑毛茶提取液中的生长繁殖量达到最大化,旨在为后续开发冠突散囊菌液态发酵茶饮品奠定基础。
1 材料与方法
1.1 材料与试剂
黑毛茶,湖南竹湘记;冠突散囊菌,保藏于南京林业大学发酵食品实验室;马铃薯葡萄糖琼脂培养基(PDA),青岛霍普生物技术有限公司;大豆蛋白、乳清蛋白、脱脂奶粉,上海瑞永生物科技有限公司;葡萄糖、果糖、NH4Cl、CaCl2等均为分析纯,国药集团化学试剂有限公司。
1.2 实验方法
1.2.1 冠突散囊菌活化
取出-20 ℃保存的菌种,在无菌操作台上于PDA平板上划线。在28 ℃、相对湿度85%的条件下恒温恒湿培养。培养至平板上长有金色闭囊壳后(约72 h),再次挑取边缘金黄色的菌落接种到新的PDA培养基上。重复上述操作2~3次。
1.2.2 冠突散囊菌孢子悬液的制备
挑取已培养72 h的冠突散囊菌,转移到盛有无菌水的三角烧瓶中,加入几颗玻璃珠,220 r/min振荡45 min。用血球计数板进行孢子计数,调节浓度,使得孢子悬液的密度为4.8×105个/mL。
1.2.3 黑毛茶提取液的制备
参照文献[7]的方法。称取3 g磨碎的黑毛茶茶粉,置于1 000 mL的锥形瓶中,加入450 mL煮沸的蒸馏水,沸水浴浸提45 min,每隔10 min摇动一次。浸提完成后立即减压抽滤,去除茶渣后将滤液移至容量瓶中,用蒸馏水定容至500 mL,得到质量浓度为6 g/L的黑毛茶提取液。
1.2.4 菌丝干质量的测定
取适量滤纸,80 ℃烘干4 h至质量恒定,分别称质量并记录。将发酵完成的菌液用已称量的滤纸抽滤,滤除滤液,将留有菌丝和孢子的滤纸再次放入80 ℃烘箱烘干6 h至质量恒定,称量并计算出菌丝干质量[8]。
1.2.5 发酵培养基的优化
以不添加任何其他物质的黑毛茶提取液(6 g/L)为空白组。碳源种类优化选用果糖、蔗糖、乳糖、麦芽糖、葡萄糖和木糖醇等6种,氮源种类优化选用大豆蛋白、乳清蛋白、脱脂奶粉、尿素、NH4Cl、NaNO3、(NH4)2SO4和NH4NO3等8种有机和无机氮源,无机盐选用KCl、ZnSO4、MgSO4、Fe2(SO4)3、NaCl和CaCl2等6种。黑毛茶提取液设3、6、9、12和15 g/L共5个质量浓度进行考察。于500 mL三角瓶中装150 mL培养液,121 ℃高压灭菌20 min,冷却至室温后,每个三角瓶中接种3 mL孢子悬液(4.8×105个/mL),28 ℃、120 r/min培养72 h,测定菌丝干质量,每组3个平行样。
1.2.6 发酵条件的优化
以最佳培养基作为发酵培养基,对装液量、接种量、初始pH、发酵时间这4个参数进行优化。接种量设1、2、3、4、5和6 mL等6个水平;初始pH设3、4、5、6、7和8这6个水平;装液量设25、50、75、100、125和150 mL这6个水平(V(装液量)∶V(孢子悬液)=50∶ 1);在最佳培养基和培养条件下培养,每隔24 h取样测定菌丝干质量,考察发酵时间的影响。
1.3 理化成分的测定
pH直接用pH计测定;水浸出物含量测定参照文献[7];茶多酚含量测定参照文献[9];蛋白质含量测定参照文献[10];总黄酮测定参照文献[11];茶色素测定参照文献[12];游离氨基酸含量测定参照文献[13];游离氨基酸类别测定参照文献[14];香气成分测定利用气相色谱-质谱(GC-MS)法进行分析,具体参照文献[15]。
2 结果与讨论
2.1 发酵培养基成分的优化
2.1.1 碳源对冠突散囊菌生长的影响
碳源在微生物的生长过程中起着不可或缺的作用,在微生物的培养过程中,常用的碳源有糖类、油脂、小分子醇类、有机酸和有机酸酯等。本文中,笔者选取6种糖类作为碳源,冠突散囊菌生长情况如图1所示。

图1 碳源种类对冠突散囊菌生长的影响Fig.1 Effects of carbon sources on growth of Eurotium cristatum
由图1可见:冠突散囊菌在添加碳源的黑毛茶提取液中的生长情况优于空白组,即外加碳源能够促进冠突散囊菌的生长。其中,葡萄糖的促进效果最好,这与刘作易等[16]、尹旭敏[17]的研究结果一致;麦芽糖的效果次之;果糖、木糖醇和蔗糖的效果相当,三者无显著性差异;乳糖效果最差。进一步对葡萄糖的添加浓度进行优化,设置10、30、50、70和90 g/L这5个质量浓度进行考察,结果如图2所示。

图2 葡萄糖质量浓度对冠突散囊菌生长的影响Fig.2 Effect of glucose concentration on growth of Eurotium cristatum
由图2可以看出:冠突散囊菌的菌丝干质量随着葡萄糖浓度的提高而增加,其增长趋势在10 ~70 g/L区间较为明显,在70~90 g/L区间趋于平缓。本实验中,葡萄糖质量浓度只优化到90 g/L,原因一是考虑到吕嘉枥等[18]提出,过高的糖浓度会使冠突散囊菌产生无性孢子,从而影响到其有性孢子的数量;二是过高的糖浓度不利于后期发酵茶饮品的开发。因此,选取90 g/L葡萄糖为最佳碳源用量。
2.1.2 氮源对冠突散囊菌生长的影响
冠突散囊菌在生长繁殖的过程中,需要氮源来合成如氨基酸、蛋白质、核酸等菌体细胞物质。笔者选用了4种有机氮源和4种无机氮源,冠突散囊菌生长情况如图3所示。

图3 氮源种类对冠突散囊菌生长的影响Fig.3 Effects of nitrogen sources ongrowth of Eurotium cristatum
由图3可见:有机氮源中,将尿素添加到黑茶提取液中时,菌体不生长,而其他3种均能促进菌体的生长,效果从高到低依次是乳清蛋白、大豆蛋白、脱脂奶粉;无机氮源中,添加NH4NO3时菌丝干质量最大、(NH4)2SO4次之、NaNO3略高于NH4Cl。该结果与刘作易[16]的研究相一致。由于3种有机氮源添加到黑茶提取液中会使发酵液变浑浊,从而影响成品外观,此外,由于明令禁止食品中添加NH4NO3,(NH4)2SO4易与Ca2+形成沉淀等原因,最终选取NH4Cl作为最佳氮源。进一步对NH4Cl质量浓度进行优化,设置2.5、5.0、7.5、10.0、12.5和15.0 g/L这6个质量浓度进行考察,结果如图4所示。
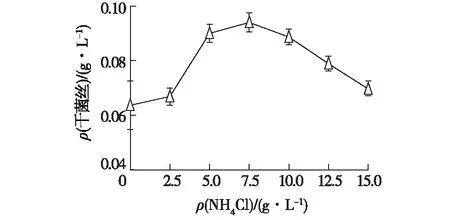
图4 NH4Cl质量浓度对冠突散囊菌生长的影响Fig.4 Effect of ammonium chloride concentration ongrowth of Eurotium cristatum
从图4可以看出,NH4Cl质量浓度在0~7.5 g/L时,其菌丝干质量随着NH4Cl浓度升高而增加;在NH4Cl质量浓度为7.5 g/L时,达到最大值;NH4Cl质量浓度高于7.5 g/L时,菌丝干质量随其浓度升高而减小。因此,NH4Cl的最佳质量浓度选取7.5 g/L。
2.1.3 无机盐对冠突散囊菌生长的影响
考虑到发酵液的可食用性,根据食品添加剂标准,选择了CaCl2等6种无机盐,研究其对冠突散囊菌生长的影响,结果如图5所示。

图5 无机盐种类对冠突散囊菌生长的影响Fig.5 Effects of inorganic salts on growth of Eurotium cristatum
由图5可知,除ZnSO4和Fe2(SO4)3外,其他4种无机盐均能促进菌体的生长,其中CaCl2效果最好。比较KCl、NaCl和CaCl2对菌丝干质量的影响,表明 Cl-对菌体的生长可能存在一定的促进作用,但使CaCl2对菌丝生长起显著性促进作用的应为Ca2+。具体Ca2+如何影响菌体生长,有待进一步研究。选取CaCl2为最佳无机盐,对其浓度进行优化,设置2.5、5.0、7.5、10.0、12.5和15.0 g/L这6个质量浓度进行考察,结果如图6所示。

图6 CaCl2质量浓度对冠突散囊菌生长的影响Fig.6 Effect of calcium chloride concentration ongrowth of Eurotium cristatum
由图6可以看出,CaCl2质量浓度为0~2.5 g/L时,菌丝干质量呈直线上升趋势;5 g/L时,达到最大值;在5~15 g/L时呈下降趋势,推测原因可能为该浓度区间不利于冠突散囊菌的生长繁殖,也可能为在该区间冠突散囊菌大量繁殖,但受到发酵摇瓶空间及碳氮源的制约,进而阻碍了冠突散囊菌的生长。
2.1.4 黑毛茶提取液浓度对冠突散囊菌生长的影响
对于空白组实验,在未添加任何碳氮源、无机盐的黑毛茶提取液中,冠突散囊菌依然可以生长,这说明黑毛茶提取液自身就含有一定量的糖类和小分子氨基酸等物质,可以为菌体生长提供碳氮源等物质,因此推测其浓度也会影响菌体的生长。为此,黑毛茶提取液设3、6、9、12和15 g/L这5个质量浓度进行考察,结果如图7所示。

图7 黑毛茶提取液质量浓度对冠突散囊菌生长的影响Fig.7 Effect of extraction solution concentration of raw dark tea on growth of Eurotium cristatum
从图7可以看出,黑毛茶提取液浓度与菌体生长有显著的相关性。在3~9 g/L时,菌丝干质量随着提取液浓度的升高而增加;9 g/L时,达到最大值;质量浓度高于9 g/L时,菌丝干质量随着浓度升高而降低。这与尹旭敏[17]的实验结果相似。
通过上述培养基成分的一系列优化,得到了冠突散囊菌液态发酵黑茶的最佳培养基成分及其浓度,以此作为最适培养基培养冠突散囊菌(实验组),与未经过优化的黑毛茶提取液进行对比(空白组),分别研究菌体的生长情况,结果如图8所示。

图8 优化前后培养基对冠突散囊菌生长的影响Fig.8 Effects of medium before and after optimizationon growth of Eurotium cristatum
由图8可以看出,优化培养基培养冠突散囊菌所得的菌丝干质量是空白组的近10倍。此结果表明,通过添加碳氮源、无机盐及调节黑毛茶提取液的浓度,冠突散囊菌液态发酵的效果得到了显著提升。
2.2 发酵条件的优化
首先考察接种量对冠突散囊菌生长的影响,结果见图9。

图9 接种量对冠突散囊菌生长的影响Fig.9 Effect of inoculum size on growth ofEurotium cristatum
由图9可知:接种量为0.48×106~2.4×106个时,菌丝干质量随着接种量的增加而增加;接种量为2.4×106个时,菌丝干质量达到最大值;接种量继续增加时,菌丝干质量开始减少。出现此现象的原因是,过大的接种量导致茶汤内有限的溶氧量、营养物质不能满足冠突散囊菌的需要,从而抑了菌体的生长繁殖。因此,选取的最佳接种量为2.4×106个(V(装液量)∶V(孢子悬液)=20∶ 1)。
黑茶提取液的pH为4.5,上述所有优化均是在自然pH下进行。冠突散囊菌适宜在酸性条件下生长繁殖,产生孢子,如陈桂梅[19]在实验中发现,冠突散囊菌产孢的最适pH为5;邓放明[20]在实验中发现,冠突散囊菌生长的适宜pH为5~7。本实验pH优化后的结果如图10所示。

图10 pH对冠突散囊菌生长的影响Fig.10 Effect of pH on growth of Eurotium cristatum
由图10可知:当初始pH从3上升到4时,菌丝干质量明显增加; pH为4时,冠突散囊菌菌体干质量最大;之后,菌丝干质量随着pH的继续增大而逐渐减小。此结果证明,过酸、过碱的条件均会导致冠突散囊菌产生无性孢子,使得有性孢子的数量减少,进而抑制冠突散囊菌的生长繁殖[19]。因此最佳pH选定4。
在液态发酵中,溶氧量是一个重要的参数。调节溶氧量的方法有:改变装液量、搅拌速度等。本实验中,笔者利用改变装液量的方法来调节溶氧量,结果如图11所示。

图11 摇瓶装液量对冠突散囊菌生长的影响Fig.11 Effect of loaded broth volume on growth of Eurotium cristatum
由图11可知:装液量对菌丝干质量会产生不同程度的影响。装液量为100 mL时,菌丝干质量最大,约为1.172 g/L,约是装液量为25 mL时的1.3倍;装液量超过100 mL时,菌丝干质量随着装液量的增加而减小。装液量的不同,本质上是溶氧量的不同。此结果说明过高和过低的溶氧量都不利于发酵的进行。因此,选择100 mL为最佳装液量。
以24 h为单位,以菌丝干质量为衡量指标,考察最佳培养基中,冠突散囊菌在最优发酵条件下的生长进程曲线,结果如图12所示。

图12 发酵时间对冠突散囊菌生长的影响Fig.12 Effect of fermentation time on growth ofEurotium cristatum
由图12可知:前48 h冠突散囊菌生长快速;48~72 h,菌丝干质量呈指数增长,增加量最明显;72~168 h,菌丝干质量持续增加;168~192 h,菌丝干质量增加趋于平缓;192 h时,菌丝干质量达到最大,之后便逐渐减小,这主要是因为菌体在增长量达到最大值后,开始自溶,从而使菌丝干质量呈缓慢减少的趋势。综上,选择192 h(8 d)为最适发酵时长。
2.3 发酵过程中理化成分的动态变化
发酵过程中理化成分的动态变化如图13所示。

图13 发酵过程中理化成分的动态变化Fig.13 Changes of the physicochemical componentsduring the fermentation
由图13可知:在前48 h内,pH略有下降,因为在这48 h内,冠突散囊菌逐渐繁殖增多,发酵液中碳源不断被菌体吸收利用,产生酸类代谢产物,溶解到茶汤中,使其pH有所降低;48~120 h,pH逐步从4上升到5,产生此现象的原因可能是发酵培养基中的氮源被分解利用,产生了碱性代谢产物;120~192 h,菌体生长量达到极限,菌体开始自溶,导致pH缓慢上升。
茶水浸出物含有多酚化合物、可溶性糖、水溶性果胶、水溶性维生素、游离氨基酸、咖啡碱、水溶性蛋白、无机盐等多种物质。茶水浸出物的成分及其含量反映了茶叶品质的优劣[4]。从图13还可知,在发酵过程中,水浸出物的含量随着发酵进程的推进而逐渐减少,推测可能是茶汤中水浸出物主要由茶多酚和水溶性蛋白组成,这两种物质在发酵过程中不断减少,最终使水浸出物含量缓慢变少。
在发酵过程中,茶多酚的含量逐渐降低,与发酵前相比,减少了36.36%。这说明在发酵期间,冠突散囊菌能够将茶多酚分解成分子量更小的物质或茶多酚能够通过自动氧化、酶促氧化等多种途径转化成其他物质。该结果与徐瑞瑞等[21]和黄群等[22]的结果一致。144 h后,茶多酚含量降低变缓慢,这是由于随着发酵时间延长,底物浓度降低,氧化速度相对变缓;同时茶汤pH增加使多酚氧化酶失去最适pH条件而致其活性下降,也致茶多酚氧化速度降低,因此茶多酚含量下降速度也随之变缓[22]。
在发酵过程中,可溶性蛋白的总含量逐渐减少。在初始24 h内,茶汤中蛋白质含量降低明显;24~120 h,其含量继续下降,但趋势减缓;120~192 h,其下降速度又开始加快。与发酵前相比,发酵结束后水溶性蛋白减少了约53.8%,推测主要原因是茶汤中的大分子蛋白在发酵过程中一部分通过水解反应分解成了氨基酸等小分子物质,另一部分被菌体当作氮源用于自身生长繁殖。
在初始48 h内,游离氨基酸的总量逐渐减少,其原因可能是氨基酸被菌体当做氮源吸收利用,也可能是茶氨酸与茶多酚氧化产物发生结合而生成暗色聚合物或茶氨酸发生了其他氧化、降解和转化反应[22];48 h后,游离氨基酸的含量又逐步增加,这可能是因为在此过程中,蛋白质水解、茶多酚等被氧化分解从而释放出游离氨基酸;对比发酵前后水溶性氨基酸的总量,发现发酵后的氨基酸总量是增加的。对于发酵前后氨基酸种类的比较,如表1所示。发酵后较发酵前增加了3种,分别是丝氨酸、谷氨酸和苯丙氨酸;减少了1种,为缬氨酸。
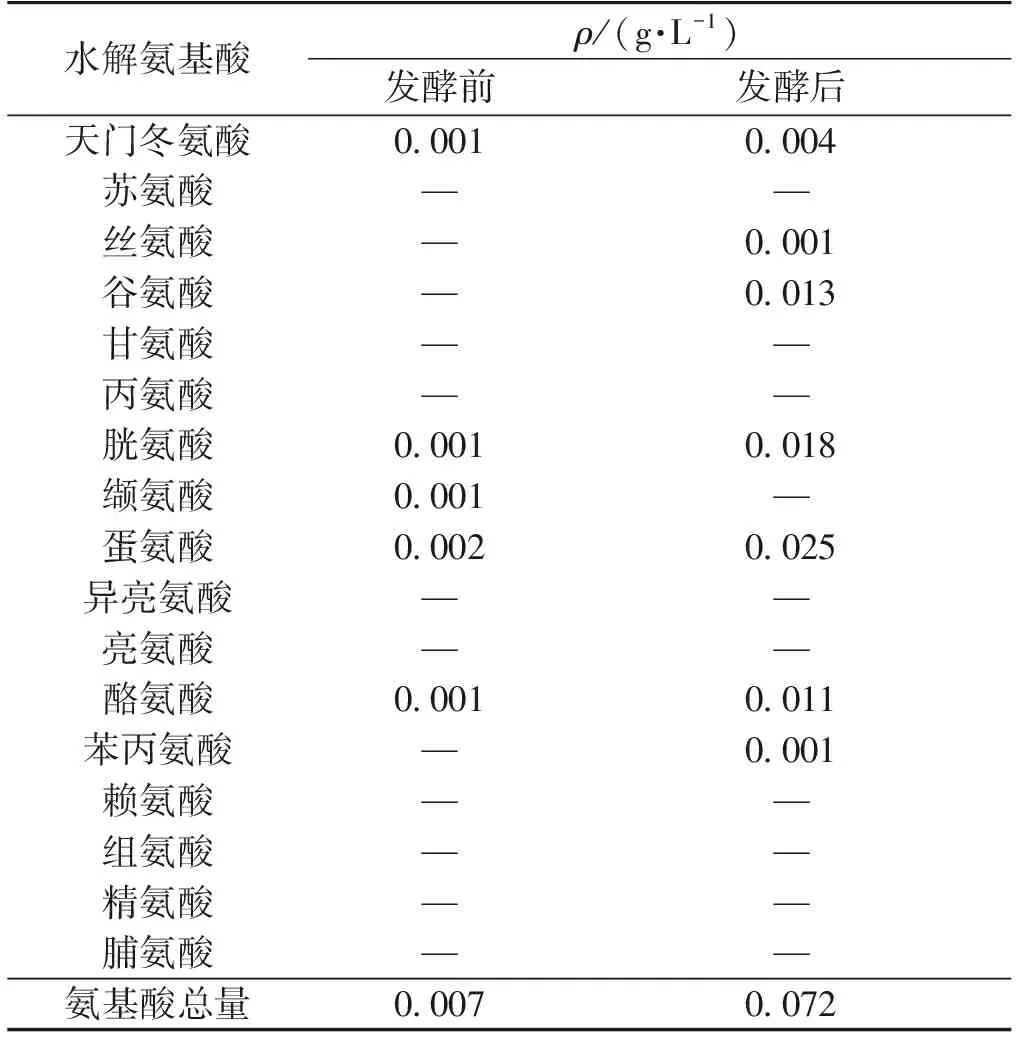
表1 发酵前后游离氨基酸类别变化
2.4 发酵过程中功能成分的动态变化
发酵过程中功能成分的动态变化如图14所示。由图14可知:发酵前72 h,黄酮类含量随着菌体的生长繁殖而逐渐减少;72 h后,其含量又逐渐增多。该结果与傅冬和[23]黄酮类物质的含量持续减少的结果不一致,这可能是两者采用的菌种和发酵条件不同。茯砖茶加工过程中,由于配糖化作用,糖苷一般难以分解,但在高温高湿作用下,黄酮苷易发生水解,释放糖基,从而降低茶汤的苦涩味。同时,黄酮类的氧化产物还能与茶汤中的咖啡碱形成络合物,从而有助于茯砖茶醇和滋味的形成[23]。冠突散囊菌液态发酵过程中,发酵前72 h的黄酮苷也可能基于同样的原因导致含量下降。就整个发酵过程而言,相比发酵之前,发酵后的黄酮类总量比发酵前增加了25%;后期,由于冠突散囊菌菌体数量的增长,黄酮类总量也不断增加,由此推测冠突散囊菌自身代谢也可能产生一定量的黄酮类物质。
高品质的黑茶发酵液应当色泽橙红、明亮。茶汤的色泽变化取决于茶色素的变化。从图14可以看出,3种茶色素在发酵过程中变化的趋势各不相同。在整个发酵进程中,茶褐素含量一直在增加:前72 h,增加趋势较平缓;72 h后,增加速度大幅上升。茶红素含量较低,随着发酵的推进,也呈小幅的上升趋势。茶黄素含量一直较低,48~96 h间只有极微量的变化;96 h后,含量几乎为零。本实验所用的黑毛茶为后发酵茶,在其生产过程中,已将大部分的茶黄素转为茶褐素,所以茶褐素的含量比茶红素和茶黄素要高出许多。单体儿茶素物质的氧化、聚合和茶多酚的氧化也会导致茶褐素含量的增加。

图14 发酵过程中功能成分的动态变化Fig.14 Changes of the functional componentsduring the fermentation
茶叶中芳香物质的组成十分复杂,其中包括碳氢类化合物、醛、醇、酮、酯类和内酯类[15]。经过发酵后的冠突散囊菌黑茶发酵液具有独特的“菌花”香气,与发酵前的菌液香气截然不同。发酵前后香气成分变化如表2所示。

表2 发酵前后香气成分变化
注:离子化方式为EI源;电子能量为70 eV;离子源温度为230 ℃。
由表2可知:发酵前茶汤的香气成分有5种,除4-辛烯酸乙醚外,其余全由酯类物质构成;发酵后,香气成分多达17种,比发酵前增加了12种。此处需要说明的是本研究发酵采用的是通风式液态摇瓶发酵,在长时间的发酵过程中,芳香性成分会挥发,此处分析所得到的芳香性物质的结果只是局部的,并不能代表冠突散囊菌发酵可能产生的所有芳香性物质。即使这样,发酵后茶汤中的挥发性成分大大增加,其中醇类物质占14.29%,醛类物质占7.14%。醇类物质含有温和清雅的花香,且阈值较低,推测是使发酵后茶汤具有独特“菌花香”的原因。本实验中检测出的香气成分与虞飞[15]和王华夫等[24]的结果相差较大,一方面可能因为发酵条件、发酵时间不同,导致发酵结束残留芳香性成分不同;另一方面可能是因为香气成分具有强烈的挥发性,在常温下很不稳定,大部分含量甚微的香气物质在检测前已挥发。
3 结论
本文中,笔者用6 g/L的黑茶提取液作为发酵的初始培养基,研究了冠突散囊菌在黑毛茶提取液中发酵所需的最佳培养基成分和培养条件,并对发酵前后黑毛茶提取液中各成分的变化进行了测定。结果表明,冠突散囊菌液态培养基的最佳组成为90 g/L葡萄糖、7.5 g/L NH4Cl、5 g/L CaCl2和9 g/L黑茶提取液;最优培养条件为250 mL摇瓶装液量100 mL、接种量2.4×106个(V(装液量)∶V(孢子悬液)=20∶ 1)、初始pH 4.0、28 ℃发酵8 d;在最佳培养基和最优培养条件下,其菌丝干质量是初始黑茶提取液、初始培养条件下的近30倍。发酵完成后,通过测定发酵液中的各理化成分发现,茶多酚含量减少了36.36%,总可溶性蛋白含量减少了53.80%,水浸出物含量减少了21.95%,总黄酮苷含量增加了14.40%,游离氨基酸含量增加了76.75%,茶褐素含量增加了5.08%,茶黄素、茶红素发酵前后含量都较低,可溶性糖含量是发酵前的近4倍,芳香性成分增加了12种,多为酯类和醇类。本试验为后续开发冠突散囊菌液态发酵饮品提供了理论依据。
