葱兰夜蛾幼虫肠道细菌群落结构与多样性分析
2019-08-08蔡泱莲黄宽官黄俊浩
蔡泱莲,黄宽官,黄俊浩,吴 鸿
(浙江农林大学 林业与生物技术学院,浙江 杭州 311300)
近年来,随着我国城市规模的发展、绿化面积的扩大,葱莲Zephyranthes candida又名葱兰,在城市绿化中应用越来越广泛,葱兰夜蛾Brithys crini的发生范围和危害程度亦随之增加。葱兰夜蛾又名毛健夜蛾、文殊兰夜蛾,属鳞翅目Lepidoptera夜蛾科Noctuidae健夜蛾属Brithys昆虫,主要为害葱莲,朱顶红Hippeastrum rutilum,石蒜Lycoris radiata,文殊兰Crinum asiaticumvar.sinicum等石蒜科Amaryllidaceae的植物[1-2]。其主要为害方式为幼虫蚕食或钻蛀寄主植物的叶片、花梗、花、茎杆或球根,食量巨大,可将寄主植物地面以上茎叶全部食光。夏季炎热时,幼虫早晚取食,白天隐匿;在比较阴潮的林下,幼虫终日都可以取食为害。该虫在国内主要分布在浙江、江苏、上海、江西等地,而最早见于印度、缅甸、斯里兰卡、新加坡、印度尼西亚和日本等国家[3]。
昆虫肠道微生物的群落结构、代谢活动便会受到宿主昆虫肠道微生物环境的影响,微生物通过一系列策略机制来适应昆虫肠道微环境,与之形成共生关系,相互影响,相互生存[4]。肠道微生物参与昆虫的食物消化、为昆虫提供特殊营养、也可以抵抗外来微生物侵染、降解食物中的有毒物质来使昆虫不受伤害、会合成信息素成分和引起宿主昆虫免疫反应等[5]。
16S rDNA是原核生物染色体上编码核糖体RNA的对应DNA序列,包括保守区和高变区两部分,其中保守区主要可用于确定物种间亲缘关系,服务于系统进化研究;而高变区则更多的反映物种组成和丰度信息,有助于更加全面的对肠道细菌的结构组成、最佳生长条件、肠道细菌多样性分析和不同功能进行研究[6]。高通量测序可提供大量的有效数据,通过对这些数据进行分析即可获得样品中微生物的多样性信息,尤其是用高通量测序依赖的16S rRNA测序分析肠道微生物多样性,包括物种注释与评估、物种组成分析、β多样性分析、物种差异分析、进化关系分析和16S功能预测等[7]。
本研究采集浙江农林大学校园为害葱莲的葱兰夜蛾,采用IonS5TMXL高通量测序技术,数据分析主要采用Cutadap,UCHIME Algorithm,Uparse,Qiime,LEfSe,R等软件对葱兰夜蛾肠道细菌的多样性进行初步分析与比较,为进一步研究葱兰夜蛾肠道微生物的功能及其在防治中的应用提供理论。
1 材料与方法
1.1 供试虫源
2017年11月21日在浙江省杭州市浙江农林大学东湖校区采集葱兰夜蛾4龄幼虫。单头幼虫为1个样本,共4个重复,分别标记为YE1,YE2,YE3和YE4。
1.2 葱兰夜蛾肠道细菌总DNA抽提
采集新鲜虫体24 h内解剖肠道。在超净工作台内,将虫体放入无菌水中,清洗表面异物,放入75%酒精浸泡1 min,取出后再放入100%酒精麻醉,沥干,用镊子取其肠道。虫体除肠道外的躯干用于昆虫物种分子鉴定,肠道则用于后续细菌多样性测定。
肠道细菌总DNA采用试剂盒(QIAamp Fast DNA Stool Mini Kit)提取,提取完的总DNA分装4份,1份保存于4℃冰箱用于测定DNA质量,其余3份保存于-20℃冰箱备用。高通量测序的DNA样本浓度和质量使用Nanodrop分光光度计检测。
1.3 葱兰夜蛾肠道细菌16S rDNA扩增及测序
以1.2节提取的肠道细菌总DNA送至北京诺禾致源科技股份有限公司进行高通量测序。采用细菌V3-V4区通用引物对16S rDNA进行 PCR扩增。所用引物为341F(5’-CCTAYGGGRBGCASCAG-3’)和806R(5’-GGACTACNNGGGTATCTAAT-3’)。使用 Thermofisher公司的 Ion Plus Fragment Library Kit 48 rxns建库试剂盒进行文库的构建,构建好的文库经过Qubit定量和文库检测合格后,使用Thermofisher的IonS5TMXL进行上机测序。
1.4 数据处理分析
使用Cutadapt进行剪切、拆分和处理得到原始序列(Raw reads),并利用UCHIME Algorithm与物种注释数据库进行比对检测,得到最终的有效数据(Clean Reads)。利用Uparse软件对所有样品的全部Clean Reads进行聚类,默认以97%的一致性(Identity)将序列聚类成为操作分类单元(Operational Taxonomic Units,OTU),同时会选取OTU数目的代表性序列进行物种注释。使用Qiime软件计算Chao1,Shannon和Simpson指数,使用R软件绘制稀释曲线,Rank abundance曲线,物种累积曲线并使用R软件进行Alpha多样性指数组间差异分析等。
2 结果与分析
2.1 葱兰夜蛾4个肠道样品测序结果及取样深度验证
测序后,共获得葱兰夜蛾肠道细菌序列273 453条。为了研究样品的物种组成多样性,对所有样品的Clean reads进行聚类,在97%相似度下平均每个样本可聚类为512个OTU数目,然后对OTU数目的代表序列进行物种注释。
2.2 稀释曲线(Rarefaction Curve)
稀释曲线是指从样品中随机抽取一定测序量的数据,统计所代表的物种数目,即OTU数目,通过抽取的测序数据量和对应物种数来构建曲线。利用稀释曲线评价葱兰夜蛾肠道细菌的测序深度和物种丰富度,虽然随着测序深度增加,但是稀释曲线并未达到饱和,这一方面主要由于二代测序能够检测到很多低丰度物种,另一方面由于食物带入肠道的过路细菌以及一些死的细菌均可能引起稀释曲线很难达到饱和(图1)。
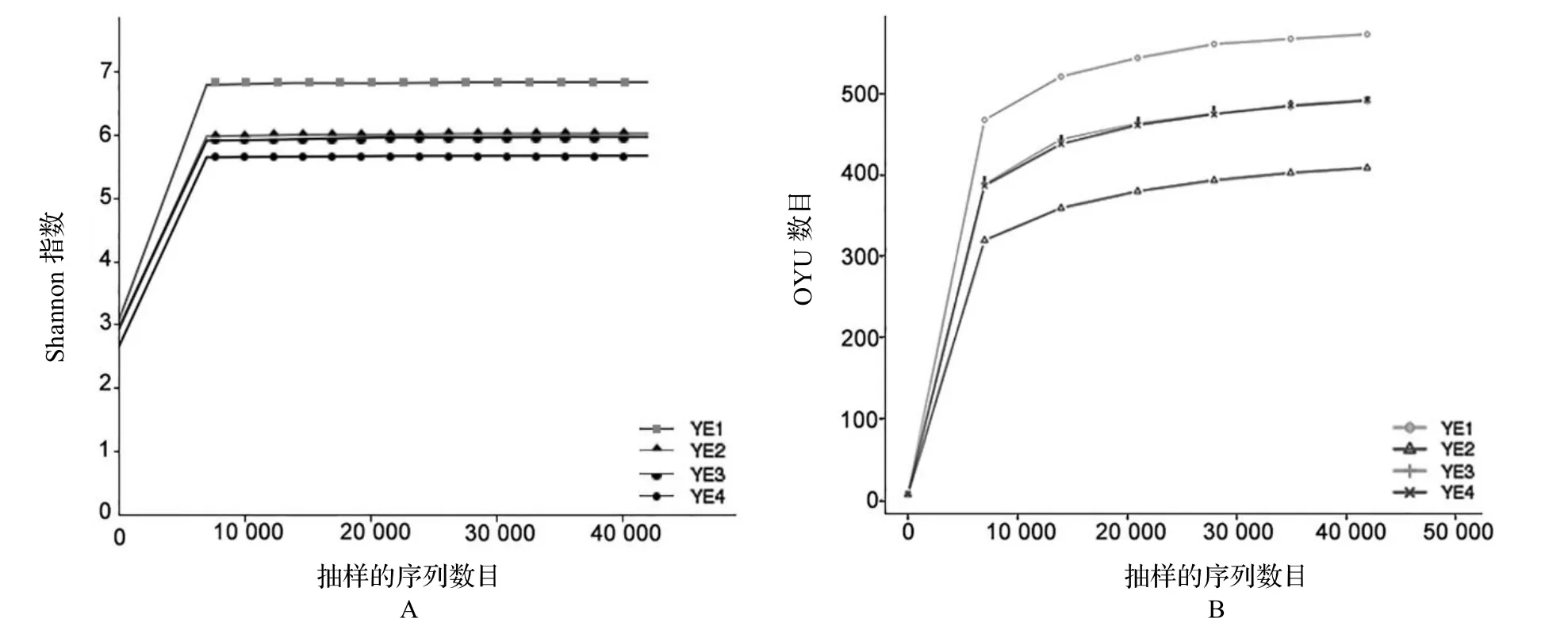
图1 葱兰夜蛾幼虫肠道细菌类群的多样性分析Figure1 Diversity(A)and abundance(B)of intestional bacterial colonies of Brithys crini
2.3 Alpha多样性分析
对OTU数目进行Alpha多样性指数分析,并对其进行群落结构的统计分析(表1)。Alpha多样性指对单个样品中物种多样性的分析,本研究分析了Simpson指数、Shannon指数和Chao1指数等。Chao1指数反映的事样品中群落丰富度,而Shannon指数反映样品群落的多样性,Simpson指数反映样品群落中优势种的集中程度。Shannon指数和Chao1指数越大,Simpson指数越小,说明样品中物种越丰富多样。
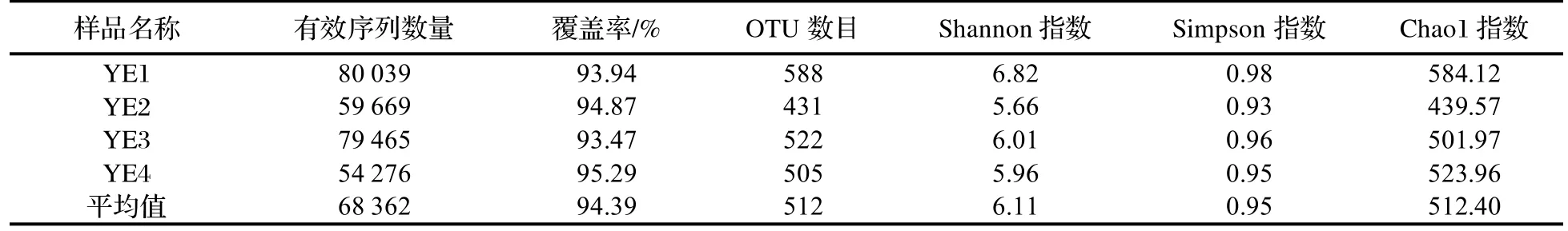
表1 葱兰夜蛾中肠道细菌Alpha多样性分析Table1 Alpha diversity of intestinal bacteria in Brithys crini
葱兰夜蛾肠道细菌种类有较高的丰富度和多样性,其肠道微生物Simpson指数、Shannon指数和Chao1指数分别为0.93~0.98,5.66~6.82和439.57~584.12。其中样品YE1的群落丰富度和多样性最高,群落优势种的集中程度也最大。
根据Alpha指数进行作图分析(以Shannon指数为例)。Shannon指数是反映样品中微生物多样性的指数,利用各样品的测序量在不同测序深度时的微生物多样性指数构建曲线,以此反映各样本在不同测序数量时的微生物多样性。当曲线趋于平坦时,说明测序数量足够大,可以反映样品中绝大多数的微生物物种信息。Shannon曲线中葱兰夜蛾4个肠道样品细菌稀释曲线均趋于平缓(图1B),说明测序数据量足够大。起初曲线直线上升,是由于测序条数远不足覆盖样品导致,数值升高直至平滑说明测序条数足以覆盖样品中的大部分微生物。YE1的指数明显高于其他3个样本(图1A),其数据可信度有待检验。
2.4 葱兰夜蛾4个肠道样品细菌物种相对丰度分析
4个样本聚类注释后,平均99.98%的序列被注释为细菌(表2)。注释鉴定共获得23门57纲86目168科347属。

表2 葱兰夜蛾幼虫肠道4个样本聚类注释后细菌与古细菌所占比例Table2 Proportion of bacteria and archaea after cluster annotation of Brithys crini intestinal canal
在门水平上,葱兰夜蛾肠道微生物的16S rDNA基因序列共注释到了变形菌门Proteobacteria,厚壁菌门Firmicutes,拟杆菌门Bacteroidetes,放线菌门Actinobacteria,蓝藻门Cyanobacteria,梭杆菌门Fusobacteria,酸杆菌门Acidobacteria,绿弯菌门Chloroflexi,异常球菌-栖热菌门Deinococcus-Thermus,糖菌门Saccharibacteria等23个门(图2)。4个样本的肠道细菌优势菌门均为变形菌门(26.15%~51.97%)和厚壁菌门(15.70%~37.70%),肠道细菌优势门相似,但不同个体样本的相对丰度有所差异,其中YE2,YE3和YE4的变形菌门含量最丰富,占48.22%~50.55%,其次是厚壁菌门含量较丰富,占15.70%~22.94%;而YE1的厚壁菌门含量(37.70%)比变形菌门(26.15%)高。
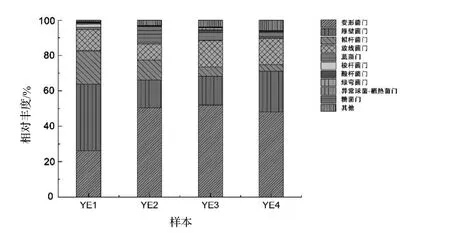
图2 葱兰夜蛾幼虫肠道细菌门的组成和结构Figure2 The proportion of phylum of the intestine intestinal bacteria in of Brithys crini in phylum level
在纲水平上,主要有γ-变形菌纲Gammaproteobacteria,梭菌纲Clostridia,未分类的放线菌纲unidentified Actinobacteria,拟杆菌纲Bacteroidia,α-变形菌纲Alphaproteobacteria,芽孢杆菌纲Bacilli,叶绿体Chloroplast,β-变形杆菌纲Betaproteobacteria等。占比最高的优势纲为γ-变形菌纲,平均相对丰度为33.85%,其中有梭菌纲(14.84%)、未分类的放线菌纲(11.54%)、拟杆菌纲(8.61%)、α-变形菌纲(8.21%)、芽孢杆菌纲(7.17%)、叶绿体(4.41%)、β-变形杆菌纲(1.51%)等(图3A)。
在目水平,主要有肠杆菌目Enterobacteriales,梭菌目Clostridiales,拟杆菌目Bacteroidales,芽孢杆菌目Bacillales,根瘤菌目Rhizobiales,微球菌Micrococcales,未识别的叶绿体unidentified_Chloroplast等。平均相对丰度占比前10的是肠杆菌目(30.63%)、梭菌目(14.78%)、拟杆菌目(8.61%)、芽孢杆菌目(4.82%)、根瘤菌目(4.65%)、微球菌(4.28%)、未识别的叶绿体(4.02%)、丙酸杆菌目(3.14%)、乳杆菌目(2.34%)、棒状杆菌目(1.48%),其中优势目为肠杆菌目,占比达到30.63%(图3B)。
在科水平,主要有肠杆菌科Enterobacteriaceae,毛螺菌科Lachnospiraceae,杆菌科Bacillaceae,未识别的叶绿体unidentified_Chloroplast,反刍球菌科Ruminococcaceae,柏科Prevotellaceae,拟杆菌科Bacteroidaceae等,以及许多未鉴定科。平均相对丰度占比前10的科分别是肠杆菌科(30.63%)、毛螺菌科(9.34%)、杆菌科(4.02%)、未分类的叶绿体(4.02%)、反刍球菌科(3.42%)、柏科(3.39%)、拟杆菌科(3.03%)、微丝菌科(2.73%)、丙酸杆菌科(2.50%)、甲杆菌科(2.36%),其中肠杆菌科所占比例最高达到30.63%(图3C)。

图3 葱兰夜蛾幼虫肠道细菌在不同分类等级上的物种比例Figure3 The proportions of class,order,family and genus the of intestinal bacteria species in the intestine of larval Brithys crini at different classification level
在属水平,主要有克雷伯氏菌属Klebsiella,泛菌属Pantoea,Tyzzerella_3,未识别的叶绿体unidentified Chloroplast,拟杆菌属Bacteroides,普雷沃菌属Prevotella,丙酸杆菌属Propionibacterium,甲醇杆菌属Methylobacterium,肠杆菌属Enterobacter,根瘤菌Rhizobium等,以及许多未鉴定属。平均相对丰度占比前10的为克雷伯氏菌属(13.61%)、泛菌属(6.99%)、未命名的属Tyzzerella_3(6.10%)、未分类的叶绿体(4.02%)、拟杆菌属(3.03%)、普雷沃菌属(2.64%)、丙酸杆菌属(2.38%)、甲醇杆菌属(2.30%)、肠杆菌属(1.91%)、根瘤菌属(1.19%),其中克雷伯氏菌属所占比例最高达到13.61%,(图3D)。
本研究共注释获得347个属,相对于传统的分离培养技术,IonS5TMXL技术可以全面地检测到样本中的细菌,然而其中大多数是未鉴定菌和未命名菌。前20个明确鉴定到属的类群,相对丰度都较低(表3),但是在肠道中的作用却不可轻视。其中,克雷伯氏菌属含量最丰富,鞘脂单胞菌属和叶杆菌属的含量在4个个体间表现出较大差异但是每个样本中都占有一定的比例。
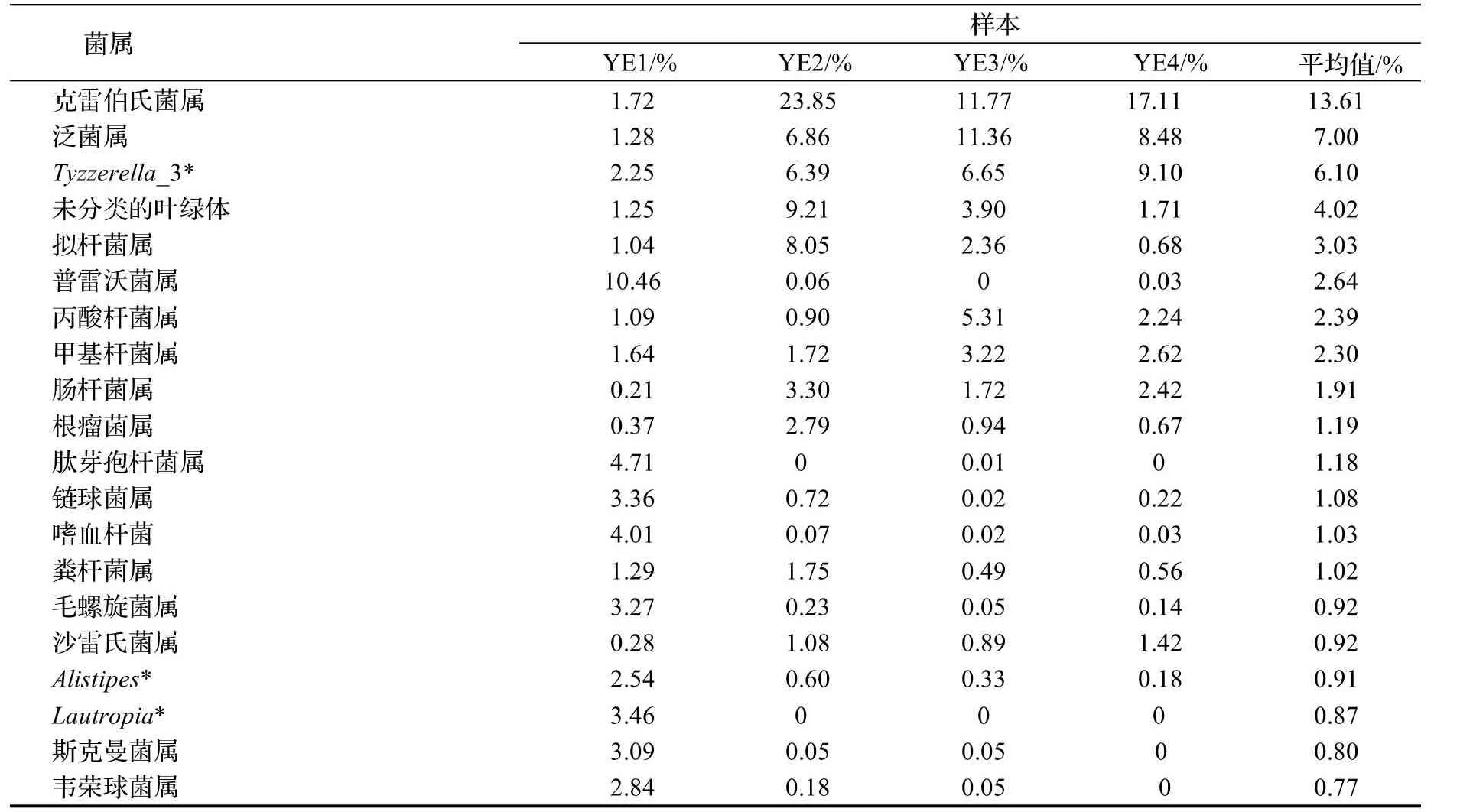
表3 属水平上丰度排名前20的葱兰夜蛾幼虫肠道菌群Table3 The top 20 abundant genera of intestinal bacteria in Brithys crini
3 结论与讨论
近年来,随着基于16S rDNA的高通量测序技术的发展和应用,昆虫肠道微生物群落结构的研究迎来了一个崭新的黄金时期。16S rRNA测序技术可以避开微生物分离培养的过程,能够准确、快速、高通量地解读微生物群体的多样性与丰度[8]。本研究采用16S rDNA和IonS5TMXL技术首次开展葱兰夜蛾幼虫肠道细菌菌落组成分析,共注释鉴定23门57纲86目168科347属。
在23门中,含量最高的为变形菌门,该结果与有些昆虫肠道中的优势菌相同。如豌豆蚜Acyrthosiphon pisum[9],点蜂缘蝽象Riptortus clavatus[10],泽兰实蝇Procecidochares utilis[11],地中海实蝇Ceratitis capitate,柑橘大实蝇Bactrocera minax[12],沙蝇Lutzomyia longipalpis[13],沙漠蝗Schistocerca gregaria[14],天牛Saperdave stita[15]以及茶尺蠖Ectropis obliqua[16]等昆虫肠道中鉴定获得的优势菌均为变形菌门。
Yun等[17]对大量不同种昆虫的肠道菌群多样性的研究表明,昆虫肠道中的优势菌群主要隶属于变形菌门和厚壁菌门,这与本研究结果大体一致。然而葱兰夜蛾肠道的优势菌群与有些昆虫肠道中不同,家蝇Musca domestica肠道的优势菌还有拟杆菌门[18],而白蚁Reticulitermes speratus肠道优势菌依次为拟杆菌门、厚壁菌门、螺旋体门、变形菌门[19]。鞘翅目昆虫五月鳃金龟Melolontha melolonth的肠道优势菌为厚壁菌门[20]。昆虫肠道微生物的多样性除了与昆虫种类有关外,还与食物及环境因素相关[17]。因此,尚需进一步研究来自不同生育期和不同地理种群的葱兰夜蛾幼虫的肠道微生物多样性,更全面地明确葱兰夜蛾幼虫肠道细菌的多样性。
在葱兰夜蛾幼虫肠道347属细菌中,克雷伯氏菌属为优势属,占13.6%,这与已报道的柑橘大实蝇结果一致[13]。葱兰夜蛾与地中海实蝇肠道细菌优势属的结果不太相同,其主要有克雷伯氏菌属、泛菌属、肠杆菌属、果胶杆菌属Pectobacterium和柠檬酸杆菌属Citrobacter[21]。这些不同丰度的属是否具有不同功能值得继续关注和研究,且为进一步探索利用葱兰夜蛾共生微生物资源进行害虫防治奠定了基础。
葱兰夜蛾幼虫肠道中还发现了一部分人类肠道常见菌群,包括拟杆菌属、肠杆菌属和泛菌属。其中,拟杆菌属在葱兰夜蛾幼虫肠道中的平均相对丰度达到3.03%,它一般寄居于人和动物的肠道、口腔、上呼吸道和生殖道[22]。肠杆菌属可能参与编码一系列纤维素和木质素降解酶[23],在河曲丝叶蜂Nematus hequensi中发现可能有助于宿主昆虫的生殖发育和碳氮代谢[24],在乳黄家白蚁Coptoermes lacteus中发现了与昆虫营养消化有关的具固氮活性的成团肠杆菌Enterbacter agglomerans[25];泛菌属也可从动物和人的伤口、血和尿中分离到,是人类条件致病菌[26]。另外还发现在其他昆虫中具有纤维素水解和果胶水解活性的根瘤菌属和沙雷氏菌属,这两类菌都是河曲丝叶蜂幼虫肠道的优势菌群,有助于合成食物所缺乏的含氮化合物,并对萜烯化合物具解毒功能[27-28]。进一步研究和验证上述功能菌是否在葱兰夜蛾肠道具有类似功能,能为葱兰夜蛾的防治带来新途径。
研究昆虫肠道微生物有利于深入了解其系统发育及与宿主协同进化关系,为阐述昆虫的适应性、多样性以及与共生微生物协同进化机制奠定理论基础[29]。本研究全面分析了葱兰夜蛾体内微生物群落结构及多样性,极大丰富了葱兰夜蛾体内微生物相关信息,有助于葱兰夜蛾体内关键微生物种类的挖掘及其生物学功能的解析,为基于肠道微生物开发新的绿色防治技术奠定基础。
