间充质干细胞来源外泌体在缺血性脑卒中的研究进展
2019-08-08
(1.南华大学附属第二医院神经内科,湖南 衡阳 421000;2.益阳市中心医院神经内科,湖南 益阳 413000)
目前,脑卒中已成为全世界第二位死亡原因及主要致残疾原因,缺血性脑卒中是最主要的类型[1]。目前有效治疗方法有静脉溶栓、血管内治疗及卒中单元中的常规管理方法,但受时间窗限制,只有少部分病人能得到有效救治。因此,探寻安全、高效新疗法成为目前脑卒中治疗研究热点。多项证据表明,干细胞移植可以作为一种替代传统药物的脑卒中治疗方法,而间充质干细胞(mesenchymal stem cells,MSCs)因其独特分化及衍生能力,成为干细胞移植治疗的首选细胞。最新研究发现,旁分泌机制可能是MSCs细胞移植治疗脑卒中最重要的作用机制。在MSCs的众多衍生分泌物中,外泌体(exosomes)已经引起了人们广泛的研究兴趣。研究发现MSCs分泌的外泌体可以穿透血脑屏障到达大脑受损部位,且内含的多种生物因子可以促进神经功能恢复及血管重塑[2]。基于再生医学的不断发展,精准医学概念的提出,外泌体因其在体内存在的广泛性及获取的便捷性等特性,已成为许多疾病诊断治疗的可能方式,在精准医学及再生医学均具有广大前景。
1 间充质干细胞源性外泌体概述
MSCs能够分泌多种均匀大小的胞外囊泡(extracellular vesicles,EVs),包括外泌体和微泡(microvesicles,MV),这些EVs均携带有独特的膜脂质结合配体、蛋白质及RNAs。并且参与细胞之间传递、细胞信号传导以及在体内通过短距离或长距离迁移来改变细胞或组织代谢,影响细胞或组织对损伤、感染和疾病的应激反应[3]。在过去10年中,外泌体已成为细胞间信息传导的重要媒介,其在肿瘤、感染性疾病及神经变性疾病等多种疾病中的生理病理作用被广泛研究。通过基因修饰工程修饰外泌体的内含生物信息,挖掘治疗干预疾病的潜在新靶点以及大分子药物新型定向传递方式已成为如今外泌体领域研究热点。
MSCs衍生的外泌体是一种大小约为30~100 nm脂质双层膜结构,具备类似于MSCs的许多特性,携带有多种细胞因子、生长因子、脂质信号、mRNA和调节miRNA,在组织愈合、炎症、免疫调节及抑制纤维化等过程中发挥效应[4]。目前,与已知产生外泌体的其他细胞相比,MSCs是外泌体相对衍生量最多的一类细胞。且永生化MSCs不影响所分泌外泌体的质量与数量[5]。MSCs源性外泌体因其与来源细胞的相似生物功能特性及良好的生物相容性,在无细胞治疗再生医学方面及药物治疗载体方面有着巨大优势。
2 间充质干细胞源性外泌体的分离与提取
MSCs源性外泌体的分离与提取通常在实验室条件下完成,对于目前外泌体提取的方法学研究也一直是外泌体领域的重点。MSCs源性外泌体的提取方式与其他细胞来源外泌体提取方式类似,分为传统的高通量方法,如超速离心法、梯度离心法、共沉淀法、尺寸排阻色谱、场流分级法;较为新颖方法有微流控法、非接触法、免疫吸附法[6]。由于外泌体与其他MV有着类似结构、密度及其他生物物理学特性,为获得纯度更高的外泌体,目前大部分较为权威外泌体实验研究均采用超速离心法或蔗糖密度梯度超速离心法提取外泌体。外泌体的提取与分离成本高,且产量较低,难以满足一次动物实验用量要求。因此如何简化提取分离高纯度外泌体过程,是外泌体提取方法改进的难点。
与永生化肿瘤细胞系不同,MSCs的扩增能力有限,其一次外泌体产量难以满足动物实验需求,而MSCs源性外泌体大规模获取仍有一定难度。有研究者用mys转染MSCs使其永生化,而未改变MSCs外泌体产的数量与性质[5]。此外,通过改变来源细胞的培养微环境,也能一定程度上影响外泌体的量与活性。Haraszti RA等[7]通过结合MSCs微载体的三维(3D)细胞培养及MSCs外泌体正切流动过滤(tangential flow filtration,TFF)提取优势,并比较了来自2D与3D培养物的外泌体物理化学特性,以及由差异超速离心与TFF产生的外泌体的物理化学特征,结果表明,3D培养结合TFF可将MSCs源性外泌体的产量提高140倍,且这些外泌体在治疗性小干扰RNA(siRNA)转移至原代神经元的活性提高了7倍。这些高效、大量的MSCs外泌体分离提取方法将极大地促进外泌体无细胞疗法向临床应用转化的可能性。
3 间充质干细胞源性外泌体在缺血性脑卒中的应用与机制
缺血性脑卒中后的恢复基于受损部位的神经突触可塑性及新血管生成,神经突触的可塑性是神经网络建立和维持正常信息传导的核心。当缺血性脑卒中发生时,大脑皮质会发生一系列神经突触重塑,血管内皮祖细胞被激活,分泌血管内皮生长因子(vascular endothelial growth factor,VEGF),参与新生血管的形成[8],然而,大脑自我修复程度有限,不能达到临床满意效果。但大脑的这种自我重塑能力为使用外源性干预治疗措施提供了可能性。
基于MSCs的细胞疗法已经得到广泛研究者的证实,甚至得到了许多临床数据的支持。尽管MSCs介导的修复效应机制不完全明了,既往证据表明,MSCs可能通过线粒体转移、旁分泌和直接分化为神经细胞发挥损伤修复作用[9]。最新研究认为,MSCs移植治疗缺血性脑卒中并不需要细胞迁移至脑损区域,MSCs可能主要通过分泌携带有一定生物信息的外泌体来发挥内源性修复作用。此外,在缺血性脑卒中发生后,外泌体也可在脑细胞中合成与释放,通过血脑屏障,并且可在外周血或脑脊液中被检测到[10]。外泌体本身不具备分化能力,且具备良好的生物相容性,几乎不会被机体免疫机制清除。因此,基于MSCs源性外泌体移植的无细胞治疗摆脱了细胞移植疗法的排异性及致瘤性短板,为无细胞移植治疗缺血性脑卒中的再生医学带来了一道新的曙光。见图1。
3.1 间充质干细胞源性外泌体促进神经修护
越来越多的研究表明,microRNAs是新血管生成调节的重要决定因素,也是中风发病机制的重要因素。下调局灶性脑缺血小鼠模型中miRNA-15a(miR-15a-)能增加内皮生长因子水平,VEGF在血管内皮细胞表面与其受体(VEGFR-1或-2)结合可激活细胞内酪氨酸激酶,并触发促进血管生成的多种下游信号(PI3K/Akt及MEK/ERK信号通路)[11]。Shabbir A等[12]将被PKH26标记的三组不同剂量MSCs源性外泌体与定量人脐静脉血内皮细胞共孵育6 h,结果显示MSCs源性外泌体可在体外诱导人脐静脉血内皮细胞的管状分化,形成新生血管雏形,且新生血管形成数量及长度与MSCs源性外泌体剂量相关。Chen KH等[13]的研究还表明静脉移植脂肪源性间充质干细胞衍生的外泌体能明显缩小急性缺血性卒中后梗死体积以及对梗死部位具有神经保护作用,而Doeppner T等[14]通过直接对比MSCs细胞、MSCs源性外泌体与生理盐水移植治疗缺血性脑卒中大鼠有效,结果发现,MSCs外泌体能增加缺血纹状体部位神经元密度及促进缺血后血管生成,其疗效持续时间与MSCs细胞移植组无统计学差异,提示MSCs源性外泌体可诱导缺血后的长期神经保护作用。
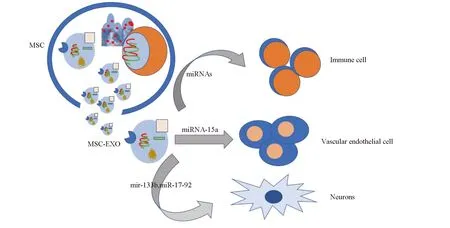
图1 间充质干细胞源性外泌体改善脑卒中可能机制简图注:MSC-EXO:间充质干细胞源性外泌体;Immune cell:免疫细胞;Vascular endothelial cell:血管内皮细胞;Neurons:神经元细胞
MSCs能分泌多种神经因子来刺激内源性脑修复过程,主要分泌的神经因子包括:肝细胞生长因子(hepatocyte growth factor,HGF)、VEGF、神经生长因子(nerve growth factor,NGF)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF,FGF-2)、胰岛素生长因子1(insulin growth factor-1,IGF-1)等[15-16]。由于MSCs外泌体结构的特殊性,可以将MSCs源性外泌体进行基因工程修饰,使MSCs源性外泌体中包含特定种类及特定量的细胞因子或含有特殊小分子或大分子药物,通过静脉移植或定向移植入脑受损部位,大大增加其神经修护效果。Xin H等[3,17-18]发现,通过将MSCs源性外泌体经静脉移植给药至大脑中动脉闭塞大鼠模型后,实验组缺血部位神经恢复加速,并刺激正常组织和缺血组织之间边界区的轴突密度增加及血管生成。同组实验结果还发现,经基因工程诱导后过表达miR-133b的MSCs源性外泌体(MSCs_miR-133b+)移植组增强了卒中大鼠中神经功能的恢复,而基因敲除miR-133b的MSCs源性外泌体(MSCs_miR-133b-)移植组无明显神经发生现象。同时,他们在反向验证过程中发现,MSCs_miR-133b+移植组缺血边界区内结缔组织生长因子(connective tissue growth factor,CTGF)(miR_133b的靶标)的表达显着降低,而MSCs_miR-133b-移植组CTGF表达保持不变。最终得出结论,MSCs外泌体的miR-133b参与介导缺血性卒中的神经功能恢复。在同研究组的另一项研究中,他们还证明了MSCs衍生的外泌体可以自主迁移至邻近细胞。MSCs外泌体包含的miRNA远不止一种。随着研究的深入,越来越多mRNA被发现与脑卒中神经功能恢复相关,Xin H等[19]最新研究表明,用高表达miR-17-92 MSCs源性外泌体治疗缺血性脑卒中可增加卒中后的神经可塑性和功能恢复,其可能机制是通过靶向抑制PTEN(经验证的miR-17-92簇靶基因)激活PI3K/Akt/mTOR/GSK-3β信号传导途径发挥作用。
3.2 MSCs外泌体调节免疫炎性反应
当血管壁内或周围发生的异常免疫炎性反应可促进血栓的形成,最终导致脑卒中的发生。且免疫炎性反应可以促进脑卒中的进展,其中多种淋巴细胞及其衍生的蛋白质分子是导致梗死范围扩大的重要原因。因此,探索免疫干预也为治疗急性缺血性脑卒中提供可能性。
相对于MSCs而言,其来源的外泌体分子量小,且其囊泡性质使得其移植免疫排斥及其微小。Doeppner TR等[14]实验发现,通过对比假手术组与MSCs外泌体移植治疗MACO大鼠组外周白细胞亚群及淋巴细胞亚群总数,后者外周血中B细胞,NK细胞、T细胞减少及树突状细胞的活化增加,提示MSCs源性外泌体能够调节局灶性缺血对外周血系统的细胞组成及其细胞活化状态,并能一定程度逆转脑卒中后诱导的外周免疫抑制。在Chen等[13]的研究中表明,MSCs外泌体能显著降低梗死部位基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、IL-1β、TNFα、纤溶酶原激活物抑制剂-1(plasminogen activator inhibitor-1,RANTES)、NF-κB、CD11和CD68等炎性反应因子,提示MSCs源性外泌体抑制了缺血部位的免疫炎性反应。
4 小结与展望
MSCs移植治疗脑卒中的有效性得到许多动物研究甚至临床研究的验证,但MSCs的致瘤性及低存活率在一定程度上限制了MSCs的治疗空间。而MSCs分泌的外泌体因其微小的纳米尺寸及脂质外层结构,可作为天然的生物信息及药物载体,其独特的双层脂质结构能有效保护其内在生物信息的稳定,避免在迁移的过程中被分解,其微小纳米尺寸可允许外泌体直接穿过血脑屏障,诱导其在梗死区发挥作用,且避免免疫排斥反应和微小毛细血管的阻塞。
现已证明MSCs外泌体所含的多种miRNA参与多种疾病的生理调节及损伤组织修复,其中不仅仅包括缺血性脑卒中,还包括缺血性心肌梗死、肝纤维化、肿瘤等疾病,然而其基本的分子机制与具体miRNA靶点信息特征并不完全清楚[20]。基于MSCs源性外泌体所含miRNA多样性,在探索验证与缺血性脑卒中修复信息相关miRNA后,可以直接基因诱导编辑MSCs源性外泌体所含生物信息,高表达某种生物修复因子或敲除某一基因,静脉输注移植或定点移植入梗死区域,改善缺血性脑卒中症状或将其作为溶栓后辅助治疗的一种可能方式。目前对于MSCs外泌体移植治疗缺血性脑卒中仍处于起步阶段,其临床应用也许还需很长时间的研究,但MSCs源性外泌体在其他学科基础研究及临床应用研究中的不断突破给脑血管病新治疗疗法奠定了基础。
