窄带成像放大内镜和超声内镜判断早期食管癌浸润深度准确度比较
2019-08-08徐正元王加斌
徐正元 王加斌
徐州医科大学附属沭阳医院 消化科,江苏沭阳 223600
我国是食管癌高发地区,据报道,因食管癌死亡患者在恶性肿瘤中占16.05%,居恶性肿瘤死亡率次席[1]。食管癌患者平均5年生存率仅为20.9%,而早期食管癌患者5年生存率可达90%,因此,食管癌的早期诊断及干预对于改善患者生存质量有着重要意义[2]。然而,对于早期食管癌而言,定性诊断只是第一步,准确判断及浸润深度及淋巴结转移方为指导临床治疗方案选择的关键环节[3]。
目前,应用于临床的内镜诊断技术包括白光内镜、碘染色等多种方法,随着内镜技术的不断发展,放大内镜结合窄带成像已应用于早期食管癌进行诊断[4],超声内镜(endoscopic ultrasound,EUS)应用于食管癌分期的报道也不断增多[5]。此次研究就窄带成像放大内镜(Narrow Band Imaging magnifying endoscopy,NBI-ME)和超声内镜判断早期食管癌浸润深度的准确度进行了对比,望为早期食管癌浸润深度判断方法的选择提供参考依据。
1 对象与方法
1.1 研究对象
观察对象为我院2014年1月至2018年1月收治的109例早期食管癌患者,患者均经活检病理证实为早期食管癌,拟于我院接受内镜下黏膜剥离术或外科手术切除,对此次研究知情同意且自愿参与;排除合并心、肝、肺、肾等脏器严重病变者,以及入组前已接受食管癌相关放疗、化疗治疗者。109例患者中,男58例,女51例,年龄43~81岁,平均(61.39±11.07)岁。此次研究已获得我院医学伦理委员会批准,批件号LC-20131205C。
1.2 检查方法
1.2.1 NBI-ME检查 使用CV-260SL型主机和GIF-Q240Z型放大内镜(日本Olympus公司)行窄带成像放大内镜检查,仔细观察病变上皮乳头内毛细血管袢(intrapillary capillary loop,IPCL),并参照Inoue IPCL分型判断食管癌浸润深度[6]。
Ⅰ型:IPCL呈细圆形卷曲状,形态规则,分布均匀,为正常黏膜形态;
Ⅱ型:IPCL轻度扩张延长,排列尚规整,见于食管炎;
Ⅲ型:IPCL轻微变化,个别IPCL管径粗细不均,排列不规则,见于低级别上皮内瘤变;
Ⅳ型:IPCL出现轻度扩张、扭曲、管径粗细不均、形态不规则中的2~3种变化,见于高级别上皮内瘤变或原位癌;
Ⅴ1型:IPCL同时出现扩张、扭曲、管径粗细不均和形态不规则,见于食管鳞癌;
Ⅴ2型:在Ⅴ1型的基础上出现IPCL延长;
Ⅴ3型:IPCL高度破坏;
ⅤN型:可见新生肿瘤血管。各型对应的浸润深度为:
Ⅴ1型:局限于上皮层(M1);
Ⅴ2型:浸润至固有层(M2);
Ⅴ3型:浸润至黏膜肌层和黏膜下层上1/3,距黏膜肌层下缘<200 μm(M3、SM1);
ⅤN型:浸润至黏膜下层1/3以下(SM2、SM3及进展期浸润癌)。
1.2.2 EUS检查 使用GF-UCT240型线阵超声内镜,超声探头频率5~12 MHz,配合ProSound SSD-α5超声诊断仪(日本Aolka公司),行EUS检查,参照文献标准判断食管癌浸润深度[7]。
M1:回声仅在上皮内,黏膜下层清晰、连续、完整且形态规整;
M2:回声在固有层;
M3:回声在黏膜肌层;
SM:黏膜下层受累,黏膜肌层和黏膜下层层次紊乱、分界消失,黏膜下层增厚、中断,可见较小的低回声影。
1.3 分析方法
以内镜下黏膜剥离术或外科手术后病理检查结果为金标准,计算NBI-ME和EUS判断早期食管癌浸润深度的准确率,并运用Kappa检验,分析NBI-ME和EUS判断结果与病理检查结果的一致性,总结两种技术判断早期食管癌浸润深度的临床应用价值。
1.4 统计学分析
对本临床研究的所有数据采用SPSS 22.0进行分析,判断准确率以(n/%)表示,并采用配对χ2检验,以P<0.05为差异有统计学意义;一致性检验采用Kappa检验,Kappa值0~0.20为一致性极低,0.21~0.40为一致性一般,0.41~0.60为一致性中等,0.61~0.80为一致性高,0.81~1为接近一致。
2 结果
2.1 病理检查结果
病理检查结果示,109例早期食管癌患者中,M1~M2 58例,M3~SM1 33例,SM2及其以上18例,分别占53.21%、30.28%、16.51%。
2.2 NBI-ME和EUS判断早期食管癌浸润深度的一致性
Kappa检验结果得出,NBI-ME判断早期食管癌浸润深度与病理检查结果的一致性高,Kappa值为0.762;EUS判断早期食管癌浸润深度与病理检查结果的一致性一般,Kappa值为0.292。详见表1。

表1 NBI-ME和EUS判断早期食管癌浸润深度与病理检查结果的一致性(n)
2.3 NBI-ME和EUS判断早期食管癌浸润深度的准确度
NBI-ME判断早期食管癌浸润深度的准确度为85.32%,高于EUS的51.38%,差异有统计学意义(P<0.05)。详见表2。
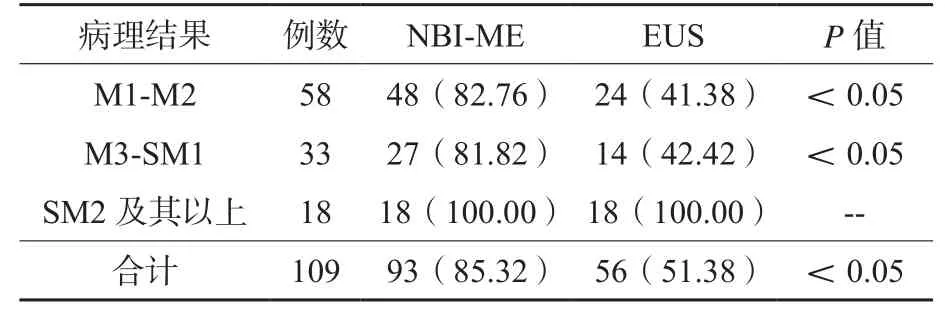
表2 NBI-ME和EUS判断早期食管癌浸润深度的准确度(n/%)
3 讨论
早期食管癌的定义为局限于黏膜和黏膜下层、不伴有淋巴结转移和远处转移的肿瘤。当前内镜下黏膜切除术及内镜黏膜下剥离术已成为早期食管癌和高级上皮内瘤变治疗的重要方法,而对于早期食管癌手术方案,决定内镜治疗或外科开胸手术的重要依据为病灶浸润深度。既往研究显示,食管黏膜癌的转移率为5.0%~8.5%,而黏膜下癌的淋巴结转移率则升至16.6%~38.0%[8-9]。因此,准确判断食管癌病变深度,是指导合理治疗方案选择的关键所在,也是保证患者预后生存期及生活质量的重要前提。
EUS将内镜与超声相结合用于消化道检查,能够获得食管及胃肠层次结构及其周围器官图像,是临床诊断早期食管癌的常用手段,据报道,EUS诊断早期食管鳞癌的准确率高达85.2%[10],然而,本研究结果提示,EUS判断早期食管癌浸润深度的准确度仅为51.38%,且与病理检查结果的一致性仅为0.292,说明EUS仅可用于早期食管癌的诊断,难以为临床治疗方案决策提供可靠参考,其弊端主要在于:在频率5~12 MHz的超声图像上,食管壁分为5层结构,黏膜肌层辨认难度较高,而固有肌层与肿瘤病灶同为低回声表现,可能造成主观过度诊断[11-12]。本研究33例患者病理结果判断是食管癌浸润深度为M3-SM1,而EUS则将其中17例归为浸润深度达SM2及其以上,存在过度诊断问题。此外,肿瘤病灶在浸润性生长时,其周围往往伴有组织坏死及炎性反应,区域淋巴结也可能发生反应性增大,与固有肌层相同,炎性病灶在EUS图像上亦表现为低回声,也是造成过度诊断的重要原因之一[13]。虽然高频超声探头可将食管壁细分为9层,但仍难以观察到微小肿瘤浸润灶,且亦难以区分坏死组织、炎性反应区域与浸润肿瘤组织,加之超声小探头对直径超过3 cm肿瘤组织的诊断准确性较低[14-15],均限制了EUS在判断早期食管癌浸润深度中的临床应用价值。
NBI-ME主要通过观察食管上皮乳头内IPCL的形态结构变化,为早期食管癌浸润深度的判断提供参考。该技术利用特殊光源滤器过滤发射不同波长的窄带光谱,可使浅表性癌灶镜下表现为棕色区域,为IPCL细微结构的观察创造良好条件[16]。既往研究根据IPCL镜下扩张度、弯曲度、形态及直径变化,将其分为Ⅰ~Ⅴ型[17],本研究在公认Inoue分型标准的基础上,将IPCL分型与早期食管癌浸润深度一一对应,结果显示,NBI-ME判断早期食管癌浸润深度的准确度高达85.32%,且与病理检查结果的一致性Kappa值亦为0.762,显现出NBI-ME在指导浸润深度评估方面的重要作用。
NBI-ME优势主要在于:早期食管癌在不同浸润深度状态下,IPCL呈渐进性变化,而NBI-ME不仅能够清晰显示黏膜表层结构和微血管,亦可实现IPCL形态的精细观察,借此早期发现病灶进行病变浸润深度判断[18-19]。与此同时,NBI-ME检查过程中并无染色剂与食管黏膜的接触,能够有效避免烧灼感、碘过敏等不良反应发生,且检查操作相对简单、可重复操作并可进行全方位观察[20],亦能够指导靶向活检,避免反复夹取病灶所致疤痕粘连甚至内镜下手术难度上升。
综上所述,NBI-ME和EUS均可为早期食管癌浸润深度的判断提供一定参考,得益于NBI-ME在观察IPCL细微结构方面的显著优势,该技术判断早期食管癌浸润深度的准确率及与病理结果的一致性均高于EUS,临床推广应用价值更高。
