米槠叶片基因组DNA的提取及分析
2019-08-07林莉莉郭丽倩陈潇潇游章湉游水生曹世江
林莉莉,郭丽倩,陈潇潇,游章湉,游水生,曹世江
(1.福建农林大学林学院,福建 福州 350002; 2.浙江大学农业与生物技术学院,浙江 杭州 310027;3.中国科学院华南植物园退化生态系统植被恢复与管理重点实验室、中国科学院华南植物园广东省应用植物学重点实验室,广东 广州 510650)
米槠(Castanopsiscarlesii(Hemsl.)Hay.)为壳斗科栲属乔木,是东亚地区具有代表性的建群种,是亚热带地区的常绿阔叶林组成树种之一。它不仅适应温暖湿润多雨的气候,同时也能耐荫,耐瘠薄干旱,适应性强,在福建、湖北、四川、贵州、台湾、日本等地区广泛分布[1-3]。米槠生长迅速,抗风力强,又耐烟尘、抗污染并能杀菌,在营造防火林带中有着广阔的应用前景和发展潜力[4-5]。由于现阶段我国亚热带地区经济发展迅速,人口密度增加,人类对米槠群落的干扰影响比较严重,加之采伐强度大,导致米槠群落退化严重[6]。因此开展米槠DNA提取研究对其分子生物学以及遗传多样性等方面具有重要意义。
高质量的DNA是进行基因检测的重要基础,PCR为基础的基因检测技术在遗传多样性、遗传分析、亲缘关系等各个方面都有广泛的应用[7],所以得到高质量的DNA是有效用于PCR扩增、基因克隆、基因图谱、进化进程分析的重要基础,是成为植物分子技术分析的首要前提[8-10]。因此出现了针对各种栲属植物,如赤枝栲(Castanopsiskawakamii)[11]、格氏栲(CastanopsiskawakamiiHayata)[12]、丝栗栲(CastanopsisfargesiiFranch)[13]、红锥(CastcmopsishystrixA.DC)[14]等植物基因组DNA提取方法的研究,采用了柠檬酸钠法、尿素法、高盐低pH法、SDS法、传统CTAB法和试剂盒提取这6种方法,但至今尚未见有关米槠基因组DNA提取方法的研究报道,参考现有的栲属植物基因组DNA提取方法。本研究采用改良的CTAB法来提取米槠基因组DNA,以期找到高效提取米槠基因组DNA的方法,为其后续PCR、遗传分析等方面的研究及应用提供参考。
1 材料与方法
1.1 材料来源
试验所用的米槠叶片采自福州鼓山风景区,根据人类干扰程度的大小选择6个不同的米槠群落(表1),于2016年6月采集新鲜叶片,冻存于-80 ℃冰箱内。

表1 6个米槠群落的概况
1.2 试剂与仪器
主要试剂为DNA提取缓冲液(100 mmol·L-1Tris-HCl,pH 8.0,20 mmol·L-1EDTA,pH 8.0,1.0 mol·L-1NaCl,2%(w/v)CTAB,0.5%β-巯基乙醇(使用时现加入)),氯仿,异丙醇,75%乙醇,ddH2O等,所用试剂均为分析纯。主要仪器有:低温离心机,干式恒温器,PCR仪,电泳仪,超微量分光光度计DeNovix,电泳凝胶成像数据分析系统。
1.3 方法
1.3.1 DNA提取 秤取米槠叶片0.05 g于干燥的研钵内,加入适量液氮研磨成粉末,转入1.5 mL离心管中并加入预处理的DNA缓冲液500 μL,65 ℃水浴30 min,期间每隔10 min混匀1次;4 ℃,13000 r·min-1离心2 min,取上层水相并加入氯仿500 μL,混匀后静置2 min;4 ℃,13000 r·min-1离心15 min,取上层水相,加入等体积已加入10%NaAC的异丙醇,上下颠倒混匀,在-20 ℃下醇沉30 min。4 ℃,13000 r·min-1离心15 min,收集沉淀,加入75%乙醇溶解、洗涤;4 ℃,13000 r·min-1离心3 min,重复2次;置于通风橱数分钟,待管内乙醇挥发殆尽,加入ddH2O 100 μL,震荡混匀即为所提取的基因组DNA。
1.3.2 DNA检测 取1 μL DNA样品于超微量分光光度计DeNovix上测定DNA浓度、A260/230、A260/280。通过1%琼脂糖凝胶电泳检测DNA的完整性,并拍照记录。
1.3.3 PCR检测 以米槠叶片提取的DNA作为模板进行PCR检测。用trnL为引物进行PCR扩增(表2),反应体系为模板500ng、引物10 pM、ddH2O 8 μL、Master Mix10 μL。反应程序为94 ℃预变性5 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸1 min,进行40个循环;再于72 ℃延伸10 min[15]。PCR产物用1%的琼脂糖凝胶电泳检测,通过电泳凝胶成像数据分析系统观察并采集图像。

表2分子标记引物序列
2 结果与分析
2.1 米槠叶片DNA的质量浓度和纯度
表3是经超微量分光光度计检测所得的每个米槠群落内5个米槠叶片样品DNA浓度和纯度的平均值。结果表明,试验中所提取的DNA,A260/230值均在2.0左右,说明纯度较高,多糖等杂质较少;A260/280的值均在2.0左右,说明DNA中还有少量的RNA,但不影响后续试验操作。试验提取的米槠DNA质量浓度均在400~750 ng·μL-1之间,DNA得率在80~120 mg·g-1之间,在微量试验中产率较高,说明本方法能够有效的提取到米槠分子生物实验的DNA质量。

表3 6个米槠群落内叶片DNA质量浓度和纯度的平均值
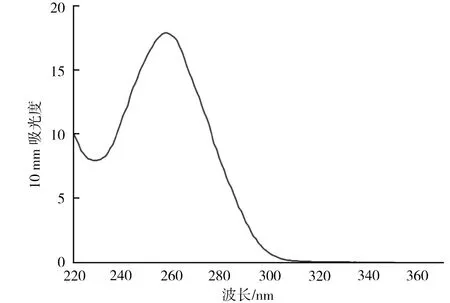
图1 米槠基因组DNA的紫外吸收曲线

图2 DNA琼脂糖凝胶电泳结果

图3 以trnL为引物的PCR扩增产物电泳图

图4 米槠PCR产物测序结果

图5 米槠基因测序部分波峰图
2.2 米槠叶片基因组DNA的质量
试验结果发现,采用该方法所获得的沉淀物能够较好地溶解于乙醇中,在提取过程中多酚类物质影响较小。由图1、图2可知,采用该方法提取的米槠叶片基因组DNA质量好,经过1%琼脂糖凝胶电泳后,条带明显,且只有1条清晰的主带,“拖尾”现象较小,DNA降解和RNA污染的现象也轻,DNA质量稳定。
2.3 PCR扩增结果
图3是以采用trnL为引物的PCR扩增电泳结果。由图3可得,采用本文改良的CTAB法所获得的DNA结果,在trnL引物和反应体系中能够得到稳定的扩增片段,长度约为800 bp,主带清晰、明显,无杂带,重复性好。由此可见,采用该方法所提取的米槠DNA质量高,可以应用于以PCR为基础的分子生物研究。
2.4 米槠叶片基因组DNA测序结果
将PCR扩增结果送到铂尚生物技术有限公司测序得到结果。结果表明本次测定的序列长度均在800 bp左右,图4为第5号米槠群落样品的测序结果之一,序列长度为788 bp,与YU-PIN CHENG利用该引物测序所得结果801 bp相似度高达97.3%[15],在该基因中A占35.2%,G占15.6%,T占33.2%,C占16.0%,且基因测序结果有效区间的波峰图中主峰明显,没有特异性条带干扰(图5)。因此利用该方法提取的DNA可用于米槠遗传多样性的分析。
3 讨论与结论
米槠属于顽拗植物,细胞中多糖、酚类、单宁等物质含量较多[16],在提取过程易褐化形成粘稠的物质,严重影响实验操作。通过前期的试验摸索,从中找到适合米槠基因组DNA提取的方法。本次试验提取液中NaCl的含量为1.0 mol·L-1,用量减少,加入0.5%的β-巯基乙醇相较于常见植物DNA提取方法中的0.1%[17]用量有所增加,能够有效地减少提取过程的褐变,与现有格氏栲的方法中3%[12]相比,本方法的用量降低了操作过程的毒性。实验省略了酚氯仿的使用,且氯仿在该过程中只使用1次,又进一步减少了实验操作中的毒性。本方法使用10%的醋酸钠去除基因组DNA中糖类的干扰,在-20 ℃下用异丙醇代替75%乙醇能使DNA更易醇沉。该方法使用的试剂均为实验室常见试剂,操作简单,提取过程相对于试剂盒提取基因组DNA消耗时间少,整个操作时间在2 h左右,且在操作过程中有效调整了β-巯基乙醇的用量,减少氯仿的使用次数,省略了酚氯仿这些有毒物质的使用,相较于传统的CTAB法,本方法毒性较小,操作简单,用时少;相对于试剂盒提取,本方法更加经济实用。
叶绿体是植物细胞质遗传的重要单位,具有相对独立的遗传物质(cpDNA)[18]。叶绿体基因组在植物分子标记[19]、系统发育基因组学[20]等方面有广泛的应用。本试验使用的材料为福州鼓山米槠的叶片,采用幼叶和成熟叶片均能达到良好的效果。利用紫外分光光度计检测,在6个米槠群落样品中均提取到了较好的基因组DNA,提取过程中有效降低了DNA的降解,同时实验结果能够用于PCR扩增DNA模板。基因组DNA和PCR扩增产物在琼脂糖凝胶电泳中均能够得到稳定的条带,PCR产物条带清晰,“拖尾”现象较少,且扩增结果能够得到稳定序列结果,为今后对米槠不同种群间的遗传序列分析、基因定位等研究提供了较好的DNA提取方法。且利用本方法提取格氏栲(CastanopsiskawakamiiHayata)的基因组DNA也取得了比较好的结果,因此本方法能够为米槠和格氏栲等其它栲属植物的DNA提取以及其它分子研究提供参考。
