食管裂孔疝的病理生理
2019-08-06陈双周太成马宁
陈双 周太成 马宁
食管裂孔疝是指腹腔内脏器或组织(主要是胃、网膜、结肠等)通过膈肌的食管裂孔持续或暂时性进入胸腔所致的疾病,国外60岁以上的西方人群中,存在食管裂孔疝患者占60%,而其中95%以上是滑动型的食管裂孔疝(Ⅰ型)。我国关于食管裂孔疝的流行病学数据并不完整,在新疆,食管裂孔疝的发病率可高达20%,而在一些地区也可以低至3%~5%[1]。
因食管处于特殊的解剖部位、具有一些特殊的解剖结构。食管裂孔疝内容物在这些位置的滑动、对解剖结构对破坏,会引起一些列对病理生理改变,导致特殊情况的发生。同时,食管裂孔疝的发生也涉及到一些列的病理生理改变。而许多临床医生对食管裂孔疝的发生及发病危害机制并不清楚。本文就此做一梳理及阐述。
一、食管裂孔疝起因的病理生理
人们对食管裂孔疝的认识过程将近260年。来自美国麻省的Henry Ingersoll Bodwitch是第1个详细描述膈肌缺损的人。1853年他在《A Treatise on Diaphragmatic Hernia》中通过88例尸检,描述了我们现在所熟知的裂孔疝的病理状态[2]。而1904年,Eppinger首次诊断在活体患者中确诊食管裂孔疝,而他的诊断在随后的尸体解剖中得到验证,而在1911年Eppinger发表文章进行了详细的病历介绍[3]。
虽然人们对食管裂孔疝的认识和治疗时间由来已久,但对于食管裂孔疝的发生原因,一直没有一个明确的论断。而几百年来的研究一般认为食管裂孔疝是一个多因素作用的结果,主要与以下几个因素有关。
(一)腹腔内压力升高
食管裂孔疝在肥胖人口较多的西方国家中,发病率很高。而肥胖患者腹内压力较正常人高,所以有推测认为腹内压力增高与食管裂孔疝的发生有相关性[4]。这也很好理解:在肥胖或孕妇人群,增高的腹内压力将胃食管结合部位从腹腔向胸腔产生一个推力,久而久之产生食管裂孔疝。
相关的研究也显示了这一点,2006年Pandolfino等[5]研究了285例患者的体重指数(body mass index, BMI)和腰围(waist circumference,WC),他们发现无论患者吸气相或呼气相,其BMI和WC与胃内压、食管内压正相关。他们还发现:BMI每增加1 kg/m2,胃内压力就上升0.3 mmHg(1 mmHg=0.133 kPa);WC每增加1 cm,胃内压力就增加0.16 mmHg。另外一方面,食管内压力也随着BMI每增加1 kg/m而升高0.17mmHg,随着WC的每增加厘米而升高0.1mmHg。此外,他们还发现肥胖与胃食管压力梯度呈正相关性。
这项研究还仔细测量了肥胖人群的食管下括约肌、膈肌脚的空间结构,结果显示肥胖人群中这些胃食管结合部的结构解剖上的分离度更大。这也提示腹内压力不仅仅将胃食管结合部向胸腔推压,还会对食管下括约肌和膈肌脚产生持续的作用力,而导致其支撑功能的破坏。这在食管裂孔疝的形成中至关重要。
所以,增高的腹腔内压力,可能是食管裂孔疝的始动因素。压力本身存在对胃食管结合部的物理作用,还会对膈肌及筋膜、纤维组织产生破坏。而在一些膈肌存在先天性或后天性薄弱的人群,食管裂孔疝的发生可能就更加容易。
(二)膈肌及裂孔周围组织薄弱
在所有有关的食管裂孔疝发生的假说中,提出的裂孔疝形成理论中,最多客观存在的证据是关于膈肌肌肉或连接组织的变化可能有助于疝的发展[6]。有一些关于食管周围韧带和肌肉细胞变化的研究,主要集中在肌肉纤维的完整性、细胞外基质(etra-celluar matrix,ECM)的成分,如弹性蛋白、胶原蛋白、糖蛋白和蛋白聚糖。可能有助于食管裂孔疝的发生。
膈肌脚肌肉的变化:有研究显示,膈肌脚肌肉纤维细胞水平的变化,可能与食管裂孔疝发生有关[7]。Fei等[7]在需要做Nissen折叠的48例GERD患者中,取膈肌脚肌肉纤维组织,其中33例合并食管裂孔疝的患者与另外15例患者中,存在肌肉纤维细胞水平的明显不同,主要存在以下4个不同级别的变化:1级,肌纤维间隙扩张;2级,肌管状结构肿胀;3级,局灶性肌纤维退变;4级,广泛的肌肉结构破坏、退变。在电镜下,存在食管裂孔疝的患者的肌肉细胞超微结构,也和不存的人群有明显差别。这些细胞的变化包括:亚肌细胞区的空泡退化、核变性、胞膜皱纹和肌纤维及肌小节变性。
虽然相关研究不多,但这些证据显示膈肌肌肉的微观变化,与食管裂孔疝肯定存在相关性。虽然不知道这些相关,是造成食管裂孔疝发生还是食管裂孔疝存在导致的结果。未来需要相关研究明确这个问题。
胶原水平的变化:胶原变化在腹股沟疝和腹壁切口疝的发生过程中,起了比较重要的作用。一般认为呢,成熟的Ⅰ型胶原减少、不成熟的Ⅲ型胶原的增加,削弱了腹壁的张力,在一定程度上促进了腹股沟疝和腹壁切口疝的发生。在食管裂孔疝的病因学里面,胶原水平是否也发生了变化?此方面的研究很少,但2009年来自瑞典的一项研究显示[8]:食管裂孔疝患者人群高发异常胶原蛋白的沉积。这个研究显示食管裂孔疝的形成与染色体上编码3型胶原蛋白的COL3A1基因存在相关性在36个GERD流行率很高的家庭成员中,研究人员通过研究成员们的血液、口腔拭子标本,进行测序,研究结果显示在GERD和食管裂孔疝高发人群中,COL3A1高表达。从这个研究中,我们可以看到不正常的胶原蛋白沉积可能会改变食管周围韧带的完整性,通过改变其抗张性而导致食管裂孔疝的发生。因此,虽然没有直接的证据表面胶原蛋白与食管裂孔疝存在相关,但胶原蛋白在其发生发展中肯定发挥了一定的作用。
金属基质蛋白酶:基质金属蛋白(metal matrix proteaes,MMP)是降解和重塑的ECM大分子的蛋白酶,可以影响胶原或弹性纤维的代谢。到目前为止,已经发现有将近30种不同的MMPs。它们在许多疾病的病因学发挥了重要的作用,比如肺气肿、腹主动脉瘤、腹股沟疝、切口疝等。
因为食管裂孔疝与胶原的退变存在关系,所以有学者进行了相关研究[9]。他们检测其肝胃韧带(gastrohepatal ligament,GHL)、胃膈韧带(gastrophrenic ligament, GPL) 和膈食管韧带(phrenicoesophageal ligament,PEL)标本中MMP的表达情况,来自6例贲门失弛缓、无裂孔疝的患者,包括3个与弹性纤维蛋白酶相关MMPs(MMP-2,MMP-9和MMP-12)和5个胶原蛋白酶相关MMPs(MMP-1,MMP-3,MMP-7,MMP-8和MMP-13)。我们发现GHL含有最高的MMP-2的表达,但所有3个韧带都存在有MMP-2、MMP-8和MMP-9的表达。并无MMP-1、MMP-12或MMP-13的表达,同时韧带中的MMP-3水平很低。根据这些结果,MMP-2可能是主要负责食管周围韧带中ECM降解的金属基质蛋白酶。未来进一步测量食管裂孔疝患者中食管周围韧带中MMP-2的含量,可以明确MMPs在食管裂孔疝发生发展中的作用。
(三)先天性或后天性食管缩短
食管的长度在食管裂孔疝的发生发展中,也起到了很大的作用。食管裂孔疝的患者中,无论是哪种分型,食管长度都有一定程度上暂时性或永久性的短缩,导致的结果就是牵拉胃食管结合部进入胸腔。这个证据可以追溯到早期的动物实验,研究表明食管缩短导致迷走神经刺激形成裂孔疝[10]。对于食管短缩的发生,有人提出了一些假说,例如有一种理论认为它可能是吞咽的生理后遗症,而另一种理论认为它可能是由于食管炎造成的瘢痕纤维化的结果[11]。
Christensen和Miftakhaov[12]通过相关的神经研究认为,食管在每次吞咽动作的时候,其纵向肌肉应拉动胃食管结合部靠近膈肌,但并不进入胸腔,这是依靠抑制性的迷走神经支配的的结果,这种抑制机制不允许胃食管结合部或胃底进入到胸腔。而这种反馈抑制功能在因为迷走神经疾病损害的情况下,食管肌肉收缩强度的增加、不受控制,可能会导致食管裂孔疝的形成。
二、食管裂孔疝致病的病理生理
食管裂孔疝,可以导致严重的胃食管反流、慢性或急性的腹内器官压迫,从而导致一系列的急慢性病变。其主要从以下几个方面导致疾病的发生。
(一)对食管下端抗反流机制的损害
食管下端存在正常的胃食管屏障,该屏障的阻力防止胃液从高压的胃病理性反流到低压的食管中,主要由解剖(阀门瓣膜)和生理(括约肌)成分组成,在应激或非应激的情况下,两者共同作用防止反流。其关键决定因素包括:静息状态下结构完整的LES,可导致暂时性括约肌功能失调的吞咽动作,膈肌脚、HIS角和胃底共同形成的胃食管阀门瓣膜的解剖结构[1]。食管裂孔疝会对以上结构产生破坏,从而导致反流的发生。
虽然胃食管阀瓣(gastroesophageal valve,GEV)在以前就已经被描述过[13],但其抗反流的作用一直没有得到很强烈的关注。下图1是GEV的解剖图片,我们能看到GEV位于胃食管交界处,主要由LES、HIS角、膈肌脚、贲门处黏膜等维持,伸入胃底,在胃底内容物的挤压下,能与被挤压闭合,类似于单向阀门,与气门芯很像。GEV的长度在抗反流作用中非常重要。正常抗反流的括约肌压力可以通过缩短的总括约肌长度被削弱,比如当胃充盈时,括约肌长度变短(就像气球膨胀时气球颈部缩短一样)。如果LES的总长度异常短,即使空腹状态,胃发生轻微的扩张,短LES都不足以维持正常的括约肌功能,反流随之发生。在图2中,我们可以看到,当括约肌长度一直缩短,达到2 cm异常短的时候,括约肌的压力就会迅速下降、功能迅速丧失[1]。
所以,在一项关于内镜下食管炎和胃食管阀瓣关系的研究中,这证实GEV对抗反流的重要作用。而有研究通过内镜下的特征[14],对食管酸暴露和食管黏膜损伤程度对不同胃食管瓣膜形状分级患者进行比较。探讨胃食管阀瓣及其他标志在反流性疾病的诊断中的价值及敏感性、特异性。

图1 胃食管阀瓣
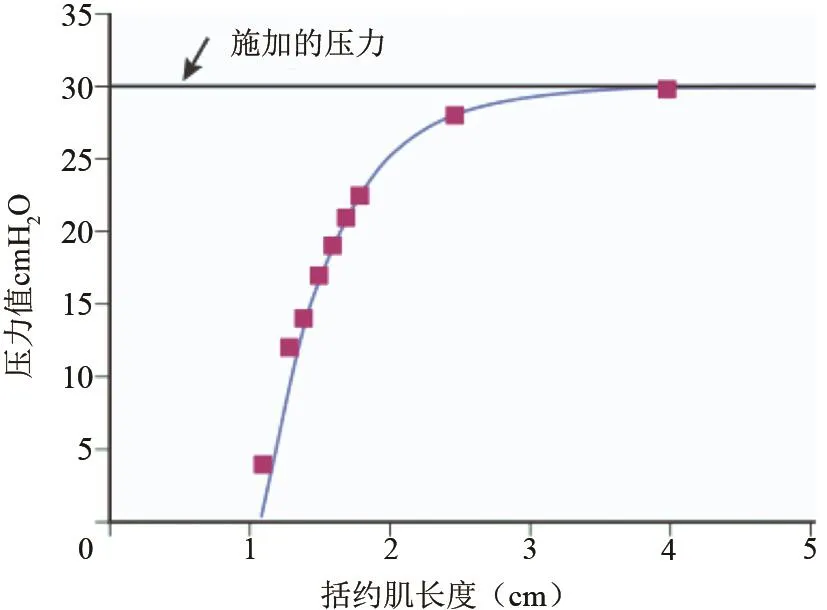
图2 保持施加压力或“括约肌挤压”时,静息括约肌压力与括约肌长度之间的关系

图3 不同GEV状态分级

图4A 巨大裂孔疝造成胃胰腺嵌顿,并胃扭转图4B 巨大裂孔疝造成胃胰腺嵌顿,并胃扭转模式图

图5 巨大食管裂孔疝压迫心脏,导致心脏向右侧偏移
在偶然的情况下,对暂时性食管下端括约肌松弛(tLESR)现象的研究发现了膈肌脚的作用,当LES的压力丧失时,膈肌脚仍然能起到一定的抗反流作用。在正常人群中,即使没有LES压力的存在,在膈肌脚不松弛的情况下,反流仍不会发生。从中我们可以看到,食管裂孔疝,无论其分型如何,对胃食管阀瓣膜的损害是肯定存在的,只是程度不同而已:有可能是长度的缩短,甚至是GEV的消失。
(二)影响食管排空
食管裂孔疝的存在也会扰乱食管排空机制,这可能与食管在腹部的锚定作用丧失有关。Kahrilas等[15]发现,无食管裂孔疝的对照组人群,86%的人群能通过吞咽动作完全排空食管;可复性(滑动型)食管裂孔疝患者中,66%患者通过吞咽动作能排空;而在不可复性的食管裂孔疝中,只有32%患者能通过吞咽完成食管排空。
以上结果表明,食管裂孔疝的存在确实会影响食管的排空,不光导致胃食管反流的发生,还可能因为食管排空障碍,产生咽喉的反流。这就不难解释一些反流严重的患者,出现的慢性咽炎、肺炎或者是哮喘等症状。另外一方面,不能排空的食管,会产生一系列的异常收缩,这是许多食管裂孔疝患者主诉的重要症状,大量无效、频繁的食管收缩,严重影响患者生活质量。
(三)压迫造成的损害
1.急性嵌顿的损害:在一些缺损较小或隐匿的食管裂孔疝患者中,平时反流症状不重,没有足够的警惕性。突发的剧烈呕吐、腹内压突然升高的情况下,腹内器官可能通过狭窄的食管裂孔进入胸腔产生嵌顿,由于裂孔疝疝囊颈狭窄,进入胸腔的器官嵌顿后血供受影响,而产生坏死[16]。这是食管裂孔疝引起的急腹症,手术处理难度大、患者死亡率高。这种情况值得引起外科医师注意。
2.慢性压迫的损害:对于食管裂孔疝的慢性扩大,腹腔内脏器逐渐进入到胸腔,并于胸膜产生黏连、成角,会导致腹腔内脏器的损害,比如肠道慢性梗阻。同时存在于胸腔的大量腹腔器官,还可能会压迫肺、心脏,产生肺不张、肺部感染、心功能不全甚至是致死性的心律失常等情况[17]。也值得外科医师重视。
总之,食管裂孔疝的发生、发展是一个病理生理过程。对于食管裂孔疝的治疗,也需要按照这个病理生理变化的规律,顺势而为。比如外科手术的关键是恢复胃食管结合部位的结构、LES正常的解剖位置以及折叠以后LES的长度,并且需要妥善固定,防止其再次产生向胸腔的移位,这样也可以最大程度的恢复、保持LES的抗反流功能。同时,关闭食管裂孔及补片的使用,也是防止裂孔缺损复发、再次产生腹内器官疝入的关键。
相关的内外科医师,只有对相关机制、病理生理做到足够的了解,才能对该疾病产生根本意义上的理解,从而对每个患者作出个体化、精准的治疗。而外科医师根据不同患者的病理生理状态,做到严格管控围手术期,合理采用手术治疗,统一恢复食管下端的解剖和功能,才能取得良好的手术效果并减少并发症的发生,才能真正意义上造福食管裂孔疝的患者。
