小鼠心肌急性缺血再灌注早期差异表达microRNA的筛选及验证*
2019-08-03陈圆圆颜峰平
陈圆圆,叶 星,颜峰平
(赣南医学院法医学系,江西 赣州 341000)
急性心肌缺血是造成心脏性猝死的主要原因, 而一定时间缺血后再灌注不但可以加重心肌损伤, 还可造成致命性心律失常,甚至引起心脏性猝死。司法鉴定实际工作中,有很多情况是由冠状动脉痉挛突然缓解和血栓溶解后再灌注所造成。此种情况下,由于缺血时间过短, 常规HE等染色技术看不出心肌的明显变化, 难以作出心脏性猝死的诊断, 给司法鉴定工作带来很大困难。因此寻找早期心肌缺血/再灌注损伤(ischemia/reperfusion injury, I/R损伤)的敏感性生物标志物具有重要的法医学应用价值。
miRNA是一种内源性长度大约为21~25个碱基的非编码RNA,通过降解目的基因或抑制目的基因翻译来进行转录后调控[1]。miRNA在急性心肌梗死、心力衰竭[2-3]、心律失常[4]等不同的心脏疾病中均出现异常的表达,被认为可能成为心血管疾病诊断、治疗及预后的生物学标记物。本研究通过构建小鼠心肌缺血后再灌注(ischemia/reperfusion,I/R)损伤模型,用miRNA芯片技术筛选心肌缺血后呈差异表达的miRNAs,为研究早期心肌缺血的发病机制提供重要的理论基础,并为心源性猝死的法医学鉴定提供一定的依据。
1 材料与方法
1.1材料
1.1.1实验动物健康雄性C57 BL/J小鼠20只,体重25~30 g,购自上海杰思捷实验动物有限公司。
1.1.2主要试剂及仪器5%水合氯醛(Sigma),TRIzol试剂(Invitrogen),Mir-X miRNA First-Strand试剂盒(Clontech),SYBR Green PCR试剂盒(Qiagen),PCR引物(上海生工生物工程股份有限公司),小动物呼吸机(SAR-830,CWE),多通道生理记录仪(上海嘉龙教仪厂),荧光定量PCR仪(Applied Biosystems)。
1.2实验方法
1.2.1动物分组和模型建立小鼠随机分为2组,每组10只,分别为I/R组和对照组。将小鼠用5%水合氯醛腹腔注射麻醉,待其麻醉后左侧胸部脱毛,手术区域备皮消毒,经口腔气管插管后,连接小动物呼吸机维持呼吸,小鼠仰卧,四肢固定于手术台上。
I/R组小鼠于胸骨左侧第3、4肋间剪开皮肤,逐层钝性分离皮下组织、肌肉,打开胸腔充分暴露心脏,剪开心包,用带线6-0线缝合针于心耳下缘1 mm处穿过心肌表层,结扎冠状动脉前降支(LAD)。结扎LAD后可看到左心室前壁心肌变白,心电图ST段抬高,判定为缺血成功[5]。确认心肌缺血后逐层关闭胸腔、缝合皮肤和肌肉,缺血45 min后,在体外将结扎线拉出[6],心电图显示ST段抬高部分回落,表示再灌注成功,持续3 h后将小鼠麻醉处死取心脏。
对照组操作同缺血组,但不结扎LAD。每个样本取部分心脏组织迅速放入RNA 保护液,以进行RNA抽提;余放入-80 ℃冰箱冻存。
1.2.2总RNA提取和芯片检测I/R组及对照组心肌组织按TRIzol一步法提取总RNA,用琼脂糖凝胶电泳判断提取的RNA质量,同时用紫外分光光度法检测所提取RNA的浓度和纯度。RNA在波长为260 nm和280 nm处的吸光度比值要求在1.8~2.2范围内,方可进行后续实验。
首先对质检合格的总RNA使用mirVanaTMmiRNA Isolation试剂盒(AM1561)进行纯化,采用Agilent Mouse miRNA(8×60K)芯片及Agilent Feature Extraction(v10.7)软件进行分析并提取数据,然后使用Agilent GeneSpring软件对数据进行归一化,并采用GeneSpring软件进行组间的差异分析;差异表达的microRNA筛选标准为:P≤0.05,同时差异倍数(fold-change, FC)在2倍以上。
1.2.3实时荧光定量PCR(qPCR)检测样本总RNA通过Mir-X miRNA First-Strand试剂盒合成cDNA,以U6为内参,利用SYBR Green实时定量PCR法检测相应miRNA的相对表达水平,其计算方法采用2-△△Ct。U6和通用反向引物由Mir-X miRNA First-Strand试剂盒提供,挑选的差异表达miRNAqPCR引物序列见表1。
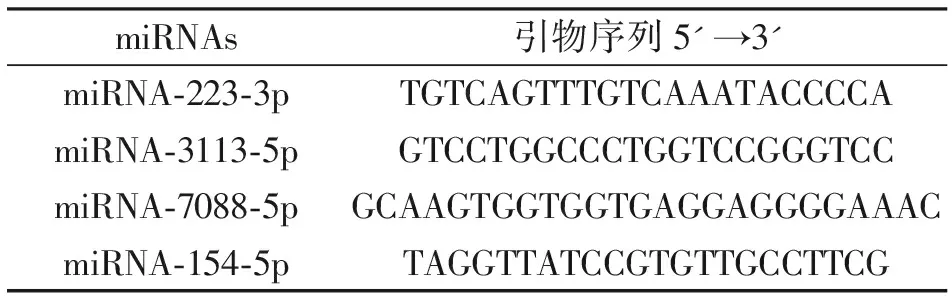
表1 miRNA荧光定量PCR引物序列
2 结 果
2.1急性心肌I/R损伤模型的构建在小鼠I/R模型构建过程中发现心肌缺血区域颜色(图1B)较对照组心肌(图1A)明显呈苍白改变;心电图显示心肌缺血期表现为ST段抬高,再灌注期抬高的ST段部分回落(图1C)。以上心肌缺血后颜色改变和心电图变化的结果表明小鼠心脏I/R损伤模型构建成功。
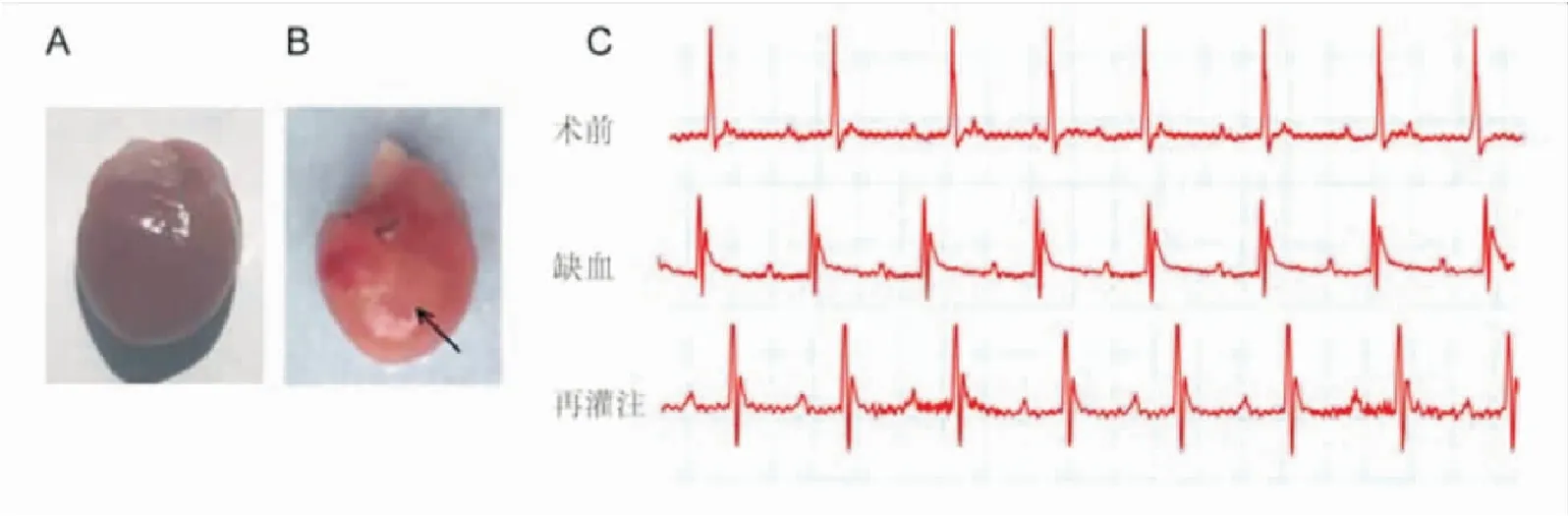
注:A:对照组心肌组织外观;B:缺血心肌组织外观,其中黑色箭头表示心肌缺血区域;C:小鼠I/R手术前、缺血、再灌注期心电图变化。
2.2小鼠I/R组和对照组心肌miRNAs芯片检测结果I/R组和正常对照组心肌的miRNAs芯片检测显示,共筛选出52个差异表达的miRNAs,其中41个表达上调,11个表达下调,结果见表2。
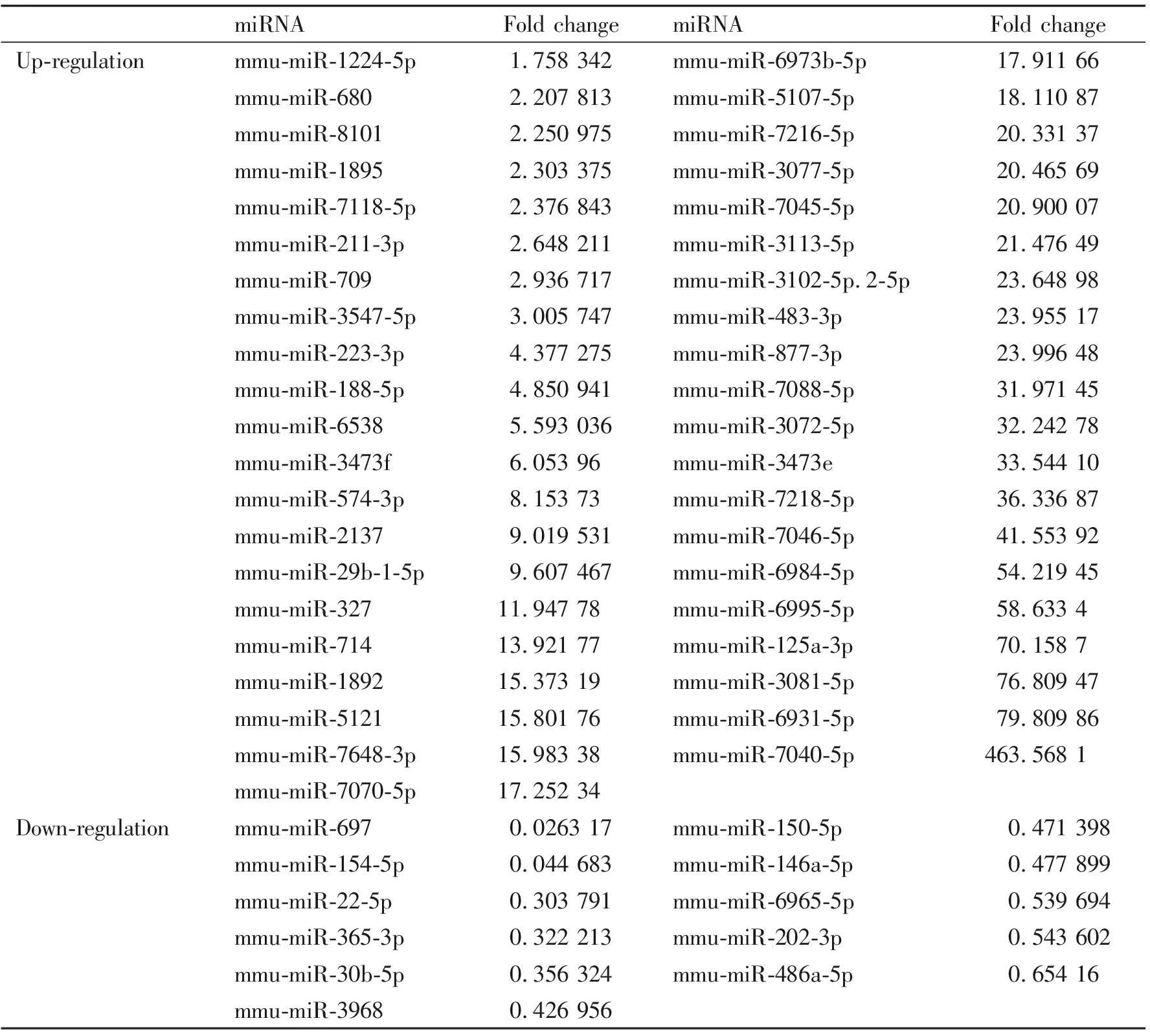
表2 心肌I/R损伤相关差异表达的miRNAs
注:Fold change均为I/R组/对照组的数值,n=2。
2.3miRNA荧光定量PCR验证结果为验证小鼠心脏I/R损伤后miRNAs芯片检测结果,我们选取了文献报道与心肌I/R损伤相关的miRNA-223-3p、miRNA-154-5p和目前鲜有报道的miRNA-3113-5p、miRNA-7088-5p进行荧光定量PCR验证。结果显示:与对照组相比,I/R组心肌的miRNA-223-3p、 miRNA-3113-5p及 miRNA-7088-5p表达上调,miRNA-154-5p表达下调(图2、表3)。以上 4个miRNAs的变化趋势与芯片检测结果基本一致,表明miRNAs芯片的检测结果具有可信性。
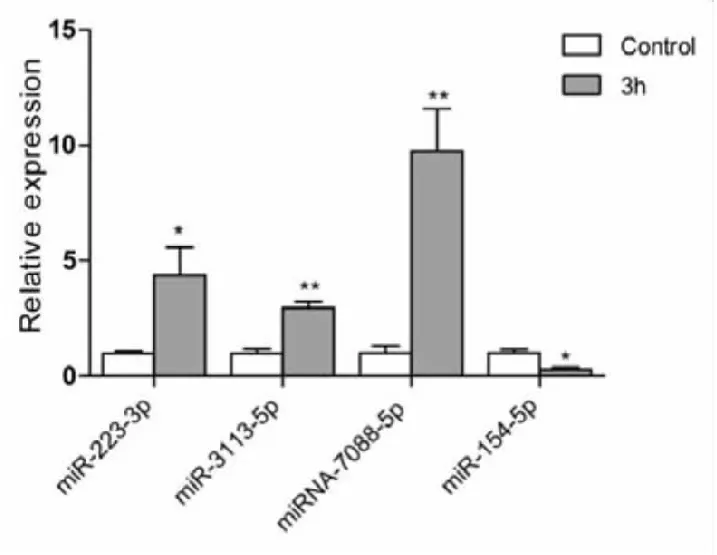
注:U6为内参,n=3,与对照组比较* P≤0.05,** P≤0.01。

表3 荧光定量PCR验证对照组和I/R组心肌组织中miRNAs相对表达量(U6为内参)
3 讨 论
miRNA参与了包括心肌病、心脏肥大、心功能衰竭、心律失常和I/R损伤等多种心脏病理改变,其中许多被鉴定为在心肌缺血期间释放到循环系统中。研究发现冠心病患者升高的血浆miRNA 223含量与其疾病的严重程度相关,血清miRNA 223可能成为心力衰竭患者结节病的新一代生物标志物[5-6]。循环miRNA 1, 499-5p和miRNA 133a或心肌细胞特异性miRNA 208b在ST段升高的心肌梗死(STEMI)发病的患者中立即增加,并且在疾病发作后12 h内达到峰值[7]。在心脏I/R的啮齿动物模型中也发现了类似的观察结果,伤后120 min上述miRNA达峰值时间[8]。以上研究提示,miRNAs可在疾病发生的极短时间内(几小时内)被释放入血而被检测到。
本次我们通过构建小鼠早期心肌I/R损伤模型,采用心肌组织为研究对象。因为在法医学实践中,由于尸体腐败等诸多因素影响,常难以获得检验所需血样。选取I/R损伤3 h的心肌作为实验对象,因为缺血及再灌注时间较短、心肌组织无特异性的病理学改变,能较好模拟法医实践中急性心肌缺血所致猝死的情形。通过对I/R组和对照组心肌进行miRNA芯片检测及生物信息学分析,发现共有52个差异表达的miRNAs,其中41个显著上调,11个显著下调。在差异表达的miRNAs中进一步选取了文献报道与心肌I/R损伤相关的miRNA-223-3p、miRNA-154-5p及目前鲜有报道的miRNA-3113-5p、miRNA-7088-5p进行荧光定量PCR验证。结果显示与对照组相比,miRNA-223-3p,miRNA-3113-5p及miRNA-7088-5p表达显著增高,miRNA-154-5p表达显著下降,它们的变化趋势与芯片检测结果基本一致,证实了芯片检测结果的可靠性。实验结果提示可能还有大量的miRNA参与了心肌I/R损伤过程。
miRNAs在IR损伤中的具体功能及机制有待进一步研究。研究人员发现miRNA-223-3p通过靶向作用并抑制NLRP3和IKB-α的表达从而减弱心肌程序性坏死和炎症反应的发生,提示miRNA-223-3p的高表达在I/R损伤中具有心肌保护作用[9]。体内外实验表明在大鼠的缺血心肌中miRNA-223的表达增加,且其通过靶向作用于PARP-1从而抑制心肌的凋亡和自噬水平[10]。Dong等研究发现miRNA-154可以通过抑制GSK-3β的表达促进心肌纤维化的发生,其过程与Wnt/β-catenin信号通路的激活有关[11]。目前未见有关miRNA-3113-5p、miRNA-7088-5p与心肌I/R损伤的报道,我们推测miRNA-3113-5p、miRNA-7088-5p在心肌I/R损伤中扮演了重要的角色,因此对它们的研究也是之后工作的重点。后续研究将进一步明确miRNA-3113-5p、miRNA-7088-5p在人体I/R损伤心肌中表达的特异性,并阐明具体作用和机制,为法医学心源性猝死的死因诊断提供应用基础。
