融合肽TAT-Helicokinin I对舞毒蛾生物活性研究
2019-08-03李永丽闫作炳周洲张永安曲良建
李永丽,闫作炳,周洲,张永安,曲良建
(1.河南科技大学林学院,河南 洛阳 471003;2.中国林业科学研究院森林生态环境与保护研究所,北京 100091)
利尿激肽Helicokinin I(YFSPWG-NH2)是从美洲棉铃虫Helicoverpa zea(Boddie)大脑中分离提取的一种小分子昆虫神经肽,属昆虫激肽(Insect kinins)家族的一员。Seinsche 等证实将利尿激肽Helicokinin I 作用于烟芽夜蛾Heliothis virescens幼虫能显著抑制其体重增加,并发现粪便中水分排泄的增加,以及在幼虫中诱导出饥饿信号,导致能量储存和营养消化效率的降低[1]。已有研究证实极微量的利尿激肽 Helicokinin I 或其类似物注入昆虫体内,可显著增加其体内液体排泄,并诱导饥饿反应、消化酶释放抑制等生理代谢变化,导致试虫的体重减轻甚至死亡[1-3]。昆虫神经肽来源于生物体,具有对高等生物和环境安全等优点,是一种极具应用潜力的天然杀虫活性物质,对其开展应用技术的研究可为害虫治理提供思路。
利尿激肽Helicokinin I 作为一种短肽类杀虫物质用于害虫治理时,首先要保证其在环境中的稳定性,其次还要满足该物质能够穿透昆虫体壁或者通过消化道顺利进入虫体进而发挥作用,这是目前昆虫神经肽在害虫治理应用中亟待解决的技术问题。利尿激肽Helicokinin I 直接穿过昆虫体壁角质而进入虫体内难度较大,通过昆虫的取食行为使该神经肽经消化道进入虫体内发挥活性是一种更可行的方法,但如何有效解决昆虫消化道酶对外源神经肽的降解是其应用中必须要解决的问题。
穿膜肽 TAT (transactivator of transcription,TAT)为HIV 病毒有效转录和复制所必须的多肽序列[4],TAT 蛋白转导域能将与之共价连接的生物大分子(如核酸、多肽、蛋白质等)非特异地转导至细胞内部,这种过程既不依赖于受体和转运蛋白,也与温度和能量无关,而且对宿主细胞几乎没有毒性[5-8]。已有研究表明,细胞穿膜肽TAT 能够携带与之融合的昆虫神经肽滞育激素(diapause hormone,DH)经舞毒蛾Lymantria dispar(Linnaeus)幼虫取食途径实现融合蛋白TAT-DH 在幼虫体内的跨膜转导到达其他组织,且该过程与融合蛋白的摄入量成比例[9]。为探明Helicokinin I 对舞毒蛾的活性与应用潜力,在完成TAT-Helicokinin I 融合肽合成与分析的基础上,笔者于2016年7—8月在河南科技大学林业生物技术实验室测试了利尿激肽Helicokinin I 和融合肽TAT-Helicokinin I 对舞毒蛾幼虫注射活性,比较二者经取食途径进入虫体后对舞毒蛾幼虫生长的影响,以期为今后深入研究利尿激肽Helicokinin I 在害虫治理中的应用提供参考。
1 材料与方法
1.1 试验材料 C 末端乙醛化的3 种多肽TAT、Helicokinin I 和 TAT-Helicokinin I 由上海生工生物工程有限公司合成,经高效液相色谱(HPLC)纯化后纯度达99%,氨基酸序列经质谱法(mass spectrometry)分析正确;TAT 多肽氨基酸编码序列为YGRKKRRQRRR,Helicokinin I 多肽氨基酸编码序列为YFSPWG,TAT-Helicokinin I 多肽氨基酸编码序列为YGRKKRRQRRRYFSPWG;舞毒蛾幼虫及其人工饲料由中国林业科学研究院森林生态环境与保护研究所昆虫病原微生物研究室提供。
1.2 3 种多肽对舞毒蛾幼虫注射活性测试 将TAT、Helicokinin I 和 TAT-Helicokinin I 多肽干粉分别溶于无菌超纯水中,每种多肽设置1.5,15,150 μmol/L 3 个浓度,多肽溶液现配现用。2016年7月,挑选生长一致的舞毒蛾3 龄末期幼虫,用微量注射器分别将配置好的多肽溶液缓慢注入幼虫体内。每头幼虫注射4 μL 多肽溶液,即每种多肽注射幼虫分别达到 6,60,600 pmol /头;对照组(CK)注射4 μL 无菌水。每个浓度处理试虫20 头,每个处理重复3 次。注射方法参照 Seinsche 等[1]略加改动,将4 μL 多肽水溶液或无菌水从虫体背面距尾部第3 至第4 对毛瘤之间缓慢注入。注射后将试虫放置于人工饲料上自由取食,试虫于培养箱中单头饲养,饲养温度设置26 ℃;每隔24 h 称量试虫体质量,并记录幼虫死亡数。
1.3 2 种多肽对舞毒蛾幼虫饲喂活性测试 将Helicokinin I 和 TAT-Helicokinin I 多肽干粉分别溶解于无菌超纯水中,分别将其配置成20,60 μmol/L 2种浓度,多肽溶液现配现用。2016年8月,吸取200 μL的多肽水溶液滴加在每瓶饲料表面,用涂布器涂抹均匀后自然晾干5 min 后备用;对照组(CK)每瓶饲料表面涂抹200 μL 无菌水,自然晾干5 min后备用。每瓶饲料放入1 头试虫,自由取食,试验共5 个组,每个处理20 头幼虫,每个处理重复3 次;每隔24 h 称量试虫体质量,并记录幼虫死亡数。
2 结果与分析
2.1 3 种多肽对舞毒蛾幼虫的注射活性 在注射无菌水后对照组试虫继续正常生长,注射TAT 后试虫生长亦不受影响,注射TAT-Helicokinin I 和Helicokinin I 对舞毒蛾幼虫均表现出注射毒性,且TATHelicokinin I 比Helicokinin I 表现出更高的生物活性。60,600 pmol/头剂量的 TAT-Helicokinin I 和Helicokinin I 对试虫均表现出致死性,试虫死亡发生在注射48 h 内,超过48 h 后死虫数量增加不明显,6 pmol/头的低剂量对试虫生长没有影响;注射600 pmol/头的融合肽TAT-Helicokinin I 后,舞毒蛾幼虫 24,48,72 h 的校正死亡率分别为 36.8%,57.9%,57.9%,而注射600 pmol/头的Helicokinin I肽后,舞毒蛾幼虫24,48,72 h 的校正死亡率分别仅为10.5%,15.8%,21.1%,其生物活性显著低于融合肽TAT-Helicokinin I(表1)。
2.2 2 种多肽对舞毒蛾幼虫的取食活性 饲喂Helicokinin I浓度为 20,60 μmol/L 的处理组舞毒蛾幼虫与对照组在体质量增长上无显著差异,而饲喂TAT-Helicokinin I 的处理组舞毒蛾幼虫体质量增长明显低于对照组。当 TAT-Helicokinin I 浓度为60 μmol/L时,对舞毒蛾幼虫生长表现出显著抑制作用,取食2 d后幼虫平均体质量为100.2 mg,显著低于对照组取食2 d 后平均体质量115.3 mg(图1)。

表1 3 种多肽不同剂量注射舞毒蛾幼虫的死亡率
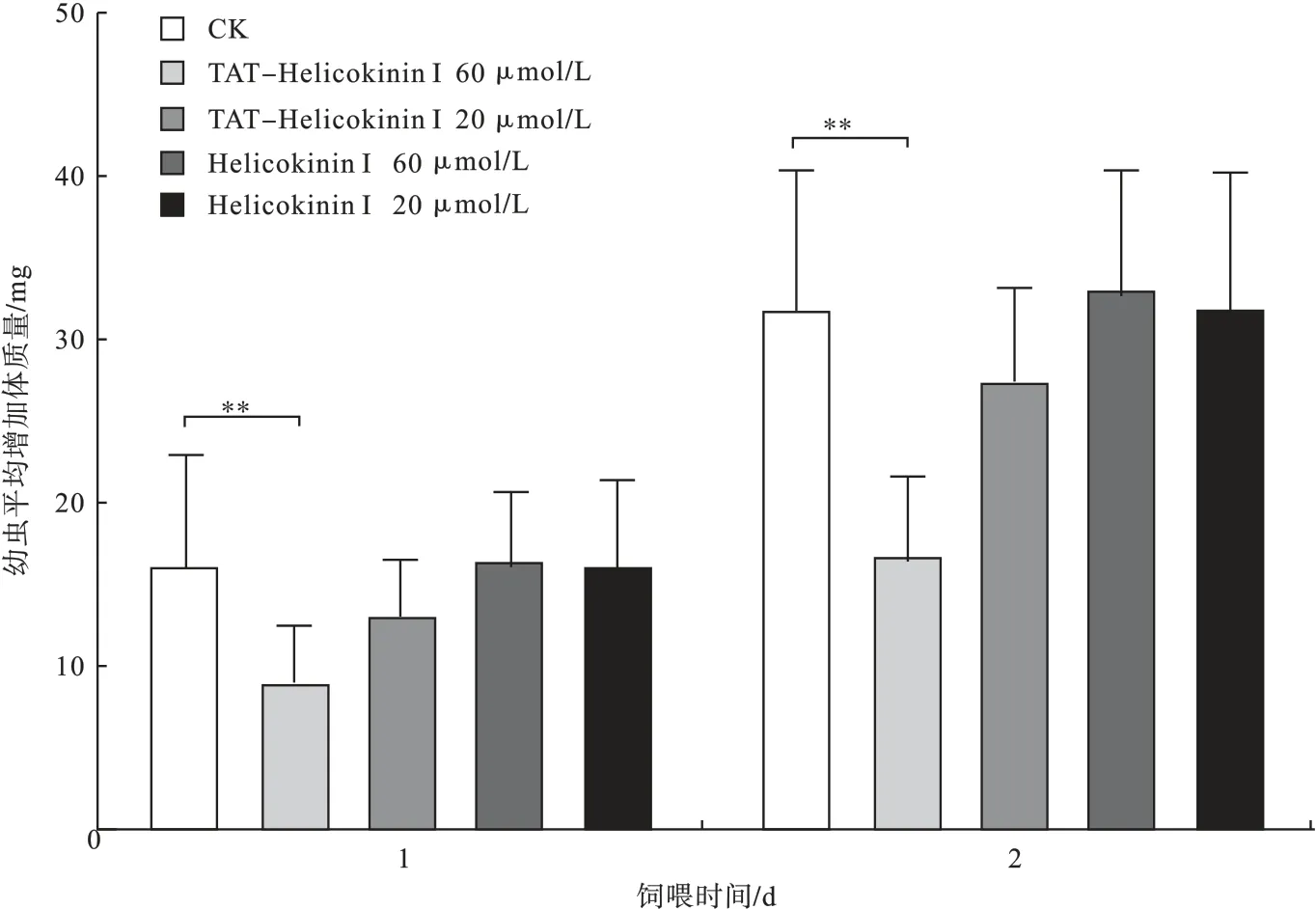
图1 2 种多肽不同浓度饲喂对舞毒蛾幼虫体质量增长的影响
3 讨论
已有研究表明,穿膜肽TAT 对细胞几乎没有毒性[5-6],本研究中注射TAT 对舞毒蛾幼虫没有毒性,进一步验证和证实了该结论。注射TAT-Helicokinin I 和Helicokinin I 则对舞毒蛾幼虫均表现出活性,且TAT-Helicokinin I 的生物活性更高,其原因可能源于TAT 高效跨膜转导,增加了融合肽TAT-Helicokinin I 的稳定性,从而对舞毒蛾幼虫表现出较高的致死效应。Seinsche 等[1]在烟芽夜蛾的研究中发现,幼虫体内注射50 pmol 的Helicokinin I 可表现出致死性,本研究中笔者亦发现该多肽60 pmol/头的剂量可对舞毒蛾幼虫表现出致死性,但6 pmol/头的剂量对试虫生长无影响。
利用幼虫注射的方法虽然能够证实利尿激肽Helicokinin I 对靶标害虫的生物活性,但该方法难以在害虫治理中应用。若能利用害虫的取食行为,使外源融合肽TAT-Helicokinin I 经消化道跨膜运输进入虫体而发挥生物活性,则不失为一种更可取的方法。本研究中的喂食试验显示,融合肽TAT-Helicokinin I 对舞毒蛾幼虫体质量增长产生显著抑制作用,而Helicokinin I 则不具有类似活性,进一步证明了融合肽TAT-Helicokinin I 的高效跨膜转导作用和稳定性。试验中饲喂浓度为60 μmol/L 的融合肽TAT-Helicokinin I 时,并未造成试虫死亡,其原因一方面可能是饲喂TAT-Helicokinin I 的量还比较低,另一方面也可能是因为TAT 与Helicokinin I 融合后仍存在部分被消化道酶降解的可能。因此,研发更加高效的细胞穿膜肽,或者在融合肽TAT-Helicokinin I 基础上进一步研究增加抑制消化酶的高效基因,将对促进利尿激肽在害虫治理中的应用具有重要作用。此外,尝试通过转基因技术,阐明融合肽TAT-Helicokinin I 在植物中的表达量和生物活性亦对该神经肽的应用具有积极意义。
本文作者对利尿激肽Helicokinin I 的生物活性进行测定,通过其与细胞穿膜肽TAT 有效融合后经昆虫取食途径应用于害虫防治的设想进行了初步探索,研究结果可为今后Helicokinin I 在害虫治理中的应用提供理论和实验参考,为其他昆虫小分子神经肽的在害虫治理中的应用研究提供借鉴和思考;研究中设计的氨基酸序列亦可为今后新型杀虫基因研究和应用提供依据。
