卡泊芬净对粪肠球菌生物膜形成能力影响的初步研究
2019-08-03林志伟徐广健陈俊文涂浩鹏李多云余治健邓启文郑金鑫
白 冰,林志伟,徐广健,孙 翔,陈俊文,涂浩鹏,李多云,余治健,邓启文,郑金鑫
(深圳大学附属深圳市南山区人民医院 深圳市内源性感染诊治研究重点实验室,广东 深圳 518052)
粪肠球菌(Enterococcusfaecalis)是导致泌尿道、血流、腹腔内、盆腔内,甚至中枢神经系统等感染的常见医院感染致病菌之一。研究[1-3]发现,粪肠球菌可以在输尿管支架、血管内导管、胆道支架、硅胶胃造瘘装置等表面形成生物膜。近年来研究[4-5]显示,本地区粪肠球菌生物膜阳性率超过80%,泌尿系统粪肠球菌生物膜形成尤其严重。在本单位临床诊疗过程中亦发现许多治疗困难的粪肠球菌感染病例,提示生物膜形成是导致粪肠球菌反复慢性感染的一个重要因素。目前,临床常用于粪肠球菌感染治疗的药物,如氨苄西林、万古霉素和利奈唑胺,对粪肠球菌生物膜感染治疗作用均不理想[6-8]。文献[9]报道,卡泊芬净对金黄色葡萄球生物膜具有较好的抑制效果。粪肠球菌生物膜形成比例更高,治疗难度更大,卡泊芬净在粪肠球菌生物膜形成中的作用尚未见报道。为了解卡泊芬净对粪肠球菌生物膜形成的作用,筛选来源于临床具有不同生物膜形成能力的菌株,初步探讨卡泊芬净对粪肠球菌生物膜形成的影响。
1 对象与方法
1.1 菌株来源 在本院前期工作基础上筛选生物膜强阳性粪肠球菌菌株(16C1)及不同生物膜形成能力的粪肠球菌菌株10株(16C289、16C67、16C83、16C106、16C173、16C25、16C56、16C205、16C8、16C51)[4-5],菌株均保存于深圳市南山区人民医院微生物室。
1.2 仪器与试剂 Phoenix100TM自动细菌鉴定/药敏系统(美国BD公司),酶标仪购自法国生物梅里埃公司,CTCA培养基购自青岛高科园海博生物技术有限公司,卡泊芬净购自MCE中国,结晶紫购自上海斯信科技有限公司,草酸铵购自海拓实验仪器有限公司。
1.3 细菌培养及鉴定 菌株均参照第3版《全国临床检验操作规程》,运用CATC肠球菌选择培养基进行细菌的分离培养,并采用美国BD Phoenix100TM自动细菌鉴定/药敏系统再次鉴定。
1.4 检测卡泊芬净对粪肠球菌浮游菌生长作用的影响 通过酶标仪测定600 nm波长吸光度(OD 600 nm)吸光值,以检测培养上清液中浮游菌含量。
1.5 粪肠球菌生物膜量的检测 按照参考文献方法[10],通过体外96孔板法构建粪肠球菌生物膜感染模型,采用结晶紫染色法检测生物膜量的变化,重复3次,每次设3个复孔,取平均值为最终检测结果。操作步骤简述如下:将粪肠球菌株接种于TSB培养基,振摇过夜,用TSBG培养基(TSB含0.25%葡萄糖)1∶200稀释后加入96孔培养板(Costar3599板,200 μL/孔),加入含不同药物的新鲜TSBG培养基(同时设卡泊芬净干预组和对照组,干预组加卡泊芬净,浓度为20 μmol/L,对照组加生理盐水),37 ℃静置分别培养24、48和72 h后,分离培养上清,PBS洗培养板3次,1%的结晶紫染色20 min,ddH2O缓慢冲洗去掉未结合结晶紫,通过酶标仪OD570吸光值检测生物膜的量,比较生物膜变化情况,同时通过酶标仪OD600吸光值检测浮游菌含量,对培养上清液中的浮游菌生长进行比较。
1.6 统计分析 应用SPSS 19.0软件进行统计分析,计量资料以均数±标准差表示,两组计量资料的差别比较采用t检验,计数资料差别比较采用χ2检验,P≤0.05为差异有统计学意义。
2 结果
2.1 粪肠球菌菌株信息 纳入粪肠球菌11株,均为临床分离菌株,其中5株分离自尿(16C289、16C25、16C56、16C8、16C51),2株分离自伤口分泌物(16C67、16C205),其余4株分别分离自血(16C106)、胸腔积液(16C1)、胆汁(16C173)和痰(16C83)。
2.2 卡泊芬净对生物膜强阳性粪肠球菌(16C1)生物膜形成的影响 选择1株生物膜强阳性临床菌株(16C1)作为实验标准株,同时设卡泊芬净干预组和对照组,干预组加卡泊芬净,浓度为20 μmol/L,对照组加生理盐水。浮游菌抑制实验结果提示,卡泊芬净对16C1菌株的浮游菌生长无明显影响(图1A),对16C1菌株的生物膜形成有抑制作用(图1B、C)。
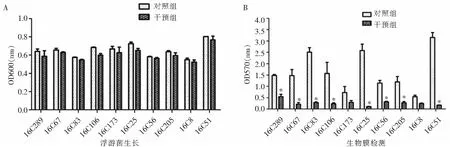
2.3 卡泊芬净对10株生物膜阳性的粪肠球菌生物膜形成的影响 为进一步证实卡泊芬净对粪肠生物膜形成能力的作用,收集来源于临床生物膜形成能力不同的10株粪肠球菌,研究卡泊芬净对粪肠球菌生物膜形成和浮游菌生长的影响,结果显示,卡泊芬净对10株粪肠球菌临床株的浮游菌生长无明显影响(见图2A),但可明显抑制菌株形成生物膜(见图2B和图3)。

A:通过酶标仪OD600 吸光值检测培养上清液中的浮游菌生长情况,卡泊芬净对菌株生长无影响;B:采用结晶紫染色法,通过酶标仪OD570 吸光值,比较生物膜变化情况,结果显示,卡泊芬净对菌株形成的强阳性生物膜有显著的抑制作用;*: 卡泊芬净干预组 vs 对照组,P<0.05(student’s t检验);C:生物膜结晶紫染色的原始结果,结晶紫染色越深表示生物膜越强
图1 卡泊芬净对粪肠球菌16C1株浮游菌生长及生物膜形成的影响
Figure 1 Effect of caspofungin on growth of planktonic and biofilm bacteria ofE.faecalis16C1 strain
A:通过酶标仪测OD600 吸光值,检测培养上清液中的浮游菌生长情况,卡泊芬净对菌株生长无影响;B:采用结晶紫染色法,通过酶标仪测OD570 吸光值比较生物膜的量,结果显示卡泊芬净对菌株形成生物膜有明显的抑制作用; *: 干预组 vs 对照组,P<0.05(student’s t检验)
图2 卡泊芬净对10株粪肠球菌临床株浮游菌生长及生物膜形成的影响
Figure 2 Effect of caspofungin on growth of planktonic and biofilm bacteria of 10 clinicalE.faecalisstrains

每株菌设3个复孔,a、c、e、g为对照组,b、d、f、h为卡泊芬净干预组;a1~a3、b1~b3为16C289株,a4~a6、b4~b6为16C173株,a7~a9、b7~b9为16C8株,c1~c3、d1~d3为16C67株,c4~c6、d4~d6为16C25株,c7~c9、d7~d9为16C51株,e1~e3、f1~f3为16C83株,e4~e6、f4~f6为16C56株,g1~g3、h1~h3为16C106株,g4~g6、h4~h6为16C205株; 生物膜结晶紫染色越深,表示生物膜越强
图3 采用结晶紫染色法检测10株粪肠球菌临床株生物膜量的变化
Figure 3 Detection of biofilm quantity of 10 clinicalE.faecalisstrains by crystal violet staining
3 讨论
细菌生物膜通常由多糖、蛋白质和核酸组成,将细菌包裹在内。生物膜中细菌常处于休眠状态,抗菌药物往往难以穿透作用于细菌,导致临床常用抗菌药物对生物膜治疗效果普遍较差[11]。临床常用于抗粪肠球菌感染治疗的药物,如氨苄西林、万古霉素和利奈唑胺等均对清除粪肠球菌生物膜效果不理想,探寻生物膜治疗有效药物和策略仍然是临床面临的难点问题之一[12]。目前,针对粪肠球菌生物膜的治疗可供选择的方案主要集中在以下方向:(1)以磷霉素为基础联合其他药物,特别是联合利福平,治疗肠球菌生物膜感染可有一定疗效,但仅有部分清除生物膜效果,而且对强阳性生物膜仍无明显清除效果[13-14]。(2)以达托霉素或利奈唑胺为基础,联合利福平或庆大霉素可对部分菌株形成的生物膜感染有一定治疗作用,但对较强生物膜感染仍无法取得满意疗效[15]。
卡泊芬净是一种新型多肽类抗真菌药,作用靶点为真菌细胞壁。卡泊芬净通过非竞争性抑制β-(1,3)-D-葡聚糖合成酶阻止真菌细胞壁的β-(1,3)-D-葡聚糖合成, 破坏真菌细胞壁的结构完整性,导致细胞破裂、溶解, 起到抗真菌的作用。卡泊芬净由于安全性高,不良反应较少,目前,已被广泛用于侵袭性真菌感染的治疗,对假丝酵母菌和曲霉菌感染均具有良好的疗效,同时研究证实其对真菌尤其是假丝酵母菌生物膜形成具有较好的抑制作用[16]。在白假丝酵母菌形成生物膜的动态过程中,卡泊芬净可以抑制生物膜的形成,并显著减少生物膜的弥散,因此,卡泊芬净在抗真菌感染同时具有明显的抗白假丝酵母菌生物膜的作用[17-18]。另有研究发现,卡泊芬净对光滑假丝酵母菌、克柔假丝酵母菌和近平滑假丝酵母菌形成的生物膜也有治疗作用。若将卡泊芬净与其他药物或化合物联合使用还有协同抗白假丝酵母菌生物膜的作用,卡泊芬净与植物防卫素HsAFP1存在明显的协同抗生物膜作用[19-20]。
深入研究发现卡泊芬净可以抑制和清除细菌生物膜。在金黄色葡萄球菌生物膜形成过程中,卡泊芬净主要通过抑制金黄色葡萄球菌膜定位N-乙酰基葡糖胺转移酶活性,抑制生物膜重要组分胞外多糖的生成,破坏生物膜结构,穿透性升高,进而显著增强莫西沙星和德拉沙星对生物膜中细菌的杀菌效果[9]。金黄色葡萄球菌中膜定位N-乙酰基葡糖胺转移酶由icaA基因编码。分析BLAST、DNAMAN等生物信息,对比金黄色葡萄球菌icaA基因序列(Genebank:NC_002662.1)与粪肠球菌OG1RF全基因序列 (Genebank:GCA_000172575.2),发现粪肠球菌中并不具有icaA基因,意味着卡泊芬净对粪肠球菌生物膜的抑制与金黄色葡萄球菌有不同的机制,因此卡泊芬净通过何种具体机制影响粪肠球菌生物膜的抑制作用仍有待进一步研究。
