聚焦高考中的电化学解题策略
2019-08-02滕明俊
滕明俊


摘要:电化学知识原理抽象,是学生在学习过程中的难点也是高考考查的重点.本文选取历年高考中的典型例题进行详细剖析和梳理,以期帮助学生形成正确的解题策略,达到解一题知一类题的目的.
关键词:电化学;高考;解题策略
电化学是高考中重点考查的内容,所涉及的知识点与日常生活、环境保护等方面密切相关,重点考查学生对基本知识的掌握与问题解决的能力,在注重核心素养培养的教育改革背景下备受出题者的青睐.
1 把握电极反应式,解决探究问题
例1 北京市高考化学试卷
用零价铁( Fe)去除水体中的硝酸盐(N03-)已成为环境修复研究的热点之一.
(1) Fe还原水体中N03-的反应原理如图1所示.
①作负极的物质是____
②正极的电极反应式是
.
(2)将足量铁粉投入水体中,经24小时测定N03-的去除率和pH,结果如表1所示:
pH =4.5时,N03-的去除率低.其原因是____.
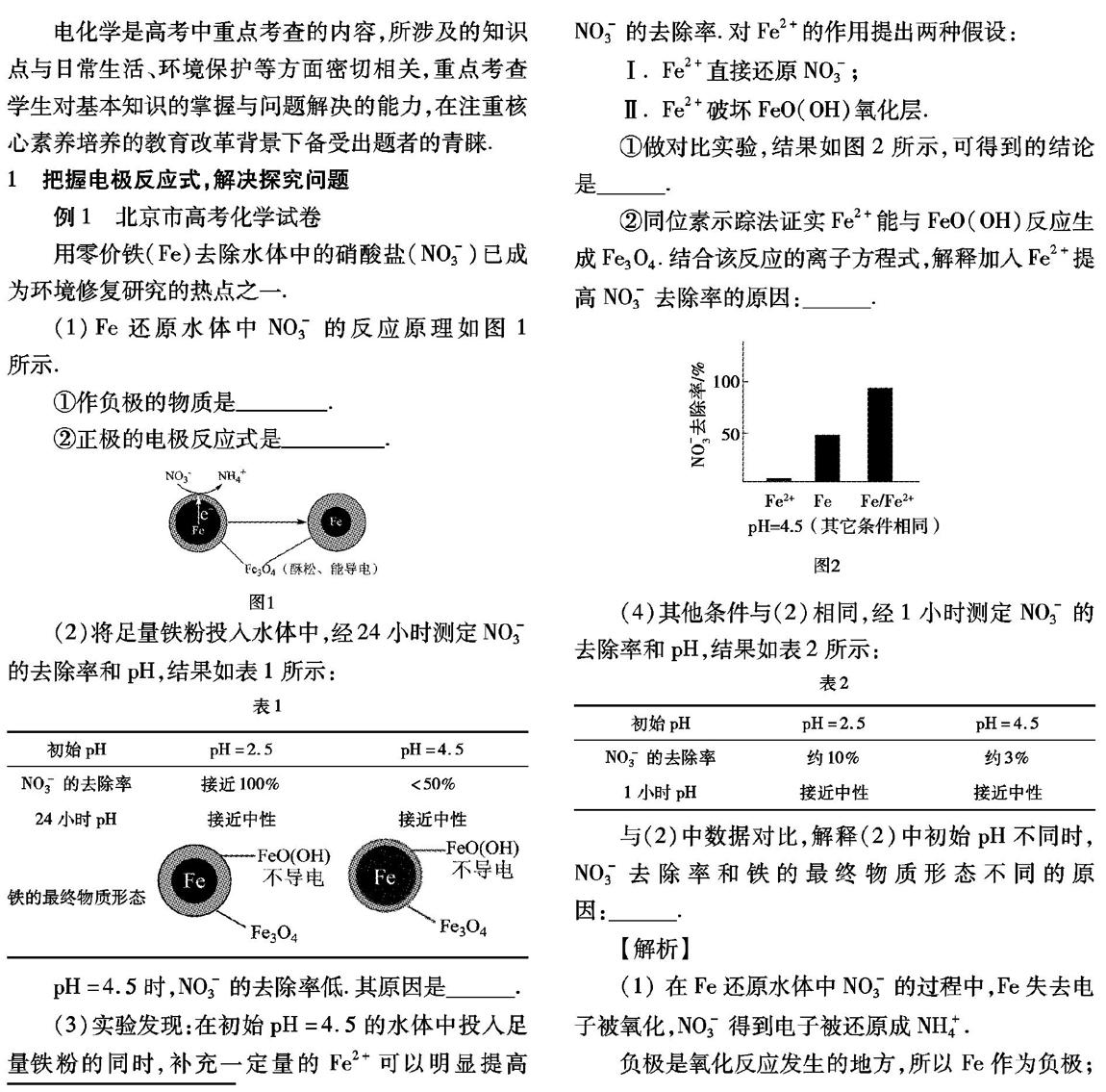
(3)实验发现:在初始pH =4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高N03-的去除率,对Fe2+的作用提出两种假设:
I.Fe2+直接还原N03-;
Ⅱ.Fe2+破坏Fe0( OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是____.
②同位素示踪法证实Fe2+能与Fe0( OH)反应生成Fe304.结合该反应的离子方程式,解释加入Fe2+提高N03-去除率的原因:____.
(4)其他条件与(2)相同,经1小时测定N03-的去除率和pH,结果如表2所示:
与(2)中数据对比,解释(2)中初始pH不同时,N03-去除率和铁的最终物质形态不同的原因:____.
【解析】
(1)在Fe还原水体中N03-的过程中,Fe失去电子被氧化,N03-得到电子被还原成NH4+.
负极是氧化反应发生的地方,所以Fe作为负极;正极涉及的物质变化为:N03→NH4+
N的化合价从+5变成-3,需要得到8个电子,同时反应式左边氢的个数少,需要H+/H20对来保持原子守恒和电荷守恒,反应式如下:N03-+ 8e-+IOH+= NH4+ +3H2O
(2)比较pH=2.5和4.5条件下的铁的最终物质形态,发现在pH =4.5的条件下,Fe的表面形成了一层不导电的Fe0( OH)膜.因为反应的发生需要离子的移动,所以Fe0( OH)膜限制离子移动,不能导电,所以阻止了反应的进一步发生.而酥松的Fe3 04中有空隙,能保证离子的移动,从而能使反应得以进行.
(3)①通过对比实验,单纯的Fe2+和单纯的Fe粉还原N03-的效率并不高,而Fe粉与Fe2+的结合效率最高.
同时,“Fe2+直接还原N03-”的假设I不成立,是因为如果该假设成立,用Fe2+还原和用Fe/Fe2+还原的效率应该一样,而实验事实证明不是如此.
假设Ⅱ,根据已有条件难以直接判定.
②Fe2+和Fe0( OH)发生非氧化还原反应生成Fe3 04和H+,反应式如下:Fe2++ 2Fe0( OH)一Fe304 +2H+,Fe2+将不导电的Fe0( OH)转化为可导电的Fe304,有利于反应的进行,使N03-的去除率提高.
(4)在反应进行1小时左右,pH接近中性,说明H+基本已经反应完全,Fe转化为Fe2+.反应式如下:Fe +2H+= Fe2++ H2↑,这时候两种情况下的反应进行程度并不高,说明这一步并不是反应的关键.之后进行的反应:Fez+和Fe0( OH)反应生成Fe304才是关键,pH =2.5情况下,氢离子浓度高,产生的Fe2+浓度大,促使Fe0( OH)转化为酥松、可导电的Fe3 04,使反应进行的更完全,而初始pH =4.5时,产生的Fe2+浓度小,从而造成N03-去除率和铁的最终物质形态不同.
【题后反思与点评】
面对有关电化学的题目,关键要明确负极(氧化反应)和正极(还原反应)所发生的反应,然后书写电极方程式,对涉及到水溶液的反应,利用H+/H2O,OH -/H2O对来配平并注意电荷守恒,
另外,影响电极反应的因素复杂,要借助电极反应式来帮助判断,如本题的(2)一(4)问,如果能准确地把握好(1)的电极反应式N03-+ 8e-+IOH+=NH4+ +3H2O这样一个大前提,然后根據题干讨论H+对反应效率的影响,(2)一(4)的问题就能迎刃而解.
2 整合挖掘隐性信息,综合多方面信息判断
例2天津市高考化学试卷(节选)
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节.回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是____(至少答出两点).但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____.
(2)化工生产的副产氢也是氢气的来源.电解法制取有广泛用途的Na2 Fe04,同时获得氢气:Fe+2H2O +20H通电Feo4-+3H2↑,工作原理如图3所示.装置通电后,铁电极附近生成紫红色的Fe04 -,镍电极有气泡产生.若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质.已知:Na2 Fe04只在强碱性条件下稳定,易被H:还原.
①电解一段时间后,c(OH-)降低的区域在____(填“阴极室”或“阳极室”).
②电解过程中,须将阴极产生的气体及时排出,其原因是____.
③c( Na2Fe04)随初始c(NaOH)的变化如图4,任选M、N两点中的一点,分析c( Na2Fe04)低于最高值的原因:______.
【解析】
(1)氢气燃烧的产物是水;原料来源广泛,可通过多种方式获得,资源丰富;相同质量的情况下,氢的燃烧能大于汽油,而汽油燃烧的产物是二氧化碳和水,汽油主要来自于石油的冶炼,资源不可再生.
(2)①通电后,铁电极(阳极)附近生成紫红色的Fe04 -,镍电极(阴极)有气泡产生,阳极Fe被氧化为Fe04 -,阴极H2O被还原为H2产生气泡.
发生反应的条件为碱性条件,所以在配平半反应方程式时要用OH -/H20对来达到原子守恒.阳极发生Fe - 6e →Fe02 -,方程式左边氧原子少,用OH -(一个H带一个O);方程式右边氧原子多,所以右边用H2O(一个H带0.5个O).
阳极反应如下:Fe - 6e-+ 80H-=Fe04-+4H20
阴极发生H2O +2e →H2,方程式右边氧原子少,用OH -;方程式左边氧原子多,用H2O,
阴极反应如下:2H20 +2e-= H2↑+20H-
可以看到,随着电解时间的延长,阳极室的c(OH-)会下降.
②因为阴阳两极在同一个电解槽中,阳极产生的Na2Fe04具有氧化性,被阴极产生的H。所还原,所以须将阴极产生的气体及时排出,防止产率降低,
③在图4中,c( Na2Fe04)存在一个极大点,说明c(OH -)存在一个条件最优的情况:
在M点时,c(OH-)过低,因Na2Fe04只在强碱性条件下稳定,所以产生的Na2 Fe04容易分解,且离子浓度低,反应慢.
在N点时,c(OH -)过高,铁电极区会生成红褐色的副产物Fe( OH)3.降低反应效率.
【题后反思与点评】
电解池和原电池从氧化还原的角度来看是统一的,但是略有不同:氧化反应发生在电解池的阳极和原电池的负极,还原反应发生在电解池的阴极和原电池的正极,
电极反应产物的稳定性和具体的电解条件选用要综合考虑各种因素:电极材料,电解液的浓度,酸碱度等等,题于中往往包含了大量的隐性信息,要注意挖掘和整合,如本题中的Na2 Fe04的稳定性和氢氧化钠的浓度控制等等,都是理解反应本质、解决问题的关键.
3 化学计量与氧化还原反应融合
例3浙江高考化学试卷
金属(M) -空气电池(如图5)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源.该类电池放电的总反应方程式为:4M+ nO2+2nH20=4M(OH)n.已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg、Al、Zn三种金属一空气电池,Al -空气电池的理论比能量最高
C.M -空气电池放电过程的正极反应式:4Mn++n02+2nH20 +4ne-=4M( OH)。
D.在M-空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
【解析】
A选项,该电极反应涉及到两相反应,02与电极不易接触反应,所以需要提高接触面积,而多孔电极是一种可行的办法,同时也能够提高电极和电解质溶液的接触面积.正确.
B选项,金属(Mg、Al、Zn)所形成的金属离子如下:Mg2+、A13+、2n2+,单位质量的金属( Mg.AI、Zn)所释放出来的电能比如下:2/24:3/27:2/65=2.7:3.6:1.0,所以Al -空气电池的理论比能量最高.正确
C选项,正极发生的是还原反应:02被还原为OH -,反应式如下:02+2H20+4e=-40H-
在正极中没有金属离子产生,所以Mn+是不存在的.C选项错误.
D选项,在碱性条件下负极附近Mn+会与OH -反应生成M( OH)。沉积,所以要在中性条件下进行,同时利用阳离子交换膜通过阳离子交换,降低电极附近的金属离子的浓度.
【题后反思与点评】
本题B选项中,将化学计量的内容和电池知识相融合,涉及物质的量的计算和不同金属的性质,体现了多章节知识的融合.
4 信息学习迁移.提升到类
例4理综(江苏卷)化学试题
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.
(1)铁炭混合物在水溶液中可形成许多微电池.将含有Cr207-的酸性废水通过铁炭混合物,在微电池正极上Cr2O7-转化为Cr3+,其电极反应式为____.
(2)在相同條件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2和Pb2+的去除率,结果如图6所示.
①当铁炭混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是一
.
②当铁炭混合物中铁的质量分数大于500-/0时,随着铁的质量分数的增加Cu2+和Pb2+的去除率不升反降,其主要原因是
(3)纳米铁粉可用于处理地下水中的污染物.
①一定条件下,向FeS04溶液中滴加碱性NaBH4溶液,溶液中BH4-(B元素的化合价为+3)与Fe2+反应生成纳米铁粉、H2和B( OH)4-,其离子方程式为____.
②纳米铁粉与水中N03-反应的离子方程式为:
4Fe+ N03-+ 1OH+= 4Fe2++ NH4- +3 H20
研究发现,若pH偏低将会导致N03-的去除率下降,其原因是____.
③相同条件下,纳米铁粉去除不同水样中N03-的速率有较大差异(见图7),产生该差异的可能原因是
.
【解析】
(1)正极上Cr207-得到电子变成Cr3+: Cr207'+6e -一Cr3+,因为是酸性条件下,所以用H+/H20达到原子守恒.方程式右边氧原子少,所以用H2O;方程式左边氧原子多,用H+.结合电荷守恒,电极反应式如下:Cr207-+ 14H++ 6e=2Cr3++ 7H2O
(2)①混合物中没有Fe存在,原电池反应不发生.但是活性炭具有较大比表面积,吸附能力强,能够吸附Cr12和Pb2+,除去部分污染物.②铁的质量分数增加微电池数目减小.
(3)①反应物包含Fe2+和BH4-,产物为Fe,H2和B( OH)4-,即Fe2++ BH4→Fe+H2↑+B(OH)4
因为是在碱性条件下进行,且方程式左边氧原子少,所以左边加上OH-,根据得失电子守恒,配平得到:2Fe2++ BH4-+ 40H-=2Fe+2H2↑+B( OH)4②pH过低,H+浓度过高,纳米Fe粉会和H+发生副反应:Fe+2H+= Fe2++ H2↑,使N03-消除率降低
③图7中显示加了Cu2+的水样,N03-的反应速率加快.Fe活泼性高于Cu,能置换出Cu单质,Fe -Cu能够形成原电池,加快反应速率,以上原理和题干(1)中铁一碳原电池的原理类似.
【题后反思与点评】
本题主要考查了信息迁移的能力:在(1)(2)给出“铁一炭”微电池的信息后,在(3)中给出新的情境,考察答题者是否将知识迁移到“铁一铜”微电池中,该信息点也和教材中金属的保护等知识点紧密链接起来,不仅仅是解决一个问题,而且是解决了一种类型的问题,强调了知识的可应用性和社会价值.
(收稿日期:2019 - 03 - 05).
