高通量基因测序调查尿道下裂患者雄激素作用相关基因甲基化研究
2019-08-02刘毅东叶惟靖黄翼然
刘毅东 吴 旻 叶惟靖 黄翼然
上海交通大学医学院附属仁济医院泌尿外科(上海 200127)
尿道下裂发病率约1/300,并且呈逐年增长的趋势[1-3],目前众多国内外对于尿道下裂的发病原因进行了深入的研究,但是均未得出一个明确结论。目前热门的流行病学和实验室调查将尿道下裂发病病因指向表观遗传学方向[4],其中由于胚胎在8~14周尿道形成的关键时期[5,6],可能会受到内源性或者外源性因素的影响,通过改变雄激素基因表达表观遗传编程作用途径,影响胎儿雄激素对胎儿的作用,从而影响了正常阴茎及尿道的发育过程。这引起我们对尿道下裂患者发病原因进行探究。查阅文献我们发现国外有学者研究发现部分相关基因甲基化在尿道下裂患者组织中高表达,并提出基因甲基化可能是尿道下裂的发病机制。我们对于我们人群中尿道下裂与甲基化关系的研究甚少,为了验证这条途径是否对尿道下裂患者发病机制产生影响,我们对123例患者包皮内板组织进行雄激素相关基因甲基化定量检测,为尿道下裂后续基因治疗提供部分基础。
资料和方法
一、临床资料
收集自2012年到2015年于我院接受手术的患者123名,其中包括实验组尿道下裂修补术患者包皮内板96 例,年龄从 3.5~8 岁。 平均年龄(5.0±1.5)岁,又根据患者术前尿道开口的位置,将尿道下裂患者分为轻中度和重度组。轻中度组定义为尿道开口于冠状沟及阴茎体中段;重度组定义为尿道口开口于阴茎体近端及会阴部。其中轻中度组患者55例,重度组患者41例,对照组为在我院行包皮环切的患者包皮内板27例,年龄从 3.7~7.5 岁,平均(5.0±0.8)岁,术前均确定有正常的尿道开口,阴茎及尿道发育正常。所有患者均排除其他生殖器疾病、隐睾、染色体异常及内分泌功能缺陷,术前基因检查排除AR基因及SRD5A2基因突变情况,术前均未接受激素治疗。
二、实验方法
(一)对组织提取样本的要求
1.样品类型:基因组DNA,溶解在H2O或TE(pH 8.0)中。样品纯度:OD 260/280值应在1.8~2.0之间,无明显降解与蛋白污染。提取的DNA样本浓度:最低浓度不低于20ng/μL。
2.样品总量:每个样品总量1μg,满足200个目的片段测序。
(二)试剂耗材
TruSeq DNA样品制备试刘盒;EpiTect亚硫酸氢盐试刘盒;TruSeq PE簇生成试剂盒;TruSeq测序试剂盒;QIAquick PCR纯化试刘盒;QIAquick凝胶提取试剂盒;NEBNext脱氧核糖核酸片段化酶。
(三)实验仪器
AB 2720热循环仪;Xiang Yi H1650-W离心机;涡旋仪;凝胶电泳;NanoDrop定量仪;Ambion磁性支架;Invitrogen Obit分光光度计;Illumina cbot簇生成支架;Illumina基因组分析仪IIX。
(四)引物的设计
根据患者AR基因及SRD5A2基因设计的引物见表 1、表 2

表1 AR基因设计引物

表2 SRD5A2基因设计引物
(五)实验步骤
1.亚硫酸氢盐处理:使用EpiTect Bisulfite Kit进行样本处理。
2.样本目标片段多重PCR反应:使用以下PCR条件:A 20μL混合溶液其中包括:1×反应缓冲液(TAKARA),2mmoL Mg2+,0.2mmoL dNTP,0.1μMoL引物,1 U HotStarTaq聚合酶 (TAKARA)and 2μL模板DNA。PCR循环条件:预热阶段:95℃,2min;循环阶段:94℃,20 s,11 个循环;63℃每个循环 40 s;72℃ 1min;94℃,20 s,24 个循环;65℃,30 s; 72℃, 1 mins。 延伸阶段:72℃,2 min。
3.相同样本的多重PCR反应体系混合。
4.样本添加特异性标签序列:使用以下PCR条件:20μL 混合溶液,包括 1×反应缓冲液(NEB Q5TM),0.3 mmoL dNTP,0.25μmoL 引物,0.25μmoL 索引引物,1 U Q5TM DNA聚合酶(NEB)和1μL稀释模板,循环再98℃,30s;11 个循环 98℃, 10 s;65℃,30 s;72℃,30 s;72℃,5 min。
5.定量后应用高通量Illumina Genome Analyzer IIx上机测序。
结 果
实验组96例,对照组27例的AR基因及SRD5A2基因甲基化个体水平的结果见表3。AR基因CpG岛共测得46个甲基化位点,整体水平下AR基因甲基化在实验组与对照组间无统计学差异,均值0.112±0.051 vs 0.107±0.019,P>0.05(图 1)。 SRD5A2 基因 CpG岛共测得25个甲基化位点,整体水平下SRD5A2基因甲基化在实验组与对照组间存在统计学差异,均值0.044±0.008 vs 0.039±0.006,P<0.05(图 2,图 3)。
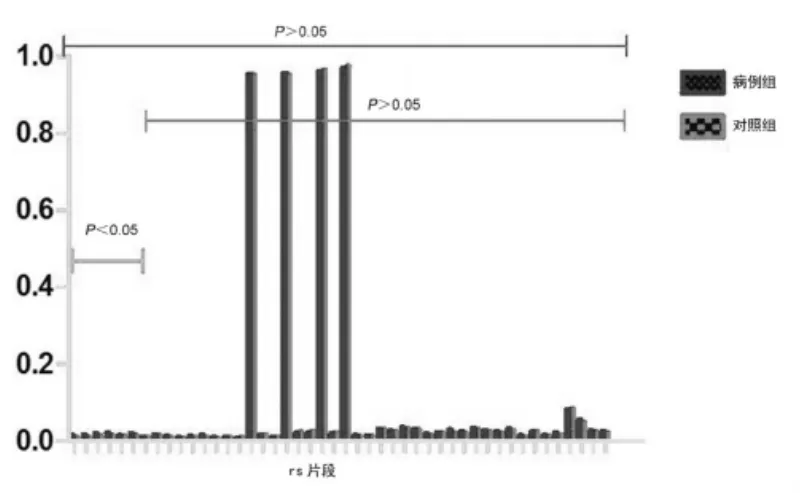
图1 AR基因CpG岛在46个不同的rs片段中实验组与对照组差异性研究(96 vs 27,46个位点,总体P>0.05)
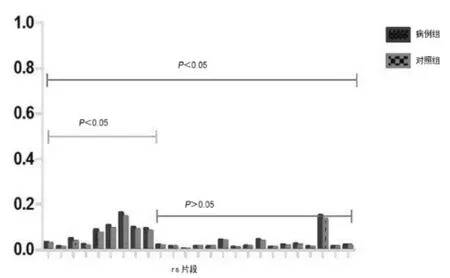
图2 SRD5A2基因CpG岛在25个不同的rs片段中实验组与对照组差异性研究(96vs27,25个位点,总体P<0.05)
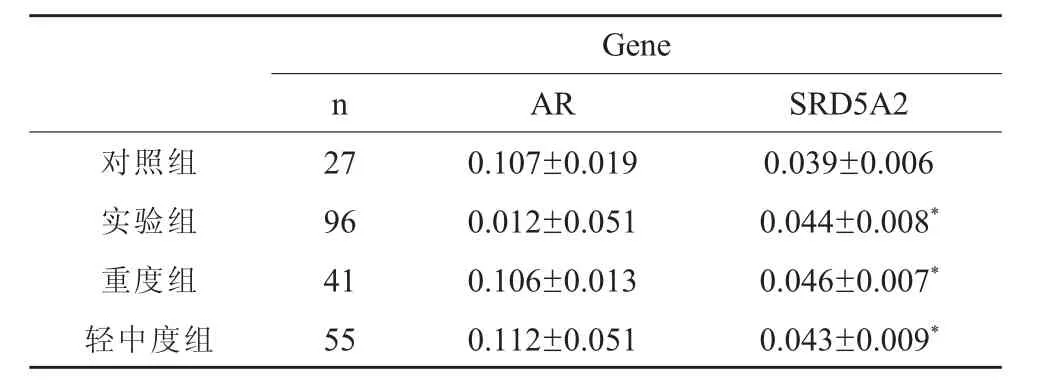
表3 AR基因及SRD5A2基因甲基化个体水平研究(x±s)
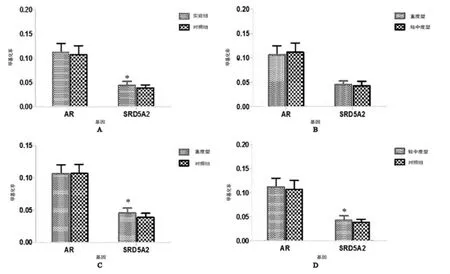
图3 AR基因及SRD5A2基因甲基化亚组水平研究
讨 论
胚胎在8~14周尿道形成的关键时期[5,6],患者受到内源性或者外源性因素的影响,改变雄激素基因表达表观遗传编程作用途径,影响了正常阴茎及尿道的发育过程。雄激素作用相关过程:睾酮(T)在SRD5A2的作用下生成双氢睾酮(DHT),DHT作用于AR,影响男性生殖器的发育过程[7]。其中任意一个环节出现问题,将会影响到男性生殖器的正常发育,最终可能成为尿道下裂发病的重要原因之一。Wang等曾报道SRD5A2基因突变在中国人群尿道下裂的一个重要的发病因素,AR基因突变并没有在尿道下裂中出现[8]。Akcay等人也同样报道了在雄激素不敏感的患者中出现SRD5A2基因突变,未发现AR基因突变现象[9]。纵观国内外对于这一方面的研究,表观遗传学的研究是近来一大热门[10,11],尤其是肿瘤领域[12-14]。但是我们发现对于尿道下裂疾病发生与雄激素相关基因甲基化的研究少有报道。Vottero等[15]在高加索人人群20例尿道下裂患儿的包皮组织中找到了表观遗传学异常的证据。其研究结果表明尿道下裂实验组的包皮组织AR基因甲基化的程度明显高于正常对照组的包皮组织。以上研究提示,雄激素作用相关基因的表观遗传学改变,影响基因的表达过程。近年来,随着技术的发展,高通量的DNA甲基化检测技术随之出现,Choudhry等第一次使用高通量甲基化分析检测了12名尿道下裂患者与8名对照组CpG位点甲基化差异性[16],这一作用机制在我们的尿道下裂患者中是否也是如此或者影响到什么程度,引起我们的兴趣。
AR基因及SRD5A2基因正常表达在雄激素作用途径中起着至关重要的作用,任何一方表达受到抑制,均会影响其正常的发挥作用[17]。这给我们启示是:对于非基因突变的尿道下裂患者是否存在甲基化情况。于是针对AR基因及SRD5A2基因附近区域CpG岛甲基化定量检测进入我们的课题。
我们的实验对AR基因及SRD5A2基因附近区域CpG岛进行深度、高准确度检测。实验结果表明:基因水平下实验组与对照组间AR基因甲基化无统计学差异。部分RS位点尽管存在统计学上的差异,但是其甲基化率过低,所以实验组与对照组在AR基因CpG岛甲基化程度并不考虑其差异性;同样,SRD5A2基因甲基化在实验组与对照组间数据上存在统计学差异(P<0.05),但是考虑其甲基化均值太低,亦不考虑其甲基化的差异性。两者在轻中度组、重度组同样甲基化程度呈现极低状态,亦不考虑其甲基化存在区别。这说明在我们的患者当中尿道下裂疾病发生发展及其严重程度可能与雄激素作用相关基因AR基因、SRD5A2基因CpG岛甲基化程度关联性较小。这与Vottero[15]等报道的高加索人人群AR基因甲基化结果存在差异。该结果表明在我们人群中可能存在尿道下裂患者的发病机理不同于高加索人人群。中国幅员辽阔,环境习性差异大,或许还需要多中心大样本合作检验。本文不足之处是未解释尿道下裂的发病机制,今后需要在蛋白水平上进一步研究。
结 论
在我们的患者中雄激素相关基因AR及SRD5A2基因CpG岛甲基化抑制了雄激素发挥作用这条途径,可能并不是尿道下裂发病的主要机制。
