基于全肿瘤ADC图纹理特征诊断脑胶质瘤分级
2019-08-01梅东东龚静山彭全洲成志强
梅东东,罗 燕,龚静山*,彭全洲,成志强
(1.暨南大学附属第二临床医学院 深圳市人民医院放射科,2.病理科,广东 深圳 518020)
胶质瘤是颅内最常见的原发恶性肿瘤,具有侵袭性及较高异质性,预后差[1]。早期、分级诊断脑胶质瘤对选择治疗方案及判断预后有重要作用。WHO将胶质瘤分为Ⅰ~Ⅳ级[2],其中Ⅰ、Ⅱ级为低级别胶质瘤(low grade glioma, LGG),Ⅲ、Ⅳ级为高级别胶质瘤(high grade glioma, HGG)。由于胶质瘤异质性较高,组织病理学检查、特别是活检获得的组织标本存在取样误差。MRI是脑胶质瘤的首选检查方法,具有无创、软组织分辨率高且可进行功能成像的优点,已越来越多地应用于脑胶质瘤分级;但不同级别脑胶质瘤间影像学表现重叠较多,仅靠传统的图像分析方式难以对胶质瘤进行准确分级。近年来,随着计算机科学的发展,从影像大数据中高通量提取大量、肉眼无法捕捉的图像高级信息,并通过分析这些信息用于诊断疾病和建立预测模型,即放射组学,已成为具有广阔应用前景的技术手段,更有望成为医学影像学与精准医疗间的桥梁[3]。ADC值是DWI的定量参数,可用于分级诊断胶质瘤,但存在较大争议,原因可能是单纯ADC平均值和直方图难以反映肿瘤异质性[1,4]。纹理特征分析可通过分析图像像素或体素灰度值分布和相关性来定量评价肿瘤的异质性[5]。本研究采用放射组学软件高通量提取脑胶质瘤全肿瘤ADC图的纹理特征,分析纹理特征与胶质瘤级别的相关性,旨在为临床在体分级诊断胶质瘤提供影像学生物标记,以协助制定和实施个性化治疗方案。
1 资料与方法
1.1 一般资料 收集2010年1月—2018年6月我院经病理证实的66例脑胶质瘤患者,男38例,女28例,年龄18~72岁,平均(42.7±14.0)岁。纳入标准:①术前1个月内接受MR扫描,且扫描序列齐全;②未接受放化疗;③病理诊断为脑胶质瘤,且有分级结果。排除标准:①患者年龄<18岁;②图像质量差,达不到后处理要求;③所有序列图像均无法明确肿瘤边界。66例中,WHOⅡ级25例(LGG组);Ⅲ、Ⅳ级分别15例、26例(HGG组,n=41),无Ⅰ级者。
1.2 仪器与方法 采用Siemens Magnetom Skyra 3.0T和Magnetom Avanto 1.5T MR系统,20通道、8通道相控阵头颅线圈。平扫序列包括脂肪抑制快速梯度回波序列T1W,TR 500 ms,TE 2.5 ms,FOV 220 mm×230 mm,层厚5 mm;脂肪抑制快速自旋回波序列T2W,TR 6 000 ms,TE 97 ms,FOV 200 mm×230 mm,层厚 5mm;T2-FLAIR,TR 8 000 ms,TE 85 ms,FOV 220 mm×230 mm,层厚5 mm;DWI,TR 4 300 ms,TE 73 ms,FOV 230 mm×230 mm,层厚5 mm,b值为0和1 000 s/mm2。增强扫描:经静脉注射钆喷酸葡胺,0.1 mmol/kg体质量,采集轴位、矢状位、冠状位T1WI,参数同平扫。
1.3 图像特征提取 由2名工作经验分别为3年和5年的影像科医师在不知晓病理结果的情况下独立完成图像特征提取。将MRI以DICOM格式导入3DSlicer软件(Version3.9.0,http://www.slicer.org)中进行肿瘤分割,具体步骤(图1):①参照T1WI、T2WI及增强扫描图像,在ADC图像上逐层勾画肿瘤边界,软件自动分割整个肿瘤体积[6];②采用开源Pyradiomics软件包(https://github.com/Radiomics/pyradiomics)自动提取分割肿瘤的影像组学特征,最终获取107个纹理特征,包括形态特征14个,一阶统计特征18个,灰度共生矩阵特征(gray level co-occurrence matrix, GLCM)24个,灰度游程矩阵特征16个,灰度大小区域特征16个,邻域灰度差分矩阵特征5个,灰度相关矩阵14个。
1.4 统计学分析 采用SPSS 13.0统计分析软件。对年龄、组学特征参数进行K-S正态检验,不符合正态分布的计量资料以中位数(上下四分位数)表示,符合正态分布者以±s表示。采用组内相关系数(intraclass correlation coefficient, ICC)评价2名医师提取特征的一致性,ICC>0.75为一致性好。剔除ICC≤0.75的纹理特征,对一致性好的特征取2名医师测量数据的平均值;采用Mann-WhiteneyU检验比较LGG与HGG组间差异。由于放射组学特征较多,对P值进行Bonferroni校正,P<0.05/96≈0.000 5为差异有统计学意义。
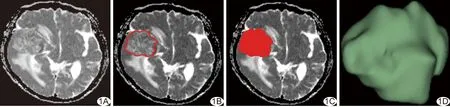
图1 肿瘤分割示意图 A.原始ADC图; B.手动勾画肿瘤边缘; C.手动填充勾画的区域,包含整个肿瘤体积; D.软件自动分割的肿瘤体积
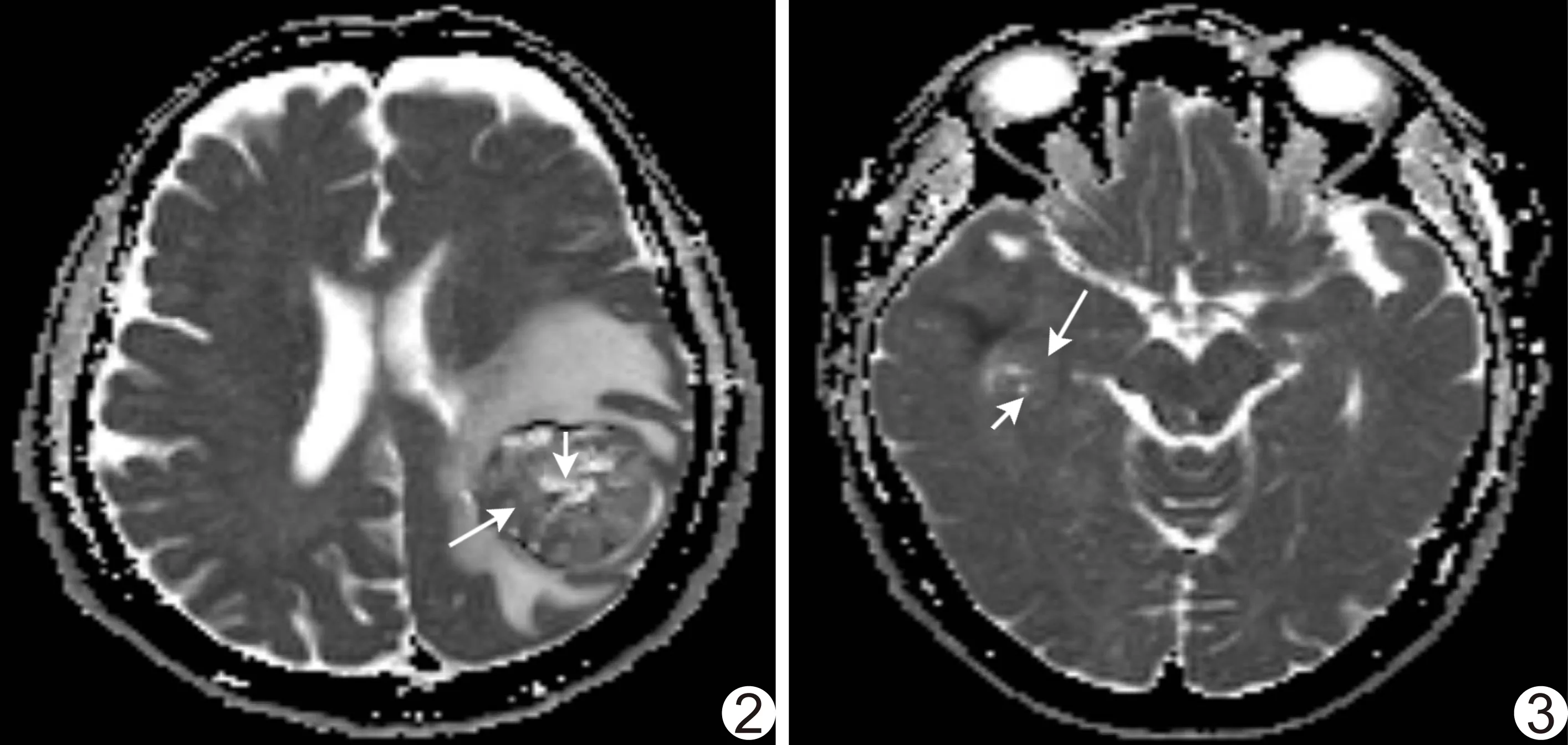
图2 患者女,67岁,左侧顶枕叶HGG,WHO Ⅲ级,ADC图示信号不均,存在低ADC值(长箭)和高ADC值(短箭)区域,全肿瘤的区域熵为7.41 图3 患者女,50岁,右侧颞叶LGG,WHO Ⅱ级,ADC图示信号不均,存在低ADC值(长箭)和高ADC值(短箭)区域,全肿瘤的区域熵为5.75
LGG组与HGG组间性别比较采用χ2检验;年龄符合正态分布,比较采用两独立样本t检验。将2组间差异有统计学意义的参数纳入Logistic回归分析模型,以似然比前进法筛选出预测HGG的独立危险因素;绘制ROC曲线评价最终筛选的相关特征对HGG的诊断效能。P<0.05为差异有统计学意义。
2 结果
HGG组与LGG组患者年龄、性别差异均有统计学意义(P均<0.05,表1)。107个影像组学特征中,96个特征2名医师测量值一致性好(ICC>0.75)。对这96个影像组学特征取平均值,经Bonferroni校正,HGG组与LGG组间表面体积比、总能量及区域熵差异有统计学意义(P均<0.000 5,表1,图2、3)。
Logistic多因素回归分析结果显示,年龄[P=0.002,优势比(odds ratio,OR)=1.090,95%CI(1.033,1.149)]和区域熵[P=0.003,OR=2.984,95%CI(1.440,6.183)]为预测HGG的独立危险因素。
ROC曲线结果显示,区域熵鉴别HGG与LGG的ROC曲线下面积为0.752(P=0.001),临界值为6.78,敏感度为63.4%,特异度为72.0%;区域熵联合年龄鉴别HGG与LGG的ROC曲线下面积为0.844(P<0.001),敏感度为75.6%,特异度为88.0%(图4)。
3 讨论
脑胶质瘤的级别是影响治疗方案选择及预后的重要因素[7-8]。对LGG通常进行手术治疗,且患者预后较好;对HGG则需在手术切除之外加行放射治疗或化学治疗,且患者5年生存率较低[9]。肿瘤恶性程度越高,细胞的密集度越高,内部成分越复杂,其异质性越高。胶质瘤的空间异质性较高,而组织病理学检查、特别是活检获得组织标本有限,存在取样误差。MRI无创、无辐射、无骨骼伪影,有良好的软组织分辨力,是诊断和随访胶质瘤的首选影像学方法。DWI能够在体观察水分子扩散运动,其参数ADC值可直接定量反映体素内水分子扩散运动受限的程度,进而评价肿瘤的良恶性。目前有关ADC值评价胶质瘤分级的研究结果存在分歧,Murakami等[10]认为最小ADC值对应胶质瘤高级别区域,而极差(最大值与最小值差)增大与整个肿瘤的分级相关;然而也有报道[11-12]称LGG和HGG的最小ADC值差异无统计学意义,根据ADC值无法区分LGG和HGG,可能与胶质瘤具有较高异质性、肿瘤在空间上存在分化程度不一致有关[5]。
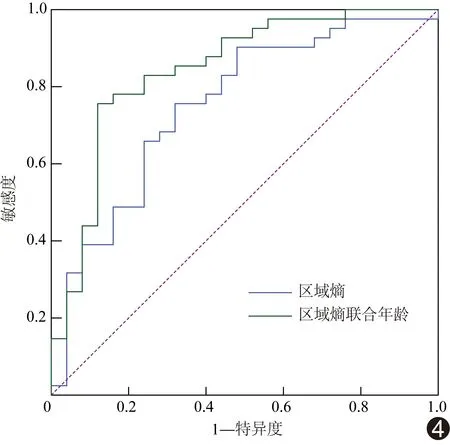
图4 区域熵和区域熵联合年龄鉴别HGG与LGG的ROC曲线
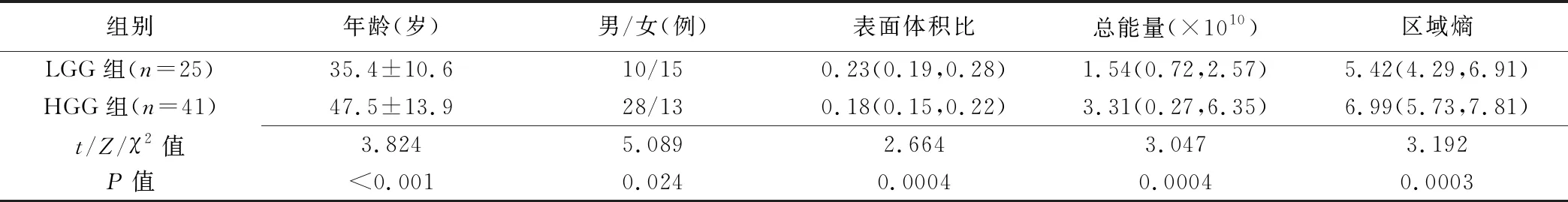
表1 LGG组与HGG组患者一般资料和肿瘤影像组学特征比较
放射组学首次被Lambin等[13]定义为从影像图中高通量提取大量影像特征以评价肿瘤的异质性;之后其概念完善为通过影像学手段(CT、MRI、PET等)高通量地提取大量影像信息,将视觉影像信息转化为深层次的纹理特征,如一阶特征、形状特征、GLCM特征等[14],凭借对影像大数据信息进行更深层次的挖掘、预测和分析,来辅助医师做出最准确的诊断。近年来,放射组学逐渐用于肺肿瘤、头颈部肿瘤、乳腺肿瘤、直肠肿瘤等研究领域,在预测肿瘤治疗效果、预后及复发转移和术前评估淋巴结转移等方面取得了明显成果[14]。在胶质瘤方面,Kang等[15]比较不同级别胶质瘤全肿瘤ADC值的直方图参数,发现根据ADC的累计频数分布图的50%位数能够较好地区分HGG和LGG。Ryu等[4]分析40例脑胶质瘤ADC图的GLCM特征,结果表明熵能较好地鉴别HGG和LGG。
本研究分析脑胶质瘤全肿瘤ADC图的多阶纹理特征,共获得107个特征,可全面反映整个肿瘤的异质性。为保证研究的可比性,采用开源软件提取胶质瘤ADC图的多阶纹理特征,通过单因素及多因素分析进行特征降维,最终确定区域熵与胶质瘤分级的相关性最高,为预测HGG的独立危险因素(P=0.003,OR=2.984)。区域熵为更为高阶纹理特征,表示区域大小及灰度的不确定性或随机性,反映图像的不均匀性,其值越大,表示肿瘤的异质性越高。肿瘤异质性与内部空间变异、血管生成、细胞外间质和坏死区有关[5]。HGG恶性程度高,易发生囊变坏死,内部结构比LGG更为复杂,异质性高于LGG。本研究显示区域熵鉴别HGG与LGG具有中等诊断效能,ROC曲线下面积为0.752;患者年龄是HGG的危险因素,与Tian等[16-17]研究结果一致;联合应用区域熵和年龄鉴别HGG与LGG,ROC曲线下面积为0.844,敏感度为75.6%,特异度为88.0%,表明联合纹理特征与临床特征能比单独使用纹理特征更好地鉴别HGG与LGG。
由于放射组学特征较大,且算法不统一,对特征的筛选和降维是尚未解决的关键问题之一[18]。Berenguer等[19]研究CT图像的放射组学特征,发现约91%的组学特征具有可重复性,但大部分特征冗余。本研究经一致性检验发现,基于ADC值获得的全肿瘤组学特征中,89.72%(96/107)的特征在2名医师间有较好的一致性。由于组学特征变量较多,本研究对单因素分析结果进行Bonferroni校正,对特征进行较为严格的筛选,尽量剔除重复冗余的特征,最后有3个组学特征进入多因素Logistic回归模型。
本研究的局限性:①为回顾性分析,样本存在选择性偏倚;②未根据图像特征重新进行多点取材,以明确判断病理分级:③对于数量庞大的组学特征,仅采用单因素及多因素分析进行特征筛选,未采用相对复杂的算法进行降维和对研究结果进行验证。
综上所述,根据ADC图的纹理特征可以很好地鉴别HGG与LGG,联合临床特征后具有较高诊断效能,有望为临床提供新的无创且能量化图像信息技术手段,用于精确评价脑胶质瘤分级,具有广阔的应用前景。
