食管微生态与食管疾病
2019-07-31王赛宇朱兰平王邦茂
马 双, 王赛宇, 朱兰平, 陈 鑫 王邦茂
马双, 王赛宇, 朱兰平, 陈鑫, 王邦茂, 天津医科大学总医院消化内科天津市 300052
核心提要: 食管微生态特别是食管菌群和牙周致病菌与食管疾病密切相关, 探究特定菌群在食管疾病中的作用和机制, 可能是食管疾病潜在的诊断和治疗靶点.
0 引言
随着宏基因组学的发展, 目前的研究发现食管微生态特别是食管菌群以及牙周致病菌可能参与了食管疾病的发生和发展, 但其具体作用机制仍不明确. 本文综述了健康成人、胃食管反流病(gastroesophageal reflux disease, GERD)、嗜酸性粒细胞性食管炎(eosinophilic esophagitis, EoE)、Barrette's食管(barrett's esophagus,BE)、食管腺癌(esophageal adenocarcinoma, EAC)及食管鳞状细胞癌(esophageal squamous cell cancer, ESCC)患者和相应动物模型的菌群特征.
1 正常食管菌群
正常食管菌群是以链球菌属(Streptococcus)为主的复杂菌群, 与口腔菌群具有相似性. Pei等[1]人使用16S rRNA测序技术对4例正常成人的食管菌群进行检测, 发现正常食管菌群在门水平上与口腔菌群大致相同, 主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroides)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、梭杆菌门(Fusobacteria)和TM7共6种门类及95种细菌组成, 其中常见的菌属是链球菌属(39%)、普氏菌属(Prevotella)(17%)和韦荣氏球菌属(Veilonella)(14%), 但缺乏在口腔菌群中普遍存在的螺旋体门(Spirochaetes). Norder Grusell等[2]利用食管活检及活检刷中的样本培养出了23种菌属, 链球菌属、奈瑟氏球菌属(Neisseria)、嗜血杆菌属(Haemophilus)和普氏菌属为主要菌属, 其中链球菌属在食管活检及活检刷中的检出率为95%-98%. 上述研究表明在正常生理情况下, 食管具有自身独立的定植菌群,而不是短暂停留在食管黏膜上皮的口腔菌群.
2 影响食管菌群的因素
2.1 质子泵抑制剂 有研究报道, 质子泵抑制剂(proton pump inhibitors, PPI)可能通过抑制胃酸分泌或直接靶向作用于含P型ATP酶的细菌[如肺炎链球菌和幽门螺杆菌(Helicobacter pylori, H. pylori)]质子泵影响胃和食管的菌群[3]. 目前的研究表明PPI可能在酸反流相关性疾病的基础上影响食管菌群结构, 但暂不明确PPI是否影响正常的食管菌群. Amir等[4]对8例GRED患者的远端食管活检组织及胃液中的菌群进行分析, 发现远端食管活检组织的菌群经PPI处理后发生显著变化, 丛毛单胞菌科(Comamonadaceae)减少而梭菌科(Clostridiaceae)、毛螺菌科(Micrococcaceae)等梭菌门增加, 但这些改变的利弊仍不明确. Deshpande等[5]采用16S rRNA和18S rRNA扩增测序技术和鸟枪测序法全面分析了106例食管微生物组发现, PPI对GERD患者菌群的影响较正常人明显, PPI可使乙酸盐产生途径和细菌性抗生素合成途径增加, 这可能与PPI影响食管菌群结构相关.
2.2 膳食 食管菌群与口腔菌群具有相似性, 膳食可能影响食管菌群. Nobel等[6]对47例BE患者的食管黏膜菌群进行回顾性研究, 发现增加纤维膳食摄入量可使厚壁菌门相对丰度增加, 变形菌门和革兰阴性菌相对丰度降低, 但脂肪膳食对食管的菌群结构无显著影响, 提示未来对食管菌群的研究需将饮食作为一影响因素. 此外,膳食影响食管菌群的机制可能是多方面的: 其一, 通过影响相邻胃肠道区域的菌群从而间接影响食管菌群; 其二, 通过改变宿主的代谢状态影响食管菌群. 但Kaakoush等[7]的动物研究表明, 长期高脂饮食可使大鼠的食管菌群发生显著改变, 狭义梭菌属(Clostridium sensu stricto)在食管上段和下段富集, 并且微生物源类胡萝卜素合成途径在食管下段明显减少, 提示不健康的高脂饮食可使食管菌群发生改变, 由高脂饮食导致的梭杆菌属丰度增加和微生物源类胡萝卜素合成途径改变是未来重要的研究方向.
3 食管菌群与食管疾病
3.1 GERD和BE 由于受胃酸、胆汁酸和其他胃内容物反流的影响, GERD和BE患者的食管优势菌群由革兰阳性菌向革兰阴性菌转变, 并且伴有菌群多样性的改变, 多个研究比较了GERD和BE患者与健康者的食管菌群(表1). Macfarlane等[8]报道, BE患者具有菌种丰富的食管菌群, 在57%(4/7)BE患者食管菌群中发现了高水平的与肠炎、牙周感染和肿瘤形成相关的弯曲杆菌(Campylobacter), 然而在非BE的对照组中未发现类似特征, 弯曲杆菌可能在食管疾病的病程中发挥作用. Yang等[9]的研究将食管菌群分为与正常食管相关的Ⅰ型菌群和与食管炎和BE相关的Ⅱ型菌群, Ⅰ型菌群以链球菌等革兰阳性菌为主, 而Ⅱ型菌群则含有较大比例的革兰阴性厌氧或微需氧菌(如拟杆菌门、变形菌门、梭杆菌门及螺旋体门), 远端食管炎症、肠化可能与食管菌群改变相关. Liu等[10]也指出正常食管、GERD和BE患者远端食管菌群在门和属水平上存在差异, 但是在数量上不存在差异, 在GERD和BE患者远端食管菌群中发现了正常食管菌群中不存在的梭杆菌门. 但也有文献报道, 在正常人、GERD及BE患者的食管黏膜菌群间未发现显著的差异[11,12]. Yu等[11]的研究表明, 我国GERD患者食管菌群总体数量和多样性只有轻度降低, 差异无统计学意义. 样本量较小、个体差异以及饮食习惯的差异可能导致上述结果不同. 一项针对口腔菌群与BE的研究报道, BE患者具有高度独特的口腔微生物结构, 其厚壁菌门丰度相对增加而变形菌门丰度降低, 包含一定丰度的劳特罗普氏菌属(Lautropia)、链球菌属和未分类的拟杆菌属的特征性菌群模型可较准确区分BE和非BE患者[13].另有一项体外研究发现, 当两种不同的BE细胞系分别与双歧杆菌和乳酸杆菌培养时, TNF-α和cox2的表达降低, 提示益生菌可能具有抑制BE发展的作用[14].
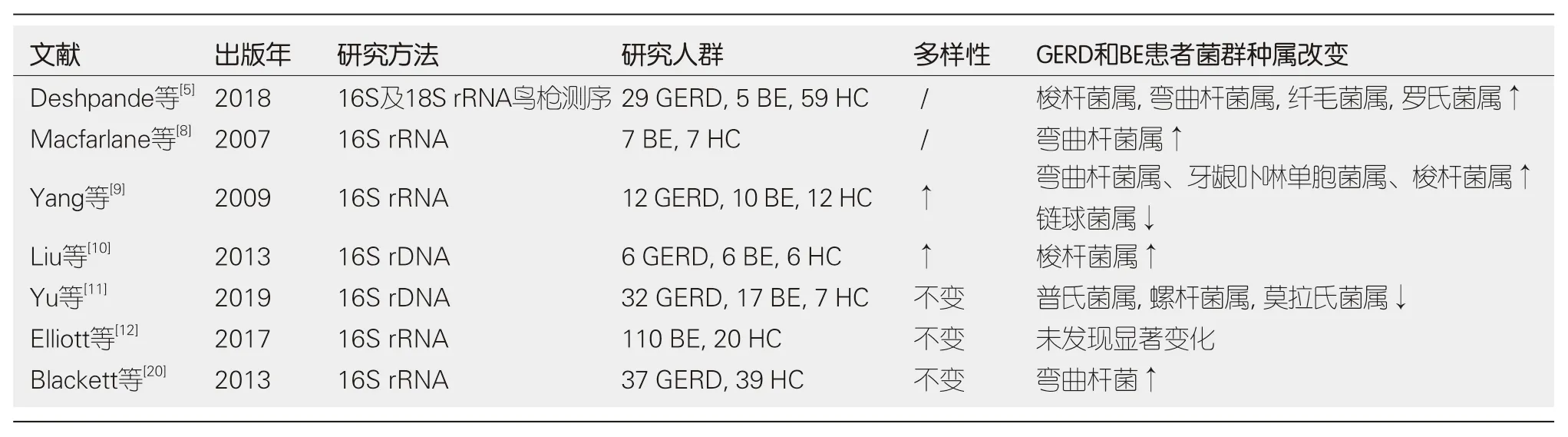
表1 胃食管反流病和Barrette's食管患者食管菌群的研究汇总
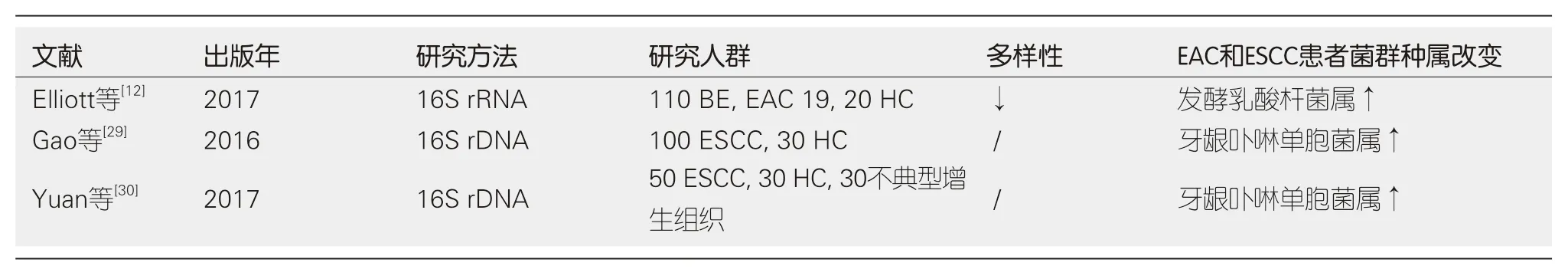
表2 食管腺癌和食管鳞状细胞癌患者食管菌群的研究汇总
脂多糖(lipopolysaccharide, LPS)是革兰阴性菌细胞壁的重要成分, LPS可直接或间接刺激食管上皮细胞或炎性细胞表面的Toll样受体4(toll-like receptors 4, TLR4),从而激活核转录因子κB(nuclear factor-κB, NF-κB)信号通路[15]. 活化的NF-κB信号通路促使诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)高表达, 合成大量的NO, 通过减缓胃排空和增加食管下段酸暴露时间, 导致GERD和BE食管黏膜炎症进一步加重. Nadatani等[16]指出, 在BE细胞中, LPS可通过TLR4信号通路激活NOD样受体蛋白3(NOD-like receptor protein 3, NLRP3)炎性小体, 引起促炎性细胞因子释放和BE细胞焦亡, 食管菌群可能通过触发炎症相关的分子事件促进BE发展过程中炎性反应介导的致癌作用. 总体而言, GRED及BE患者食管菌群中增加的革兰阴性菌可能通过诱导食管黏膜慢性炎症的发生, 并引发炎症级联反应, 从而促使EAC的发生.
3.2 EAC和ESCC 食管癌是全球癌症相关死亡的第六大病因, 主要分为起源于远端食管腺体细胞的EAC和食管上皮细胞的ESCC, 由于组织学来源不同, 二者的病因及流行病学特征差异较大[17]. 现就关于EAC和ESCC患者与健康者食管菌群变化的研究进行汇总分析(表2). 有荟萃分析表明, 在西方国家EAC发病率上升与H. pylori感染率下降一致,H. pylori可能具有降低EAC发病风险的作用, 而与ESCC的发生没有显著关联[18].H. pylori感染与EAC发病关联的机制尚不明确, 可能与胃黏膜萎缩相关的低酸性环境有关[19]. Blackett等[20]报道, GERD和BE患者食管菌群数量除弯曲杆菌属外均显著下降, 且简明弯曲杆菌(C. concisus)的丰度明显增加, 简明弯曲杆菌的丰度与促进BE向EAC发展的炎性细胞因子IL-18的表达相关. 有研究表明, 简明弯曲杆菌可能以时间依赖的方式诱导BE细胞系中CDX1表达, 从而促进BE向EAC发展[21]. 此外, Elliott等[12]的研究发现, 与健康对照组和BE患者的食管菌群相比, EAC患者的菌群多样性下降,食管菌群中发酵乳杆菌属(Lactobacillus fermentum, L fermentum)丰度增加. Deshpande等[5]报道EAC级联过程中微生物来源的乳酸产生途径增加, 过度的乳酸代谢具有致癌作用[22]. 鉴于已有文献报道在胃腺癌中产乳酸相关细菌丰富增加, 所以进一步探究EAC级联过程中产乳酸的特定菌群及其作用于宿主细胞的机制具有一定的研究意义[23]. Peters等[24]研究口腔菌群与食管癌风险的关系发现, 牙周致病菌福赛斯坦纳菌(Tannerella forsythia)与EAC患病高风险相关, 肺炎链球菌和奈瑟菌丰度降低与EAC患病低风险相关, 并且强调由细菌源类胡萝卜素可能具有抗EAC的作用.
探究食管菌群与EAC关系的实验结果暂不一致, 但目前累积的证据表明食管菌群在EAC中具有重要作用.Zaidi等[25]的采用大鼠EAC模型发现, 在60%的BE和全部的EAC黏膜菌群中检测到大肠杆菌(E. coli), 但在癌旁正常组织、不典型增生及GERD黏膜菌群中未检测到大肠杆菌. 与正常食管组织相比, TLRs 1-3、6、7和9在EAC中明显升高, 表明TLR信号通路与大肠杆菌之间存在关联, 菌群可能介导了大鼠EAC模型中的早期分子变化. 但Sawada等[26]发现, 抗生素可使食管菌群结构发生变化, 但不影响EAC发生率. 经抗生素干预后, 大鼠食管乳酸杆菌属丰度相对降低而梭状芽孢杆菌属XIVa和XVIII丰度升高, 提示食管菌群结构的变化不影响大鼠EAC的发病率, 食管菌群可能与EAC的发生无关.
口腔菌群与ESCC的发生密切相关, 其中牙龈卟啉单胞菌是目前较为明确的ESCC患病高风险相关性细菌. 有研究报道, 食管菌群的多样性与食管鳞状上皮异型增生呈负相关[27]. 口腔健康状况差、口腔卫生习惯不良和ESCC患病风险呈正相关[28]. 一项研究报道, 牙周致病菌牙龈卟啉单胞菌存在于61%的ESCC黏膜组织中,12%的癌旁组织中, 而极少在正常食管黏膜组织中检测到, 且牙龈卟啉单胞菌感染与ESCC的分化、转移及预后呈正相关, 牙龈卟啉单胞菌可能成为ESCC筛查的生物标志物, 根除常见的口腔致病菌可能是防治ESCC的新靶点[29]. Peters等[24]的研究也指出牙龈卟啉单胞菌与ESCC发病高风险相关. 常在ESCC或食管不典型增生鳞状上皮中检测到牙龈卟啉单胞菌, 而极少在癌旁、正常食管组织上皮、贲门胃底癌或其他类型胃癌黏膜上皮中检测到[30]. Gao等[31]报道, 牙龈卟啉单胞菌的IgG和IgA抗体是ESCC潜在的血清生物标志物, 可用于ESCC的早期检测, IgG或IgA抗体滴度与ESCC的预后呈负相关. 此外, 也有研究表明食管具核梭杆菌(Fusobacterium Nucleatum, F. nucleatum)与ESCC患者肿瘤相关性生存期密切相关, 具核梭杆菌可能通过激活特定的趋化因子增加肿瘤的侵袭力(如CCL20)[32]. 但由于菌群在个体间的差异性, 因此需要更多的研究来证实并进一步阐明食管菌群对肿瘤生物学行为的影响机制.
3.3 EoE EoE是一种慢性免疫介导的炎症性食管疾病,其发病机制尚未完全明确, 有研究表明食管菌群失调可能是EoE发病机制中的一方面. Dellon等[33]在一项基于美国病理数据库的横断面研究表明,H.pylori感染和EoE的发病率呈负相关. Harris等[34]报道, EoE患者食管黏膜中细菌总数增加, 且与治疗与否和黏膜嗜酸性粒细胞浸润程度无关. 与正常食管黏膜菌群相比, 未接受治疗的EoE患者食管黏膜中嗜血杆菌(Haemophilus)明显增加. 另有研究表明, EoE与非EoE食管菌群结构显著不同,在EoE食管菌群中存在奈瑟菌属和棒状杆菌属等变形菌门细菌富集, 且这种差异在活动性过敏性炎症期间最大[35]. 在活动性EoE黏膜中菌群数量及TLR1、2、4和9的表达显著增加, 提示食管菌群和固有免疫可能与EoE的发病有关[36]. 目前的研究提示EoE食管菌群发生了改变, 但缺乏证据来说明这些改变如何在EoE的发生和发展过程中发挥作用.
4 结论
正常食管菌群是以链球菌属为主的复杂菌群, PPI、膳食可能会影响食管菌群结构. 与正常食管菌群不同,GERD和BE的优势菌群由革兰阳性菌向革兰阴性菌或厌氧菌转变, 菌群失调介导的炎性免疫反应通过诱导食管黏膜慢性炎症的发生, 促使GERD和BE向EAC发展.牙周致病菌与食管癌的发病及预后密切相关, EoE病程中伴有食管菌群结构的改变. 总之, 食管菌群在食管疾病的发生和发展中可能具有重要作用, 但目前的研究仅局限于小样本的横断面研究, 暂不明确食管菌群失调或特定菌群与食管疾病的因果关系. 未来研究特定菌群在食管疾病中的作用和机制对于基于微生态的食管疾病干预具有重要意义.
