Spexin转基因小鼠的构建及表型初步分析
2019-07-31杨春菊尹俊林樊保敏卞兆祥林成源曾广智
杨春菊,庄 敏,赖 奇,尹俊林,樊保敏,卞兆祥,2,林成源,曾广智
(1.云南民族大学 云南民族大学-香港浸会大学传统天然药物研发联合实验室,云南 昆明 650500; 2. 香港浸会大学 中医药学院,香港)
Spexin(SPX),又名神经肽Q,是通过现代生物信息学技术发现并鉴定的神经肽[1-2].成熟的spexin由14个氨基酸组成[3],在脊椎动物中高度保守,并且广泛表达于中枢神经系统、消化道上皮及内分泌细胞中[4].研究证实,spexin属于甘丙肽(galanin)家族,可有效激活甘丙肽受体2(GALR2)和甘丙肽受体3(GALR3)[5].组织分布结果显示,GALR 2/3广泛表达于中枢神经系统和外周组织中,表明spexin可能具有多种生物学功能.
总的来说,spexin通过担当体循环中的内分泌信号和中枢神经系统中的神经递质的方式来发挥它的生物学功能[6].现已研究报道的功能主要有以下几方面:①促进胃肠道运动[1, 7];②抑制动物的摄食[7-12];③影响脂类代谢、血糖水平和能量平衡[13-19];④镇痛作用[5-20];⑤对内分泌组织的影响[3, 21-22];⑥心血管和肾脏功能[20-23];⑦抗抑郁和焦虑[24-25].尽管目前对spexin的研究不断增多,也发现了其越来越多的功能,但这只是个开始,从现有的成果来看,它与物质代谢、机体内分泌和神经中枢都有着千丝万缕的联系,值得我们进一步深入去探索它更多的功能,并阐明其中机制,最终服务于各种疾病的治疗.为此,课题组构建了spexin转基因模型小鼠,并成功实现了稳定繁育.这将为探索spexin更多的功能和相关机制提供更好的动物模型.同时开展了以spexin转基因小鼠为对象的糖耐受实验,以对该模型小鼠进行初步的表型分析,同时寻求它在葡萄糖代谢方面更多的证据.
1 材料与方法
1.1 材料与试剂
Tris 、EDTA购自美伦生物技术有限公司;DNA Marker购自Thermo Scientific公司;Taq DNA Polymerase 试剂盒购自Takara Biomedical Technology公司;Proteinase K购自Merk公司;琼脂糖(Biowest)购自上海贝晶生物技术有限公司;核酸染料GelRed购自Biotium公司.PCR引物由上海生物工程有限公司合成;spexin ELISA试剂盒购自Phoenix Pharmaceuticals;葡萄糖购自Sigma;高脂饲料购自美国Research Diets;普通饲料和玉米芯垫料均购自四川省医学科学院四川省人民医院实验动物研究所.
1.2 仪器
Biosens SC Series-805全自动凝胶成像系统(中国上海);Eppendrof 5424R低温高速离心机(德国);Analytik Jena FlexCycler 2多功能PCR仪(德国);IKA干浴器(德国);一恒THZ-100B恒温培养摇床(中国上海);君意JY-SPCT型水平电泳槽(中国北京);血糖仪(美国强生);iMark 酶标仪(日本Bio-Rad).
1.3 转基因小鼠的构建
Spexin转基因小鼠由赛业(广州)生物科技有限公司转基因动物中心构建,背景为C57BL/6.构建过程为:将利用piggyBac(PB)转座子构建的spexin过表达载体pPB[Exp]-CAG>mB230216G23Rik[NM_001242345.1], 用显微注射技术注射到小鼠受精卵内,再转移到代孕母鼠内自然生产,最后通过PCR法鉴定筛选子代阳性转基因小鼠.
1.4 小鼠的饲养和繁殖
小鼠饲养于SPF级动物房,温度控制在21~23 ℃,湿度 50%~65% ,光照控制12 h明/12 h暗,所喂饲饲料、水及所用垫料、笼盒均经过严格高压灭菌,小鼠可自由采食和饮水,除在哺乳期的母鼠,每一笼内小鼠不超过4只,垫料每周更换一次.小鼠繁殖时将同代性成熟的雌鼠和雄鼠按2∶1配对,并保证雌雄鼠基因型互异,每天观察小鼠的状态并及时添补食水,母鼠怀孕后立即单独放入新的笼盒待产.出生小鼠3周后断奶并与母鼠分开喂养,用不锈钢耳钉进行编号,并剪尾鉴定基因型.
1.5 小鼠的基因型鉴定
1.5.1 小鼠尾部组织基因组DNA的提取
在子鼠3周龄与母鼠分笼后,剪取2~3 mm尾部组织,置于1.5 mL Eppendorf管中,加入100 μL 消化缓冲液(50 mmol/L KCl,10 mmol/L Tris - HCl,0.1% Triton X - 100)和1 μL 蛋白酶K(终质量浓度0.5 mg/mL),56 ℃,190 r/min摇床过夜.然后98 ℃金属浴13 min使蛋白酶K变性.最后室温下14 000 r/min离心15 min,取1.5 μL上清液做PCR.
1.5.2 小鼠基因型的聚合酶链反应(PCR)
用G蛋白调节子7(Rgs7)做内参,用了2对靶向spexin的引物来验证.所用引物序列见表1.反应体系为25 μL,ddH2O 8.6 μL, 正反向的目的基因引物各0.8 μL,内参各0.4 μL,预混聚合酶12.5 μL,模版1.5 μL.PCR扩增条件为:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火35 s,72 ℃ 延伸35 s,35个循环;72 ℃ 延伸5 min;-20 ℃ 保存.

表1 PCR引物
注:Rgs7(G蛋白调节子7)为内参.
1.5.3 琼脂糖凝胶电泳
琼脂糖0.128 g 溶于16 mL 1×TBE中,微波加热充分溶解后加入1.6 μL Gelred混匀,降温至50~60 ℃,倒入插好梳子的胶床,冷却30 min以上即可使用.DNA每孔加5 μL,电泳电压120 V,时间35 min.电泳结束后用凝胶成像仪进行拍摄和分析.
1.6 小鼠血清spexin检测
取小鼠全血80~100 μL,室温静置1~2 h,4 ℃,3 500 r/min 离心10 min,取上清50 μL,按Phoenix Pharmaceuticals spexin ELISA试剂盒方案测定其中所含spexin的浓度.
1.7 糖耐受实验
随机选取了10~14周龄的转基因型雄鼠、野生型雄鼠各8只,于实验前85 d饲喂高脂饲料,每天称量小鼠体重,进行糖耐受实验时平均体重达42 g.小鼠出生日期及连续饲喂高脂饲料85 d后的体重信息如表2所示.从第86天开始,开始糖耐受实验,为减少组间差异,选体重相近的阴阳小鼠各一只组成一组,2只小鼠于实验前一天同时禁食16 h,每天上午一组下午一组共4只进行糖耐受实验,16只小鼠分4 d完成实验.给药方式采用灌胃按1 g/kg的剂量给葡萄糖,分别在0、15、30、60、90、120 min时从尾静脉取血测定血糖浓度[26].

表2 糖耐受实验小鼠信息
1.8 数据统计
实验数据以Mean±SEM的形式表示,用Graphpad prism 7软件进行Student’s t - test显著性差异分析.p值小于 0.05 作为有显著性差异,p值小于 0.01 作为有极显著性差异.
2 结果
2.1 小鼠的基因型鉴定
所用引物共有3对,内标引物扩增出的条带为507 bp,靶向小鼠内源性Rgs7基因,故野生型和转基因型小鼠均在507 bp的位置有明亮的条带.目标基因由两对引物共同确证,野生型小鼠在301 bp(图1b)、300 bp(图1a)的位置均没有条带;而spexin转基因型的小鼠在301 bp(图1b)、300 bp的位置均能扩增出很亮的条带(图1a).说明转基因型小鼠体内spexin过表达的PB转座子成功插入小鼠基因组中,且能稳定遗传.
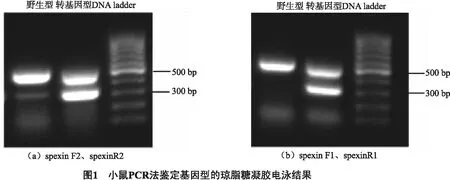
子鼠出生3周后剪尾提取总DNA后进行PCR扩增,之后进行琼脂糖凝胶电泳.PCR扩增时总共使用3对引物,图1a是采用表1中spexin F2、spexin R2及内参Rgs7 F 、Rgs7 R两对引物,靶向spexin的引物可扩增出分子量为300 bp的片段,内参扩增出的片段分子量为507 bp.电泳结果为转基因型小鼠分别在300 bp和507 bp位置有很亮的条带,野生型仅507 bp的位置有很亮的条带;图1b是采用表1中spexin F1、spexin R1及内参Rgs7 F 、Rgs7 R两对引物,靶向spexin的引物可扩增出分子量为301 bp的片段.电泳结果为仅转基因型小鼠可在301 bp的位置出现很亮的条带.所用DNA ladder分子量为100~1000 bp.
2.2 ELISA试剂盒测定血清中spexin浓度结果
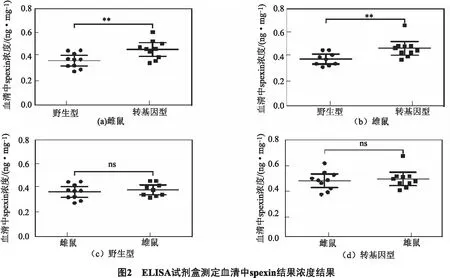
我们随机测定了转基因型雌鼠、野生型雌鼠、转基因型雄鼠、野生型雄鼠各10只血清中spexin的含量,结果如图2所示,雌性转基因型小鼠血清中spexin浓度为野生型小鼠的1.25倍,两者之间具有极显著性差异(P=0.009 4),雄性转基因型小鼠血清中spexin浓度为野生型小鼠的1.23倍,两者之间也具有极显著性差异(P=0.009 6);而无论是野生型雌雄小鼠之间(P=0.5366)还是转基因型雌雄小鼠之间(P=0.682 2),它们血清中spexin的浓度均无显著性差异.说明转基因型小鼠体内转入的基因能稳定高表达,spexin转基因小鼠构建成功且其血清中的含量没有性别差异.
随机抽取40只小鼠测定血清中spexin的浓度,图2a是雌性转基因型小鼠和野生型小鼠血清中spexin浓度具有极显著性差异(转基因型为野生型的1.25倍,P=0.009 4);图2b是雄性转基因型小鼠和野生型小鼠血清中spexin浓度具有极显著性差异(转基因型为野生型的1.23倍,P=0.009 6);图2c是野生型小鼠雌性和雄性小鼠之间血清中spexin浓度没有差异(P=0.536 6);图2d是转基因型小鼠雌性和雄性小鼠之间血清中spexin浓度没有差异(P=0.6822).结果表示为Mean±SEM(n=10/组),Student’s t - test结果为**P< 0.01,ns(not significant,差异无统计学意义)P>0.05.
2.3 糖耐受实验初步验证转基因小鼠表型
饲喂高脂饲料的85 d内,每天称量小鼠体重,小鼠平均体重由25.02 g增长至42.58 g,但是转基因型小鼠和野生型小鼠之间体重增长无差异(图3a);糖耐受结果显示,转基因型小鼠每个时间点的血糖浓度均低于野生型小鼠的,且在15 min时,两者具有显著性差异(P=0.018 2)(图3b).说明在spexin转基因小鼠模型体内,spexin表达水平的升高在一定程度上提高了小鼠的糖耐受能力,但对脂代谢的影响不够显著.
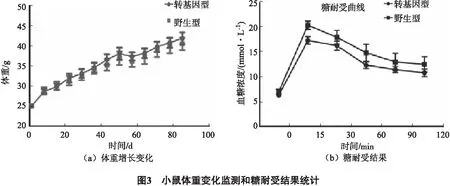
随机挑选10 ~ 14周龄的小鼠,转基因型和野生型各8只,于糖耐受实验前85 d开始饲喂高脂饲料,每天监测体重变化.图3a是饲喂高脂饲料85 d后,小鼠平均体重由25.02 g达到42.58 g,但转基因型小鼠和野生型小鼠的体重变化没有显著性差异;图3b是给小鼠禁食16 h后,采用灌胃的方式给小鼠1 g/kg的葡萄糖,分别在0、15、30、60、90、120 min时从尾静脉取血测定血糖值.结果在每个时间点,转基因型小鼠的血糖浓度均低于野生型小鼠的,且在15 min时,两者具有显著性差异(P=0.0182).结果表示为Mean ± SEM(n=8/组),Student’s t - test结果为*P<0.05.
3 讨论
Spexin作为一个新发现的神经肽,在脊椎动物中高度保守且分布广泛,意味着它可能具有多种生物学功能.从现有的研究成果看,它在胃肠道运动、动物摄食、脂类代谢、糖类代谢、镇痛、内分泌组织、心血管和肾脏、抑郁和焦虑等方面都有一定的功能,但其相关机制和信号传导通路等尚待探索.且无论从spexin的组织分布还是从目前窥探到的功能来看,这个新型的神经肽都值得更深入的研究,未来它或可为肥胖、糖尿病、抑郁、焦虑等尚困扰着我们人类的疾病的治疗提供新的思路和策略.
鉴于以上所述,课题组成功构建了spexin转基因小鼠,并成功实现了稳定繁育.这将为开展更多关于spexin的研究提供很好的模式动物.我们构建的转基因小鼠,从PCR结果上看,spexin过表达的PB转座子已成功插入基因组,而从ELISA结果上看,该片段能稳定表达出spexin.也就是说,无论从基因层面还是蛋白层面,我们构建的转基因小鼠都是成功的.而且通过对小鼠的繁育及生长状态的监测,该spexin转基因小鼠的基因型可稳定遗传,其外观表型与野生型小鼠并无明显差异.
目前已有不少研究发现spexin跟脂类和葡萄糖的代谢相关,有研究报道,在人体内血液循环中spexin含量与代谢综合征有关[27].随机挑选了16只雄鼠(转基因型和野生型各8只)于实验前85 d饲喂高脂饲料,每天监测体重变化,当平均体重达42.58 g时进行了糖耐受实验.结果发现转基因型小鼠每个时间点的血糖浓度均低于野生型小鼠,且在15 min时具有显著性差异.这从一定程度上反映出在小鼠体内,spexin与葡萄糖的代谢有关联.此前已有研究报道,给高脂饲料诱导的肥胖小鼠注射spexin能改善小鼠糖耐受能力[17].实验结果为此结论提供了更多的佐证.此外,亦有研究报道在II型糖尿病病人血液中spexin的水平相对健康人显著降低,且与血液中葡萄糖的含量呈负相关[16].通过临床研究发现,成年健康女性血液中spexin的水平与血糖显著负相关[15].但也有研究表明,spexin的水平在一定程度上影响了处于孕期中女性的血糖水平[28],且与患有妊娠期糖尿病女性的血糖正相关[29].这些研究结果说明spexin与葡萄糖代谢具有相关性,但其具体功能及机制仍需进行深入研究.在饲喂高脂饲料85天内,转基因型小鼠和野生型小鼠的体重变化并没有显著性差异.之前有报道给野生型小鼠连续腹腔注射spexin 28 d,剂量为25 μg/kg时,能显著抑制小鼠体重增长,测定血清中spexin浓度发现,该组小鼠血清中spexin浓度为对照组的1.86倍[19].而根据ELISA结果,构建的转基因模型雄性小鼠血清中spexin浓度为野生型小鼠的1.23倍.此外还有小鼠的个体差异、所饲喂饲料差异、样本容量大小,把这些因素综合起来可能是转基因型小鼠和野生型小鼠之间体重增长没有显著性差异的原因.
综上所述,构建的spexin转基因小鼠模型,在基因层面和蛋白层面spexin的含量都较野生型有显著提高,且其糖耐受能力也有所增强.该模型的成功构建,将为今后做关于spexin更系统、更深入的研究提供很好的模式动物.
