基于高通量测序分析槟榔原籽贮藏过程中真菌群落结构
2019-07-30蒋雪薇熊久松邓建阳徐欢欢罗晓明
蒋雪薇 李 浩 熊久松 邓建阳, 徐欢欢 姚 力 罗晓明*
(1 长沙理工大学化学与食品工程学院 长沙410114 2 湖南益阳皇爷食品有限公司 湖南益阳413000)
槟榔是一种地方特色小食品, 国内主产于海南,加工地主要在湖南[1]。 现代食用槟榔食品起源于湖南省湘潭市,在上世纪90年代开始使用现代化方法组织加工和生产, 现在已经发展成为一种遍布湖南全省并不断向全国扩散的休闲食品[2-3]。目前,湖南槟榔食品年产值达到300 亿,占全国槟榔食品总产值的四分之三, 是湖南食品行业中极具特色的产业之一。 产于海南的槟榔鲜果经干制后制成原籽运至湖南加工,根据原籽的贮藏时间,将当年处理得到的原籽称为新籽, 而贮藏1年及以上的原籽称为老籽。 由于槟榔成果时内生菌以及运输贮藏条件的影响,所以无论新籽还是老籽,在其贮藏过程中会出现长霉的现象, 而霉变的槟榔原籽不能进入后续加工环节。 大面积的霉变往往造成加工企业的重大损失。为减少原料损失,槟榔加工企业开始研究原籽的防霉。 分析原籽中霉菌的群落结构,从而得出原籽中霉菌污染途径,是设计有效防控方案的基础, 因此研究槟榔原籽中污染霉菌的基本信息对槟榔原籽防霉技术研发具有重要的指导意义[4-5]。
由于槟榔食品的地域局限性, 所以关于其污染菌的研究较少, 且多采用传统的菌种分离及鉴定方法为主,所得菌群信息较少且准确程度不高。银波[6]、文大缀等[7]通过霉菌形态特征,发现原籽及生产过程中优势霉菌分别为青霉及毛霉; 徐远芳等[8]通过ITS 序列测定,发现成品槟榔中两种主要污染霉菌分别为类棒菌状红球菌(Rhodococcus corynebacterioides)和黄曲霉(Aspergillus flavus)。近几年运用较多的分子生物学方法, 如变性梯度凝胶电泳技术(DGGE)[9]、温度梯度凝胶电泳技术和基因文库法则未见报道。 高通量测序(HTS)技术是近几年基因组学研究中应用最广泛的测序技术, 其对微生物群落结构的研究具有明显的先进性和优势, 能对不同菌群进行准确定量及实时检测。目前,高通量测序技术已广泛运用于肠道及土壤等样品的菌群多样性分析等多个领域[10-13]。 近期,高通量测序技术也开始运用于红酒、奶酪等较复杂的微生物发酵体系的研究[14-17]。本文利用高通量测序技术对不同槟榔原籽的真菌群落结构进行研究, 建立一套适用于固体食品物料的高通量测序方法,并获得槟榔贮藏中污染微生物分类信息,从而了解其污染源, 为槟榔生产微生物污染防控提供理论依据。
1 材料与方法
1.1 材料与试剂
槟榔原籽样品采自某槟榔公司,产地海南,包括当年产的槟榔原籽新籽(BL1)及贮藏超过1年的原籽老籽(BL2)。
E.Z.N.A.Soil DNA Kit,美国Omega 生物试剂公司;Taq DNA Polymerase 及dNTP-mix, 美国Thermo Fisher 科技公司;Qubit2.0 检测试剂盒,美国Life 科技公司;SanPrep 柱式DNA 胶回收试剂盒,上海生工;琼脂糖,北京天根生化科技有限公司。
引物为真菌18S 通用引物, 由上海生工生物工程有限公司提供合成: 上游引物NS1[18](5′-GTAGTCATATGCTTGTCTC-3′), 下游引物FUNGAL[19](5′-ATTCCCCGTTACCCGTTG-3′)。
1.2 仪器与设备
Pico-21 台式离心机, 美国Thermo Fisher 科技公司;GL-88B 漩涡混合器, 海门市其林贝尔仪器制造有限公司;TND03-H-H 混匀型干式恒温器,深圳拓能达科技;DYYY-6C 电泳仪电源,北京市六一仪器厂型;DYCZ-21 电泳槽, 北京市六一仪器厂;凝胶成像系统ChampGel5000(增强型),北京赛智公司。
1.3 试验方法
1.3.1 总DNA 的提取及PCR 扩增 采用E.Z.N.A.Soil DNA Kit 试剂盒提取槟榔中微生物总DNA,然后用Qubit2.0 检测DNA 的浓度,琼脂糖凝胶电泳检测DNA 完整性,置于-20 ℃备用。选用通用引物NS1-FUNGAL 进行扩增。PCR 反应程序为:95 ℃预变性30 s;95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸30 s;35 个循环, 最终72 ℃延伸5 min。PCR 结果于1%琼脂糖凝胶上电泳,EB 染色,凝胶成像观察,扩增效果较好。
1.3.2 PCR 产物纯化及定量 采用生工琼脂糖回收试剂盒对PCR 扩增产物进行切胶回收,然后按照PCR 产物的检测方法检测。回收产物用Qubit2.0 检测试剂盒定量。
1.3.3 高通量测序 利用Qubit2.0 DNA 检测试剂盒对回收的DNA 精确定量, 根据测得的DNA浓度,将所有样品按照1∶1 的比例进行混合;混合后充分振荡均匀, 然后利用Illumina Miseq 测序平台进行测序。
1.3.4 QIIME[20]软件数据分析 首先采用Flash 软件融合双末端序列,而后通过各样品barcode 使数据回归样品,并使用Prinseq 软件对各样本序列做质量控制(Quality Control,QC)除去引物序列、短片段、 低复杂度序列和低质量序列。 再利用pre.cluster 软件去除非靶区域序列及嵌合体以获得可供分析的序列。
在对序列预处理完成后, 采用uclust 软件对其进行OTU 聚类。 即将多条序列根据其序列之间的距离来对它们进行聚类, 序列相似性大于97%的定位为一个OTU。最后根据样品的OTU 及序列关系,采用mothur[21]软件对样品Alpha 多样性分析,计算各种物种多样性指数,衡量样本物种多样性。
采用软件RDP classifier 将序列进行物种分类,RDP classifier 运行参数:-f allrank-q input-g 18s-o rdp_out,分类阈值默认为0.8。
2 结果与讨论
2.1 测序数据处理与分析
将两个样品混合测序, 以barcode 序列为标签,进行真菌测序。测序引物设计长度为310bp 左右。测序结束后,以barcode 对测序序列进行区分,BL1 样本获得序列数为42 702, 而BL2 样本获得序列数为40 953。 在进行QC 之后,序列长度大部分分布在300~400 之间,平均长度均在为309.6bp左右, 两个样品的有效序列长度分布详细结果见图1。 再经过去除嵌合体及靶区域外序列后,最终获得BL1 样本可用于分析的序列数为42 099,BL2 样本可用于分析的序列数为40 791, 符合基本分析要求。
2.2 高通量测序数据统计分析
2.2.1 OTU 统计分类 两个样品通过uclust 软件聚类最终总共获得1 084 个OTUs 分类,其中BL1有799 个,而BL2 有515 个。总样品和各个样品槟榔真菌门类OTU 分布如图2 所示。为了验证OTU分类能否真实地反映原始样品的微生物群落的多样性,对不同槟榔原籽菌群的多样性利用richness rarefaction 进行评估。两个样品的稀释性曲线均相对趋于平稳(图3),说明取样合理,测序量能够真实反映原始样品的微生物群落的多样性。

图1 有效序列长度分布图Fig.1 Available sequences length distribution
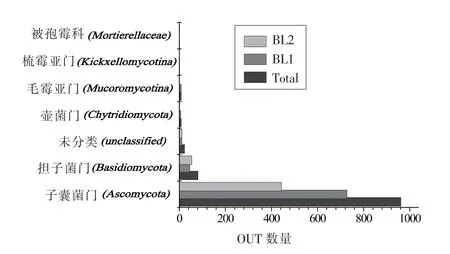
图2 样品OTU 分类Fig.2 OTU classification

图3 样品丰度稀释性曲线Fig.3 Richness rarefaction of sample
2.2.2 真菌菌群Alpha 多样性分析 采用香农指数(Shannon Index)与Chao1 指数作为两个样品α多样性的分析指标。 由Shannon 曲线 (图4)和Chao1 曲线(图5)可以看出,BL1 样品的Shannon指数及Chao1 指数均高于BL2 样品,说明BL1 样品的空间异质性及物种丰富度都较BL2 样品更高, 即槟榔原籽新籽在相同质量下具有更多的微生物物种共存。同时这也表明,槟榔原籽新籽中部分微生物并不能适应槟榔干果的环境, 从而在仓库贮藏过程中渐渐死亡。
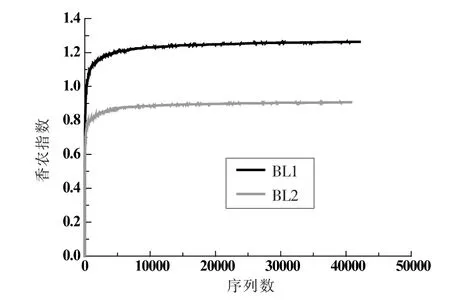
图4 香农指数稀疏性曲线Fig.4 Shannon index rarefaction
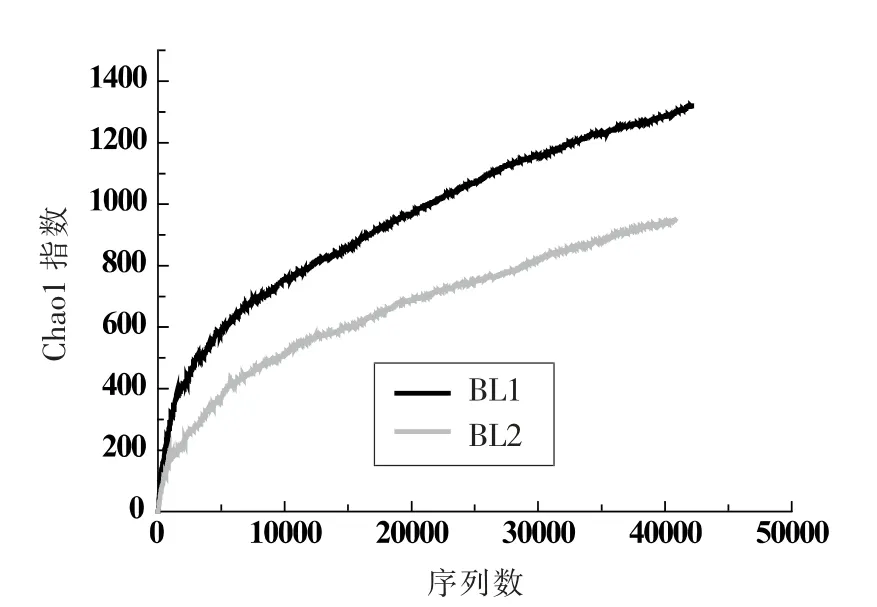
图5 Chao1 指数图Fig.5 Chao1 Index
2.3 物种分类及鉴定
从图6 可以看出,在“科”的分类水平上,槟榔新籽中占主导地位的为发菌科(Trichocomaceae)、占92.49%,节担菌科(Wallemiaceae)占1.29%,刺革菌科(Hymenochaetaceae)占0.73%,其他如酵母科(Saccharomycetaceae)、盾藻衣科(Lichinaceae)等极少,加上未分类序列占5.79%。 而槟榔老籽中基本上全部为发菌科(Trichocomaceae),占98.78%,其他如节担菌科(Wallemiaceae)、刺革菌科(Hymenochaetaceae)、酵母科(Saccharomycetaceae)等加上未分类序列仅占1.22%。 通过对比可以看出,两种槟榔原籽在family 水平上优势菌均为发菌科(Trichocomaceae),同时,在贮藏过程中,节担菌科(Wallemiaceae)、刺革菌科(Hymenochaetaceae)、酵母科(Saccharomycetaceae)等所占比例减少。
从图7 可以看出,在“属”的分类水平上,槟榔原籽新籽中以发菌科下的散囊菌属(Eurotium)、根霉属(Rhizopus)及曲霉属(Aspergillus)为主要的污染真菌,分别占96.03%、2.18%和0.82%。 其它如节担菌属(Wallemia)、纤孔菌属(Inonotus)、酵母菌属(Saccharomyces)与亥普衣属(Heppia)等也少量存在。 而在贮藏了1年的槟榔原籽老籽却是以发菌科下的曲霉属 (Aspergillus)与散囊菌属(Eurotium)为主要污染真菌, 两者所占比例分别为94.57%和4.89%。 其它只有纤孔菌属(Inonotus)含量超过0.1%。 而在新籽中存在的根霉属(Rhizopus)则并未被检出。

图6 科水平的物种丰度图Fig.6 Species richness at family level
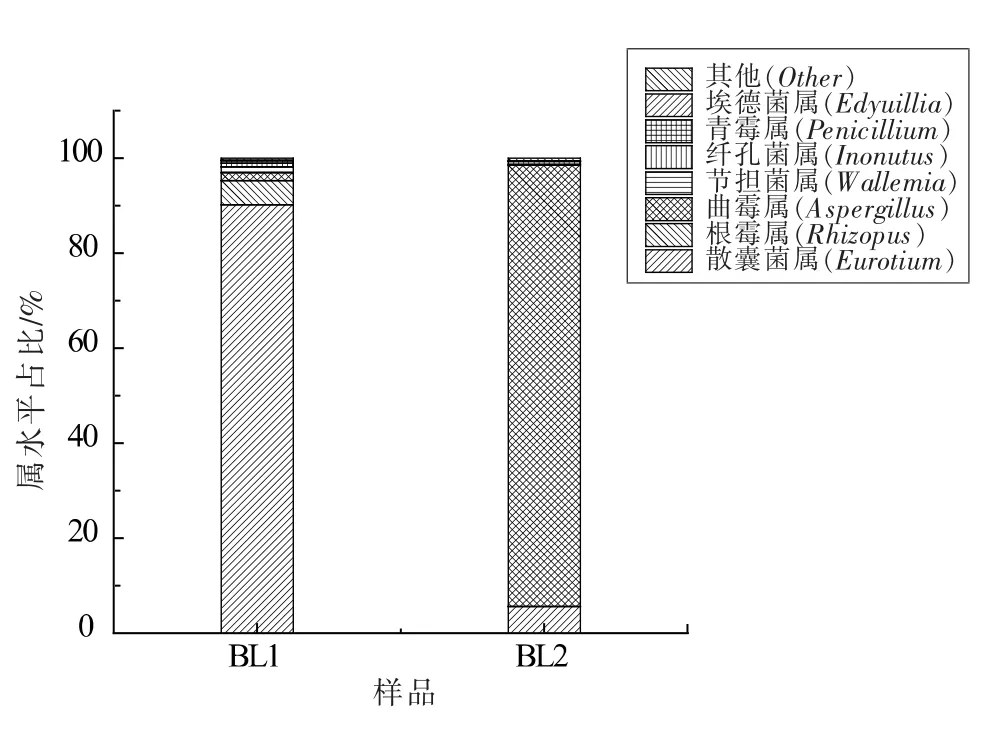
图7 属水平的物种丰度图Fig.7 Species richness at genus level
2.4 讨论
从整体上看, 槟榔原籽污染真菌均为能利用木质纤维的植物内生菌。 结合两个样品α 多样性分析及其物种分类鉴定结果可以看出, 槟榔原籽在贮藏过程中, 如根霉属 (Rhizopus)及青霉属(Penicillium)等[22]在低水活度对木质纤维利用能力较差的真菌会因为营养物质的缺乏而减少甚至消失。可以推测,这几种新籽中的污染真菌可能来源于槟榔鲜果采摘后的干燥处理及运输过程。 而散囊菌属(Eurotium)[23]及曲霉属(Aspergillus)等在低水活度下对于也能利用木质纤维的真菌则同时存在于槟榔原籽的新籽和老籽, 仅丰度比例因种间竞争而出现了差异性, 分析这些污染菌可能为槟榔鲜果的内生菌。
槟榔原籽真菌污染不仅会增加原籽贮藏成本,同时也会增加后续工序灭菌难度,造成槟榔成品的污染。因此,通过适当的处理技术可以减少鲜果中内生菌,同时,在鲜果加工成原籽及原籽运输的过程中注意减少与环境微生物的接触, 能有效减少原籽中真菌污染。
3 结论
槟榔原籽贮藏过程中, 槟榔污染真菌物种多样性会随着时间的变化而降低。 两个样品的污染真菌主要分布于发菌科(Trichocomaceae)、节担菌科(Wallemiaceae)和刺革菌科(Hymenochaetaceae)等5 个科,19 个属,发菌科为优势菌科。 而在“属”的分类水平上,新籽、老籽两种样品则分别为散囊菌属(Eurotium)和曲霉属(Aspergillus)。 根据优势菌群的特点, 可以判断槟榔原籽中大部分霉菌为内生菌。 槟榔成果时的内生霉菌在槟榔鲜果干制成原籽后还有较高的存活率, 这对槟榔产品的微生物指标有较大的影响, 如何降低槟榔鲜果内生霉菌将是今后槟榔加工防霉研究的重点。
