化皮和浓缩工艺对驴皮胶原蛋白降解产物特性的影响
2019-07-30徐菲菲陈茂深常冰玉郭尚伟麻建国
徐菲菲 陈茂深 常冰玉 郭尚伟 杨 艺 麻建国 钟 芳
(1 江南大学食品学院 江苏无锡214122 2 东阿阿胶股份有限公司 国家胶类中药工程技术研究中心 山东聊城252201)
阿胶是驴皮经前处理、煎煮化皮、浓缩熬煮等多道工序而制成的固体胶,是我国传统名贵中药。其主要成分为蛋白质类,含量占60%~85%[1],其中的蛋白质、 多肽和氨基酸是加工过程中驴皮胶原纤维逐渐水解而形成的一系列降解产物[2]。
目前对阿胶的研究主要集中在阿胶的真伪鉴别和优劣评价[3]等方面,而阿胶工艺对阿胶品质的影响研究很少。煎煮化皮、浓缩熬煮等加工工艺是除驴皮、水质[4]等用料讲究外阿胶的又一独特之处,对阿胶的品质影响很大。目前阿胶独特的加工工艺中,驴皮蛋白质发生何种变化、各工艺及其参数对产物性质的影响尚不十分明确。有关鱼皮、牛皮或其它富含胶原的组织中提取明胶蛋白及蛋白特性的研究很多,如Mehraj Ahmad 等[5]对单角革鲀皮分别用0.2 mol/L 醋酸和磷酸前处理,然后在中性条件下45 ℃热水浸提4~8 h, 结果发现出胶率为5.23%~11.54%,α1 和α2 链是提取物中的主要成分,已发生一定程度的降解。 L.S. Senaratne 等[6]用0.5 mol/L 醋酸浸泡3 d,胃蛋白酶水解48 h 提取暗鳍兔头鲀皮中的蛋白并研究提取物的性质,发现出胶率达54%,暗鳍兔头鲀皮胶原蛋白的变性温度为28 ℃,比猪皮低9 ℃。 这些工艺与阿胶的加工工艺相差甚远,无法预知驴皮在单纯热和水的作用下提取出蛋白的性质以及对提取物进行熬煮浓缩后所发生的性质变化。
本文通过对前处理后的驴皮进行煎煮化皮,分析驴皮出胶率、提取物的氨基酸组成和蛋白质分子质量分布,研究浓缩熬煮时间对产物的蛋白质分子质量分布、颜色和流变学特性的影响,从而研究化皮和浓缩过程中蛋白质特性的变化,为阿胶加工工艺的改进和阿胶品质的提升提供试验依据。
1 材料与方法
1.1 材料与仪器
驴皮由东阿阿胶股份有限公司提供。
牛血清白蛋白:创赛科技有限公司;盐酸、碳酸钠、磷酸氢二钠、磷酸二氢钠等试剂均为国产分析纯。
AL204 电子天平,梅特勒-托利多仪器(上海)有限公司;高效液相色谱仪Agilent 1260,美国安捷伦公司; 多角度激光散射凝胶色谱仪DAWN HELEOS Ⅱ,美国怀雅特技术公司;高精度分光测色仪Ultra Scan Pro 1166,美国Hunterlab 公司;立式压力蒸汽灭菌器,上海申安医疗器械厂;流变仪Discovery DHR-2,美国TA 仪器公司。
1.2 自制阿胶加工工艺
清洗: 将干驴皮用清水冲洗至水中无砂土,清水浸泡2d,每半天换水一次。 待皮泡软后用刀片将驴毛及附肉除去,清洗切割为10 cm×10 cm 方块。
掇皮:将切割为方块的驴皮置于2%碳酸钠溶液加热煮沸,至驴皮打卷时捞出,去除脂肪和上皮层角质;再将驴皮于90 ℃热水中清洗,去除热溶性油脂。
化皮:清水清洗后,加4 倍水(相对于干驴皮)于高压蒸汽灭菌器中一定温度和一定时间加压化皮。 分别在105,110,115,120,125 ℃下化皮1.0 h,取胶液,过200 目筛。残余皮料加4 倍水(相对于干驴皮),重复化皮。 合并两次化皮得到的胶液,离心(4 500 r/min,10 min), 取澄清液。 另取驴皮在115℃条件下分别化皮0.5,1.0,1.5,2.0,2.5 h,重复化皮后取澄清液。
浓缩:将化皮过滤后的澄清胶液,置于平底锅中,电磁炉文火熬煮并不断搅拌(100 r/min),熬煮一定时间后取样。 所得样品均冷冻干燥后保存[7]。
1.3 出胶率的测定
出胶率的计算公式
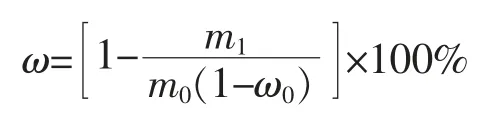
式中,ω——出胶率;m1——化皮后残渣的干基质量,g;m0——干驴皮的质量,g;ω0——干驴皮的水分含量,%。
按上述公式计算在不同化皮压力、不同化皮时间下驴皮的出胶率。
1.4 氨基酸组成分析
精密称取样品于水解管中, 加入8 mL 盐酸溶液(6 mol/L),将水解管抽真空密封,于120 ℃烘箱中水解21 h。 取出后冷却,加入氢氧化钠溶液中和酸液后定容至25 mL,双层滤纸过滤。混匀,12 000 r/min 离心10 min,将上清液移至液相小瓶中待测。
采用OPA-PMOC 柱前衍生化分析方法。 色谱柱:C18柱(250 mm×4.6 mm,5 μm);柱温:40 ℃;流动相:A 相,20 mmol/L 醋酸钠溶液;B 相,20 mmol/L醋酸钠、甲醇、乙腈(体积比为1 ∶2 ∶2);流速:1.0 mL/min;检测器:紫外检测器338,262 nm(Pro 和Hyp);梯度洗脱[8]。
1.5 蛋白质分子质量分析
试验条件:采用多角度激光光散射凝胶色谱系统测定蛋白质分子质量分布。流动相:含0.15 mol/L氯化钠的0.05 mol/L 磷酸盐缓冲液 (pH 7.0)(含2‰叠氮化钠);流速:0.35 mL/min,紫外检测器220 nm。 用牛血清白蛋白(Mw=77 ku)校准仪器[9]。
称取适量冻干样品溶解于流动相, 配制成1 mg/mL 的样品溶液, 过0.45 μm 微孔滤膜后进行HPSEC-RI-MALLS 分析。采用ASTRA 软件进行数据处理。 dn/dc 值取0.180[10]。
1.6 颜色分析
阿胶溶液色度值的测定:配制5%的阿胶水溶液,4 000 r/min 离心5 min,取上清液于色差计的样品皿中,记录L*、a*、b*值,重复测定3 次。
1.7 流变学特性分析
取适量阿胶粉末于热水中充分溶解, 配制成10%的阿胶水溶液。 采用Flow Ramp 模式测定阿胶溶液表观黏度随剪切速率变化的曲线。 测定条件:温度25 ℃,40 mm 平板,剪切速率为10~300 s-1,对数取点。
2 结果与分析
2.1 不同化皮条件下驴皮的出胶率
化皮是在一定的温度(压力)和时间下对经过前处理的驴皮提取胶原蛋白的过程,化皮的溶解物与化皮前物质的质量比即为出胶率。出胶率是阿胶生产厂家最为关心的产量和质量的权衡问题。
化皮时间为1.0 h 时,不同化皮温度(105,110,115,120,125 ℃)条件下的出胶率如图1 所示。 可以发现,在105~120 ℃范围内,随着化皮温度的增加,出胶率逐渐增大至78%左右,温度继续增加,出胶率也会有一定程度的增大。这表明随着化皮温度逐渐增加, 驴皮中胶原蛋白的三螺旋结构坍塌瓦解,胶原蛋白逐渐转化为水溶性明胶[11-12],体系中主要是蛋白质的提取过程;但温度继续升高,又会有少量的蛋白质溶出。
化皮温度为105 ℃时,不同化皮时间(0.5,1.0,1.5,2.0,2.5 h)下的出胶率如图2 所示。 结果表明,随着化皮时间的增加,出胶率逐渐增大至78%左右后趋于稳定,当化皮时间达1.0 h,出胶率即可达到最大值,表明化皮时间为0.5~1.0 h,体系中主要是蛋白质的提取过程[13]。 但时间超过1.0 h,提取蛋白质的作用不再明显。 这表明,在105~115 ℃化皮温度范围内和0.5~1.0 h 化皮时间范围内, 化皮温度和化皮时间的增加会使出胶率升高,但超过这一临界点,出胶率不再增加或增加不明显。

图1 不同化皮温度下的出胶率Fig.1 The yield at different extraction temperature
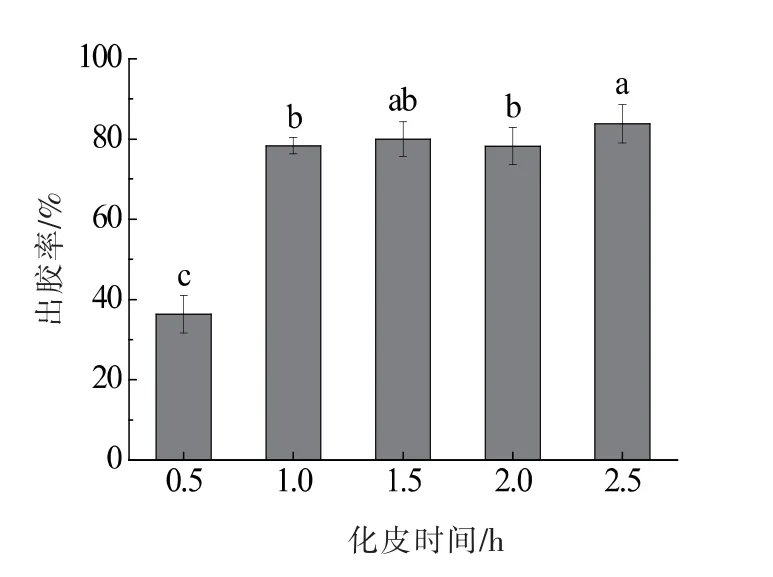
图2 不同化皮时间下的出胶率Fig.2 The yield at different extraction time
2.2 不同化皮条件对驴皮提取物氨基酸组成的影响研究
化皮条件的不同会影响出胶率的高低, 但提取出的物质是否为非胶原类的杂蛋白或其它种类的物质尚未有报道。
不同化皮条件处理驴皮得到的水解物氨基酸组成如表1 所示, 结果以每种氨基酸占总氨基酸的含量百分比表示。 结果显示,不同化皮温度和化皮时间生产的阿胶,其氨基酸组成非常接近,这表明, 不同化皮条件下提取出的蛋白质种类没有明显差别。 此外,在化皮温度增加至125 ℃时,出胶率显著增加,并非有杂蛋白溶出。
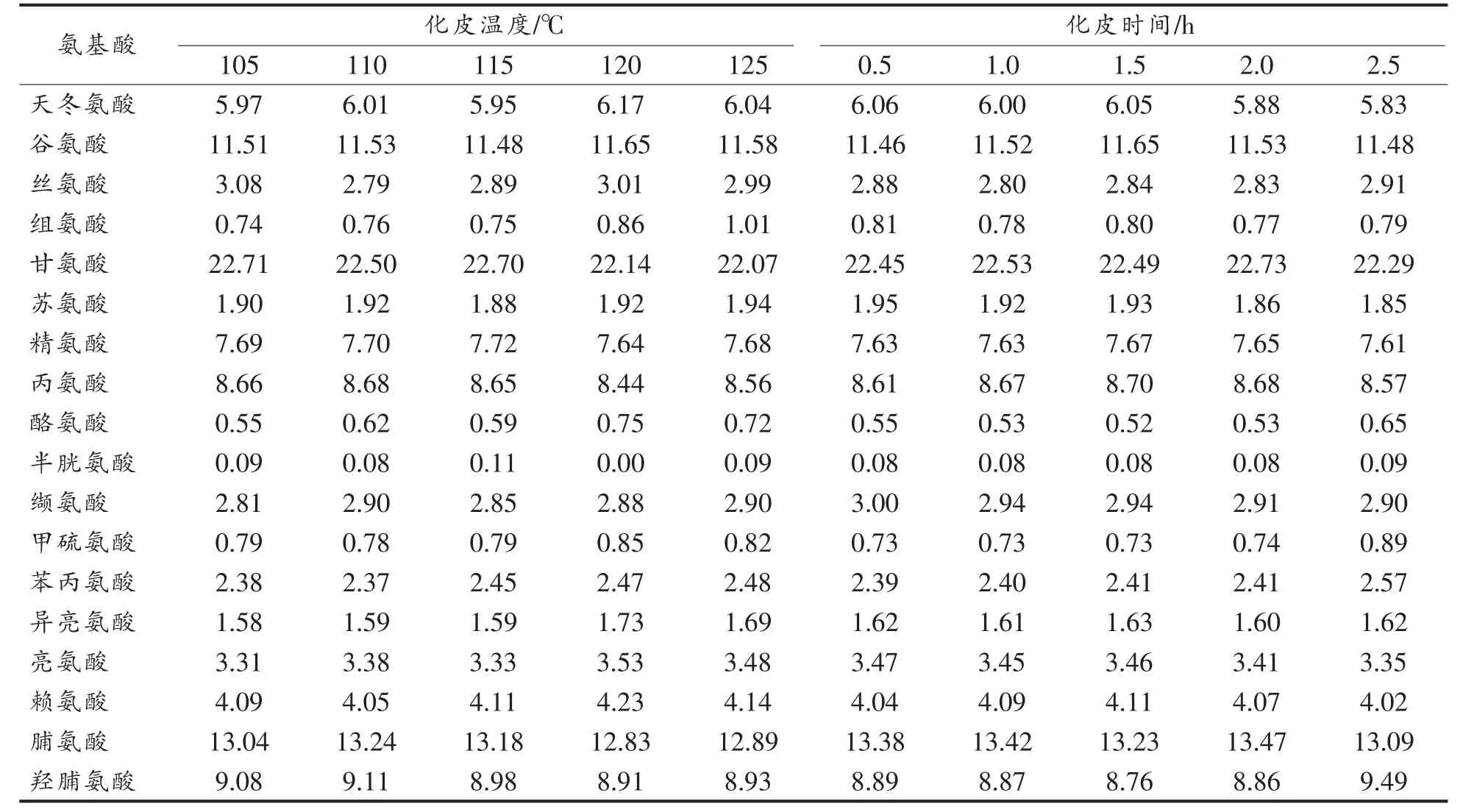
表1 不同化皮温度和时间下水解物的氨基酸组成(%)Table 1 Amino acid composition of hydrolysates at different extraction temperature and time (%)
2.3 不同化皮和浓缩条件对驴皮提取物蛋白质分子质量分布的影响
化皮是在较高温度(压力)下提取驴皮中的胶原蛋白,不同的提取温度(即压力)和提取时间可能会影响提取物的分子质量[14]。
对驴皮在不同温度下化皮相同的时间(1.0 h)后,分析其提取物的分子质量分布,结果如图3所示。 不同的温度下提取物命名为P105、P110、P115、P120、P125。 将分布曲线按峰形和分子质量大小分为三部分, 分别为HMW 区 (分子质量>1 500 ku)、MMW 区(分子质量为30~1 500 ku)、LMW 区(分子质量<30 ku), 用ASTRA 软件计算出各区域的重均分子质量和所占比例,结果见表2。
结果显示,随着化皮温度的增加,提取出的蛋白质中,HMW 区的重均分子质量逐渐增大(1 591~3 025 ku)。造成这种现象的原因可能是化皮温度较低时, 驴皮中较短链的蛋白质先溶于水中,因此体系中的低分子质量蛋白质较多;而化皮温度较高时, 可以使较难溶解的较长链蛋白质溶于水,体系中的高分子质量蛋白质较多,有文献报道[15]较高压力下蛋白质的聚集现象会抑制驴皮中的胶原纤维蛋白质的降解作用, 故驴皮中高分子质量蛋白质不需经降解为短链而提取出来。 因此较低温度下提取驴皮中的胶原蛋白, 更易提取出短链蛋白质。 化皮温度由110 ℃增大至125 ℃,LMW 区的占比由10.31%增大至22.61%, 在这一温度段内, 化皮温度的增大同时会导致已经提取出的HMW 和MMW 区的较大分子蛋白降解为较小分子的蛋白质。
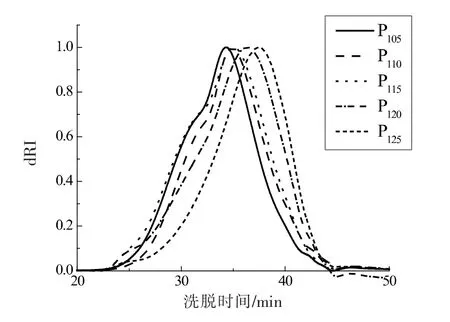
图3 不同化皮温度下提取物的分子质量分布Fig.3 Molecular weight distribution of extracts with different extraction temperature

表2 不同化皮温度下提取物的各区域分子质量及所占比例Table 2 Molecular weight and the proportion in each region of extracts at different extraction temperature
对驴皮在相同温度(115 ℃)下化皮不同的时间后,分析其提取物的分子质量分布,结果如图4所示。 不同时间的提取物命名为T0.5、T1.0、T1.5、T2.0、T2.5。 将分布曲线按峰形分为三部分,分别为HMW区 (分子质量>1 500 ku)、MMW 区 (分子质量为30~1 500 ku)、LMW 区(分子质量<30 ku),用ASTRA 软件计算出各区域的重均分子质量和所占比例,如表3 所示。
结果显示,化皮时间较短时(0.5 h),HMW 区域的蛋白质占比仅为0.21%,较其余样品小,可能是由于较短时间化皮时, 体系中主要发生的是胶原蛋白的提取过程, 分子质量较小的蛋白质先溶解于水中,体系中低分子蛋白质含量多[5]。
在一定的化皮温度(115 ℃)和化皮时间(1.0 h)下,对驴皮提取物进行浓缩熬煮,在不同的浓缩时间下的产物分别命名为N0、N4、N8、N12、N16、N20。其分子质量分布曲线如图5 所示。由ASTRA 软件计算出HMW 区、MMW 区和LMW 区的重均分子质量和占比,结果如表4 所示。
由图5 可以得出,随着浓缩的时间逐渐延长,高分子蛋白质峰逐渐减小直至消失, 峰形逐渐右移。 由表可知,HMW 区的蛋白含量逐渐减少(由25.24%减少至1.91%),MMW 区域的蛋白质含量逐渐增加(由70.22%增加至95.45%),Mw 逐渐减小(由71 ku 降至38 ku),这表明浓缩工艺是蛋白质降解的重要阶段, 可以使高分子蛋白质降解,Mw 减小。 同时,即使在化皮时产生了较多的高分子蛋白质,也可以经浓缩工艺得到充分降解,决定阿胶蛋白质分子质量分散程度的关键因素是浓缩时间。 浓缩工艺主要的作用是使MMW 区的蛋白质Mw 减小, 同时使提取出的蛋白质分子质量分布更集中。
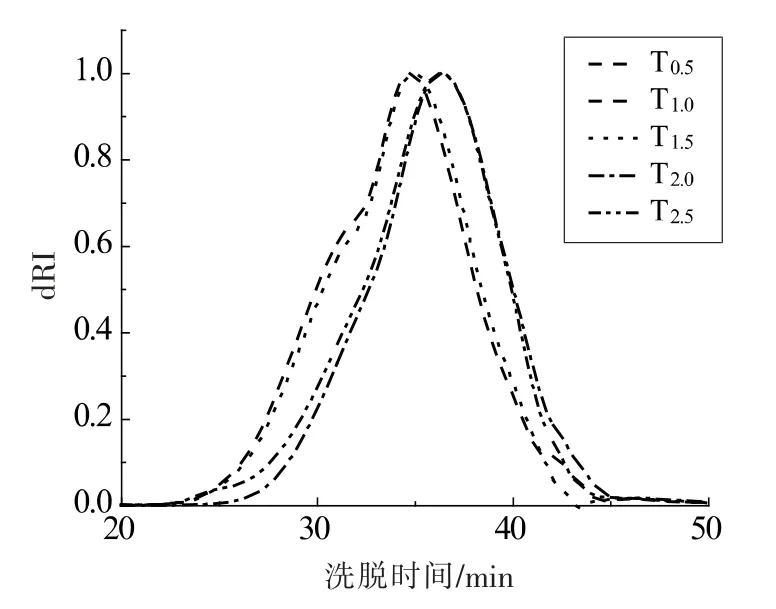
图4 不同化皮时间下提取物的分子质量分布Fig.4 Molecular weight distribution of extracts at different extraction time

图5 不同浓缩时间下产物的分子质量分布Fig.5 Molecular weight distribution of products at different concentration time
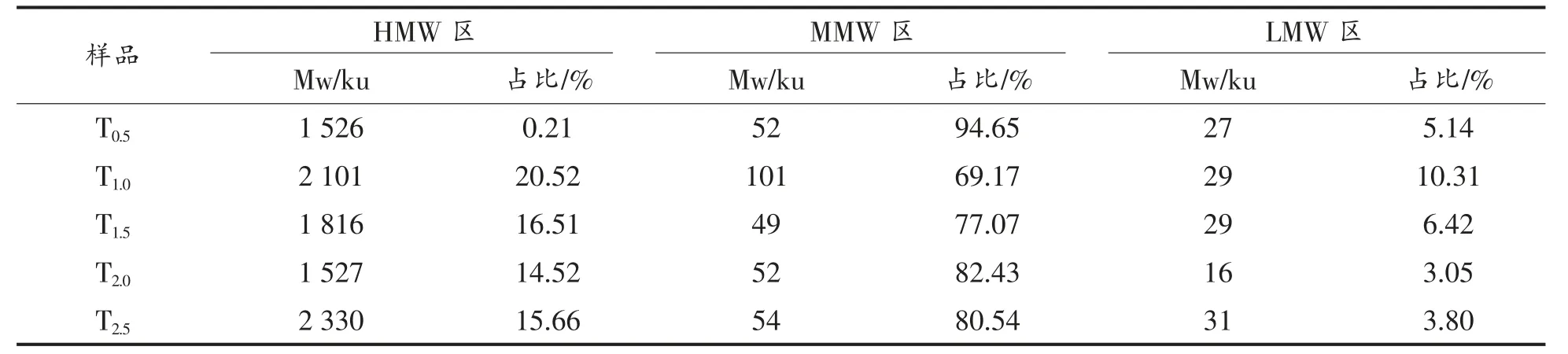
表3 不同化皮时间下提取物的各区域分子质量及所占比例Table 3 Molecular weight and the proportion in each region of extracts at different extraction time
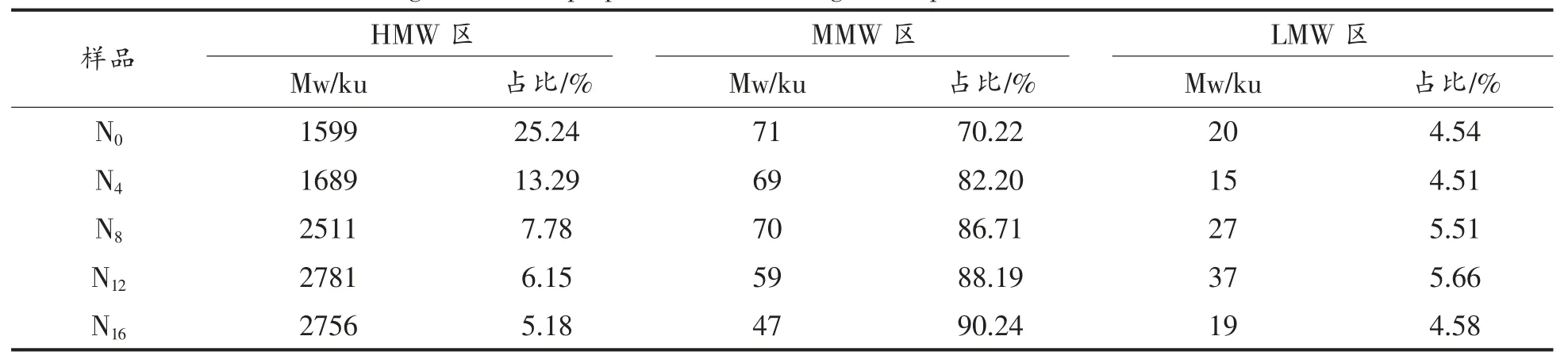
表4 不同浓缩时间下产物的各区域分子质量及所占比例Table 4 Molecular weight and the proportion in each region of products with different concentration time
2.4 不同化皮和浓缩条件对驴皮提取物颜色的影响
大量的研究表明, 提取条件的不同会导致明胶的颜色差异,从而决定了其品质和应用方向。 对于驴皮胶原蛋白降解产物, 其颜色可能也会受到加工工艺的影响,进而影响阿胶的品质。
对驴皮进行前处理后, 经不同化皮条件和浓缩时间处理后制得的阿胶半成品胶液, 对胶液进行颜色分析,结果如表5 和表6 所示。经不同化皮条件处理后再浓缩熬煮而成的胶液命名为PN105、PN110、PN115、PN120、PN125、PN105、TN0.5、TN1.0、TN1.5、TN2.5。结果表明,经不同化皮温度处理的产物,其L*、a*、b*值均无显著性差异, 表明化皮工艺中温度的改变对颜色影响很小;而随着化皮时间的延长,胶液的b*值显著增加,颜色逐渐变黄。
随着浓缩时间的延长,L*值、b*均显著增长,即胶液的亮度逐渐增大,胶液越来越透亮,这与胶越熬越透亮的经验之谈相吻合。 而黄值增加的原因尚不明确,有待进一步研究。
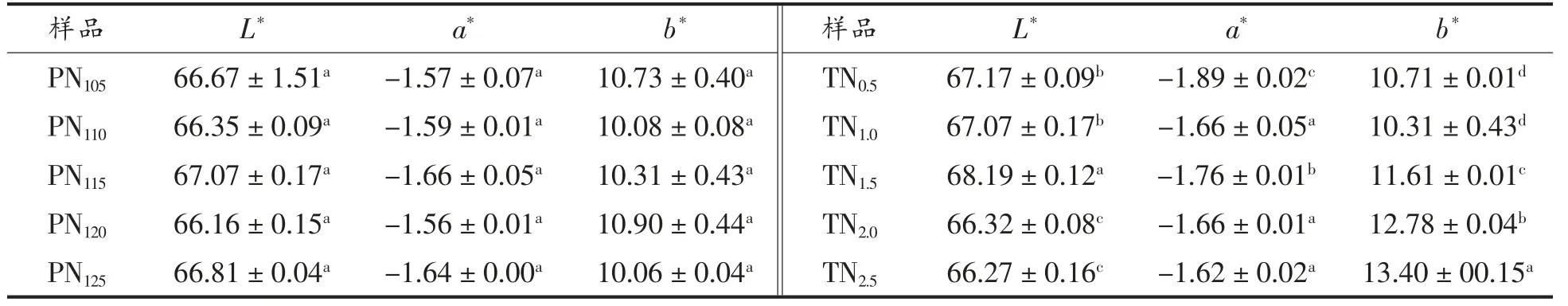
表5 不同化皮条件下胶液的颜色Table 5 Color values of solutions at different extraction temperature and time
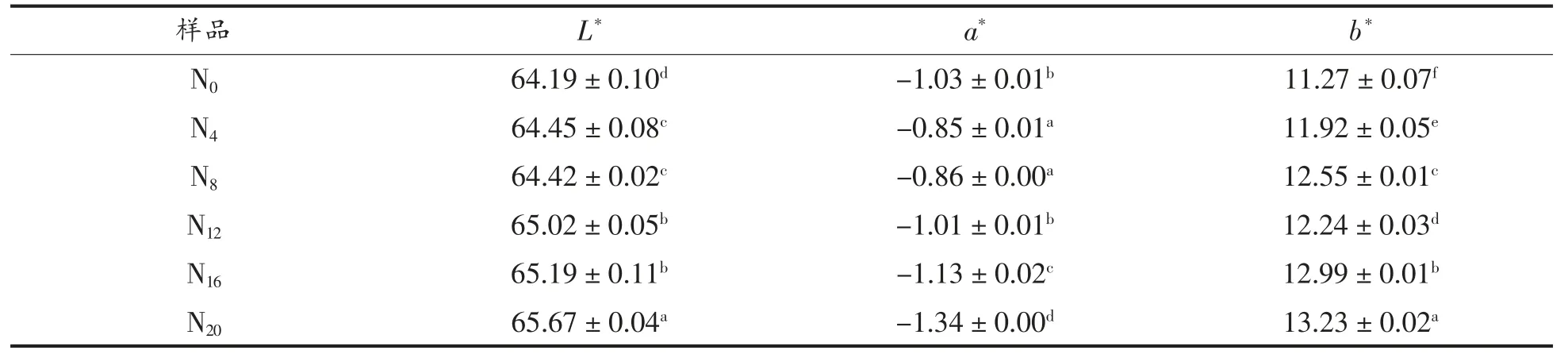
表6 不同浓缩时间下胶液的颜色Table 6 Color of solutions at different concentration time
2.5 不同化皮和浓缩条件对驴皮提取物流变学特性的影响
通过对不同化皮和浓缩条件制得的阿胶胶液进行流变学特性分析,其非牛顿指数和黏度(剪切速率为20 s-1)如表7 所示。
可以发现, 不同化皮温度和时间对胶液的黏度和非牛顿指数影响不大; 不同化皮时间制得的胶液,其黏度和非牛顿也无明显差异,因此化皮条件的不同不会明显改变流变学特性。
不同浓缩时间对胶液的非牛顿指数n 和黏度(剪切速率为20 s-1)结果如表8 所示。 由表可以看出,在0~8 h 范围内,随着浓缩时间的延长,胶液的黏度大幅减小,n 值也逐渐接近于1。可见,0~8 h 的浓缩时间对胶液的流变学特性影响最大。 但当浓缩时间延长至8~20 h, 其黏度和非牛顿指数无明显差异。
3 结论
本文通过研究驴皮在不同的化皮和浓缩条件下产物的蛋白质特性, 结果发现出胶率随化皮温度和时间的增加而增大, 但增大到115 ℃和1.0 h,出胶率无明显增大或增大幅度很小。 氨基酸组成分析结果表明在105~125 ℃的化皮温度和0.5~2.5 h 的化皮时间范围内,并未提取出种类不同的蛋白质。 化皮温度和时间对提取物的蛋白质分子质量分布有一定的影响, 较高的化皮温度会导致驴皮中的高分子蛋白质不需经降解为短链就被提取出来, 同时会对已经提取出的较大分子蛋白有一定的降解作用。 较短的化皮时间(0.5 h)较先提取出低分子蛋白。 浓缩时间对提取物有较大程度的降解作用,浓缩时间逐渐延长,可以使得体系中的分子质量分布更加集中。 化皮温度和时间的不同对胶液的颜色和流变学特性几乎无影响, 而浓缩时间增大会使得胶液亮度显著增大, 黏度明显下降。
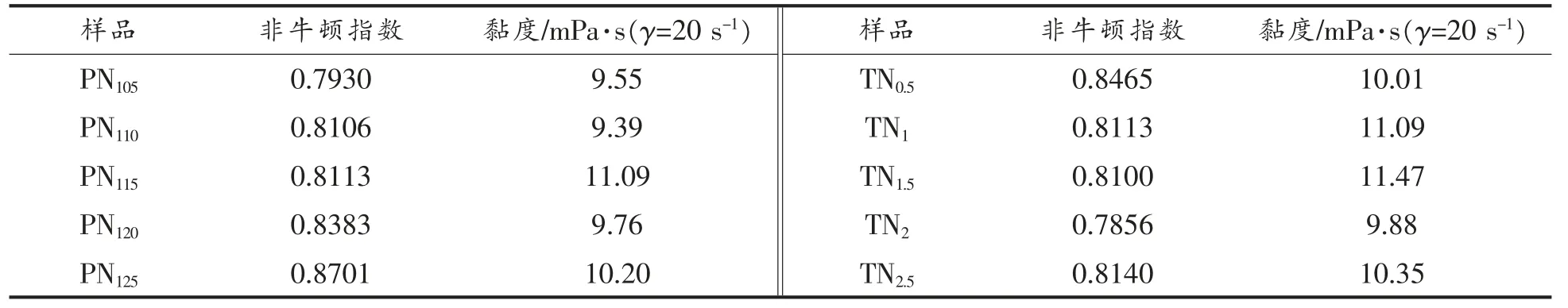
表7 不同化皮温度和时间下胶液的流变学特性Table 7 Rheological properties of solutions at different temperature and time
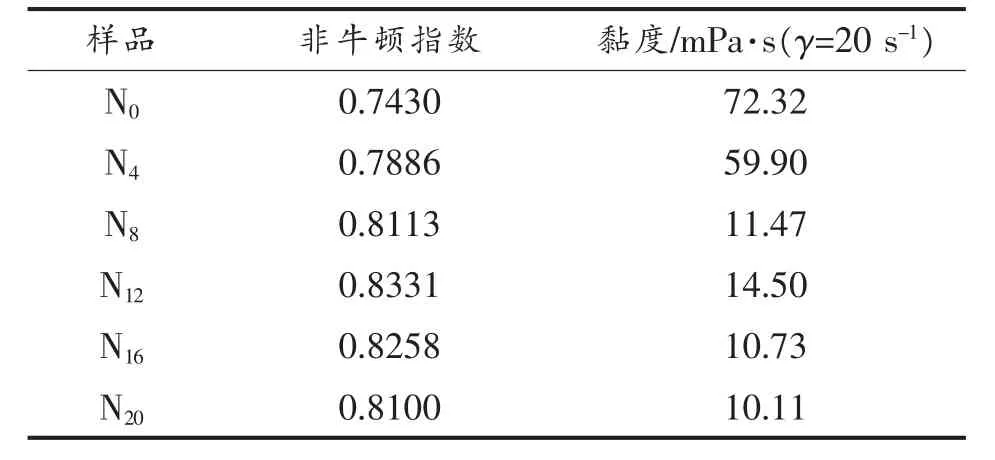
表8 不同浓缩时间下胶液的流变学特性Table 8 Rheological properties of solutions with different concentration time
