紫苏发酵乳体外抗氧化活性的研究
2019-07-30田海娟罗佳孙宇张传智潘艳张艳
田海娟,罗佳 ,孙宇,张传智 ,潘艳,张艳
(1.吉林工商学院粮油食品深加工吉林省高校重点实验室,吉林长春1300507;2.吉林工商学院粮食学院,吉林长春 130507)
0 引 言
紫苏(Perilla frutescens(L.)Britt,我国研究紫苏已有20多年的历史,紫苏籽提油后的紫苏饼粕中含有丰富的活性成分,如α-亚麻酸、亚油酸、油酸、蛋白质及氨基酸[1],另外还含有膳食纤维、谷维素、维生素F、维生素B1、甾醇、磷脂等。目前紫苏籽粕主要用作饲料,对紫苏籽粕中营养成分的利用率较低,造成了浪费。开菲尔(Kefir)是一种以牛乳或羊乳为原料,利用开菲尔粒发酵制得的复合型发酵乳。其军种为Kefir颗粒,是一个复杂的微生物共生体系,主要由乳酸菌、酵母菌和醋酸菌的某些属种组成[2]。开菲尔发酵乳具有缓解乳糖不耐症、调节胃肠道功能、刺激免疫系统和加速胆固醇代谢等功效[3]。开菲尔有很多潜在功效,为今天备受青睐的健康食品开发提供新的思路。用开菲尔菌加工紫苏籽粕发酵乳,可以得到效用更高,且具有紫苏特有香味的风味发酵乳。
目前,对紫苏抗氧化性的相关研究很多,但大多集中在其根、茎、叶中[4-7]。从自由基这方面来研究食物的营养与食疗效用,具备重要的理论意义和普遍的应用价值。羟基自由基(·OH)是活性氧中最活泼的自由基之一,对人体的毒性相当大,可以直接损伤各种生物膜,使得多种疾病并发,从而危及生物体[8]。DPPH(分子式C12H12N6O6,Mr=394.32)自由基是一种人工合成的有机自由基,性质稳定。其乙醇溶液呈深紫色,并在515~520 nm有最大吸收峰。在DPPH溶液中加入自由基清除剂,深紫色溶液褪成黄色,其褪色程度与自由基所接受的电子数量成定量关系,因此能够通过溶液吸光度的变化来进行定量分析[9]。试验以提油后的紫苏籽粕为原料,经低温超微粉碎,用开菲尔菌作为发酵剂,制备紫苏发酵乳,以·OH清除率、DPPH自由基清除率为指标,研究紫苏发酵乳体外抗氧化活性的规律,为高效利用紫苏籽粕,开发品质稳定性较高的紫苏健康食品提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 材料与试剂
紫苏籽:洮南市百群食品科技有限公司;纯牛奶:广泽乳业有限公司;纤维素酶:河南祥盛食品配料有限公司;开菲尔菌:北京川秀科技有限公司;DPPH:上海源叶生物科技有限公司;无水乙醇:北京化工厂,分析纯;硫酸亚铁:天津市光复科技发展有限公司,分析纯;过氧化氢:开原化学试剂一厂,分析纯;水杨酸:天津市华东试剂厂,分析纯。
1.1.2 主要仪器设备
4A220-50-06超临界萃取装置,江苏南通市华安超临界萃取有限公司;SQW-601三清超微粉碎机,济南易辰超微粉碎技术有限公司;LBJ-625A食品粉碎器,广东洛贝电子科技有限公司;HH-2K4二列四孔水浴,巩义市予华仪器有限责任公司;Agilent Cary 60 UV-Vis紫外-可见分光光度计,美国安捷伦科技公司。
1.2 试验方法
1.2.1 开菲尔菌扩大培养
用蒸馏水冲洗开菲尔菌,至其洁净,置于玻璃杯中,向其中倒入纯牛奶,漫过菌种,盖上纱布,套上橡皮筋,置于恒温培养箱中,30℃培养24 h。
1.2.2 原料预处理
紫苏籽经超临界CO2技术(压力:25 MPa,温度:40℃,流量:20 L/h,1 L萃取釜萃取90 min)萃取紫苏籽油,剩下的紫苏籽粕经超微粉碎处理,冷冻保藏。将适量紫苏粕置于粉碎器中粉碎,然后过80目筛,冷藏。在烧杯中加入20 g紫苏籽粕,再用200 g水将其溶解,并添加一定量的纤维素酶,搅拌均匀,置于60℃水浴锅中酶解。3 h后取出,静置。
1.2.3 单因素与正交试验设计
取一定量的紫苏酶解液,再加入开菲尔菌、蔗糖,加牛奶至50 mL,搅拌均匀,于25℃恒温培养箱中培养一定时间,取出后将发酵乳过滤,回收开菲尔菌、重复利用。控制蔗糖添加量为12%,酶解液含量为25%,培养时间12 h,开菲尔菌接种量分别设为4%、6%、8%、10%、12%,培养紫苏发酵乳。控制开菲尔菌接种量为8%,酶解液含量为25%,培养时间12 h,蔗糖添加量分别为8%、10%、12%、14%、16%,培养紫苏发酵乳。控制开菲尔菌接种量为8%,蔗糖添加量为12%,培养时间12 h,酶解液含量分别为15%、20%、25%、30%、35%,培养紫苏发酵乳。控制开菲尔菌接种量为8%,蔗糖添加量为12%,酶解液含量为25%,培养时间分别设为8 h、10 h、12 h、14 h、16 h,培养紫苏发酵乳。由于各因素条件在实际发酵酸奶时会相互影响,所以根据单因素试验结果,设计正交试验,通过正交试验确定紫苏发酵乳体外抗氧化活性的最佳工艺组合。
1.2.4 抗氧化活性测定
(1)羟基自由基清除率的测定。
称取0.1668 g七水硫酸亚铁颗粒,用蒸馏水定容至100 mL,得到浓度为6 mmol/L的硫酸亚铁溶液;量取30%的过氧化氢0.06 mL加水配制成100 mL的6 mmol/L的双氧水溶液;称取0.0829 g水杨酸用无水乙醇溶解,定容至100 mL,得到6 mmol/L的水杨酸溶液。
参考彭惠惠[10]等人的方法,在1.5 mL离心管中依次加入6 mmol/L硫酸亚铁溶液300μL、紫苏发酵乳样品300μL、6 mmol/L过氧化氢溶液300μL,摇匀,静置10 min后再加入6 mmol/L水杨酸溶液300μL,摇匀,静置30 min,然后在510 nm波长下测其吸光度。做平行试验重复测定3次。
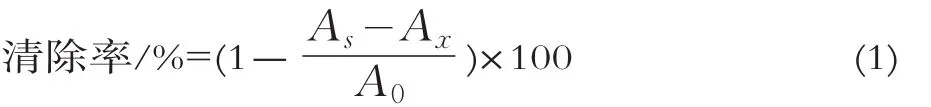
式中:A0为不加发酵乳样品液的本底吸光度;AS为加入发酵乳样品液反应后的吸光度;Ax为不加水杨酸溶液的吸光度。
(2)DPPH自由基清除率的测定[11]。
准确称取0.8 mg DPPH,用无水乙醇定容于10 mL容量瓶中,得到浓度为0.2 mmol/L的DPPH溶液。利用DPPH溶液在517 nm下具有最大的紫外吸收峰,测定加入紫苏发酵乳样品后A517 nm吸收的下降表示其清除DPPH自由基的能力。
取400μL的发酵乳样品于1.5 mL离心管中,再加入2×10-4mol/L的DPPH无水乙醇溶液400μL,混匀,室温避光反应30 min,然后测定波长517 nm处的吸光度Ai,同时测定400μL发酵乳样品液+400μL无水乙醇混合后的吸光度Ai和400μL DPPH无水乙醇溶液+400μL无水乙醇的吸光度A0。做平行试验重复测定3次。

1.3 数据分析与处理
图表中数据为三次平行试验检测数据的平均值,误差为标准偏差。所得数据用Microsoft Excel软件进行计算、制图整理,用SPSS17.0软件进行方差分析。
2 结果与分析
2.1 紫苏粕发酵乳单因素试验结果与分析
2.1.1 开菲尔菌接种量对紫苏粕发酵乳体外抗氧化性的影响
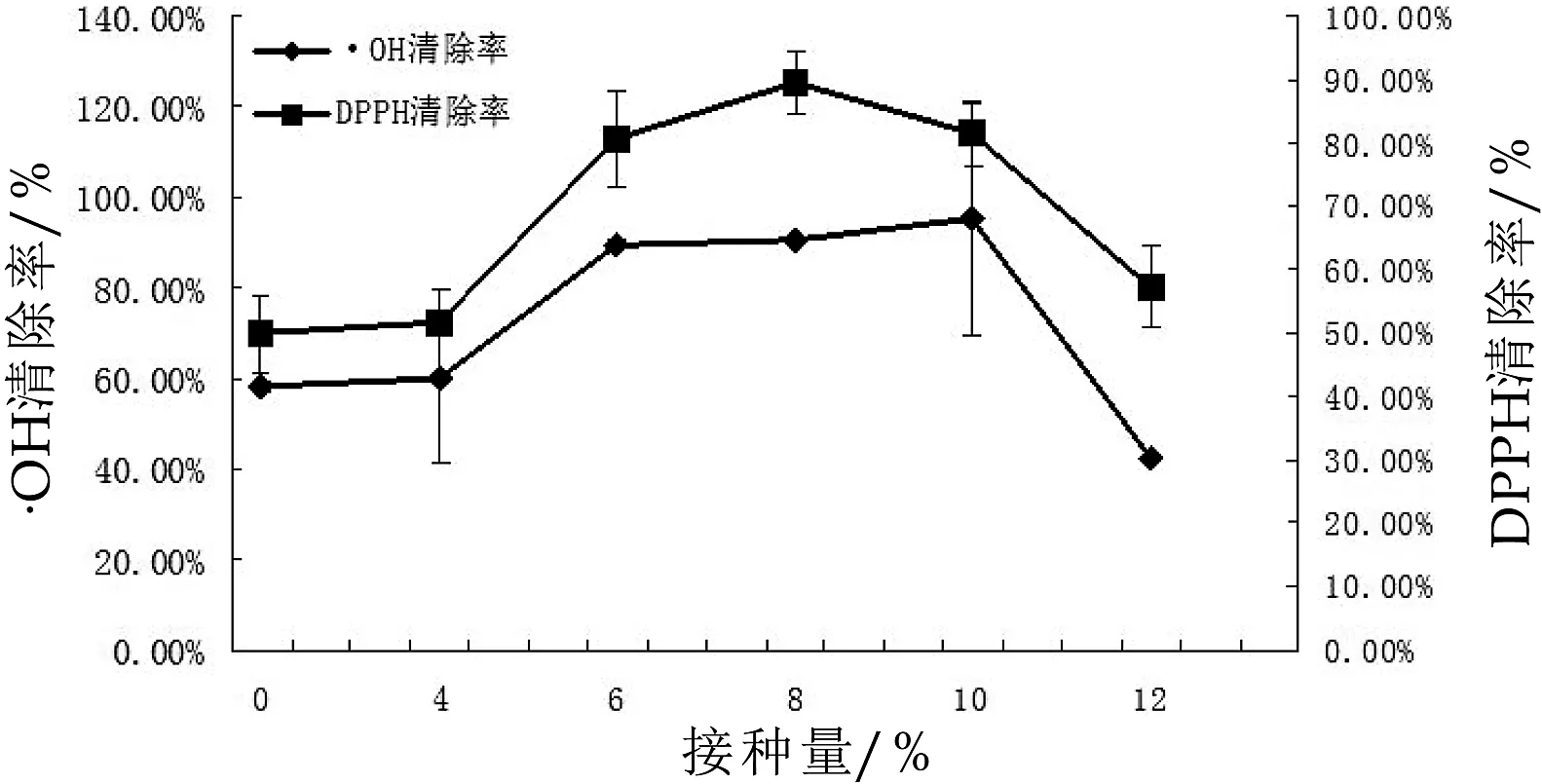
图1 接种量对紫苏粕发酵乳体外抗氧化性的影响
由图1可得,未接种开菲尔菌的紫苏发酵乳与开菲尔菌接种量为4%的紫苏发酵乳的羟基自由基清除率相差不大,DPPH自由基清除率也相差不大。接种后,随着接种量的增加,发酵乳的·OH清除率和DPPH自由基清除率均急剧提高再降低。当开菲尔菌接种量为10%时,·OH清除率最高,为(95.31±25.96)%;当开菲尔菌接种量为8%时,紫苏发酵乳的DPPH自由基清除率最高,为(89.47±5.16)%。推测可能是因为紫苏发酵乳中接入的开菲尔菌对其抗氧化性有协同提高作用。试验选取开菲尔菌接种量6%、8%和10%作为正交试验中该因素的3个水平。
2.1.2 加糖量对紫苏粕发酵乳体外抗氧化性的影响
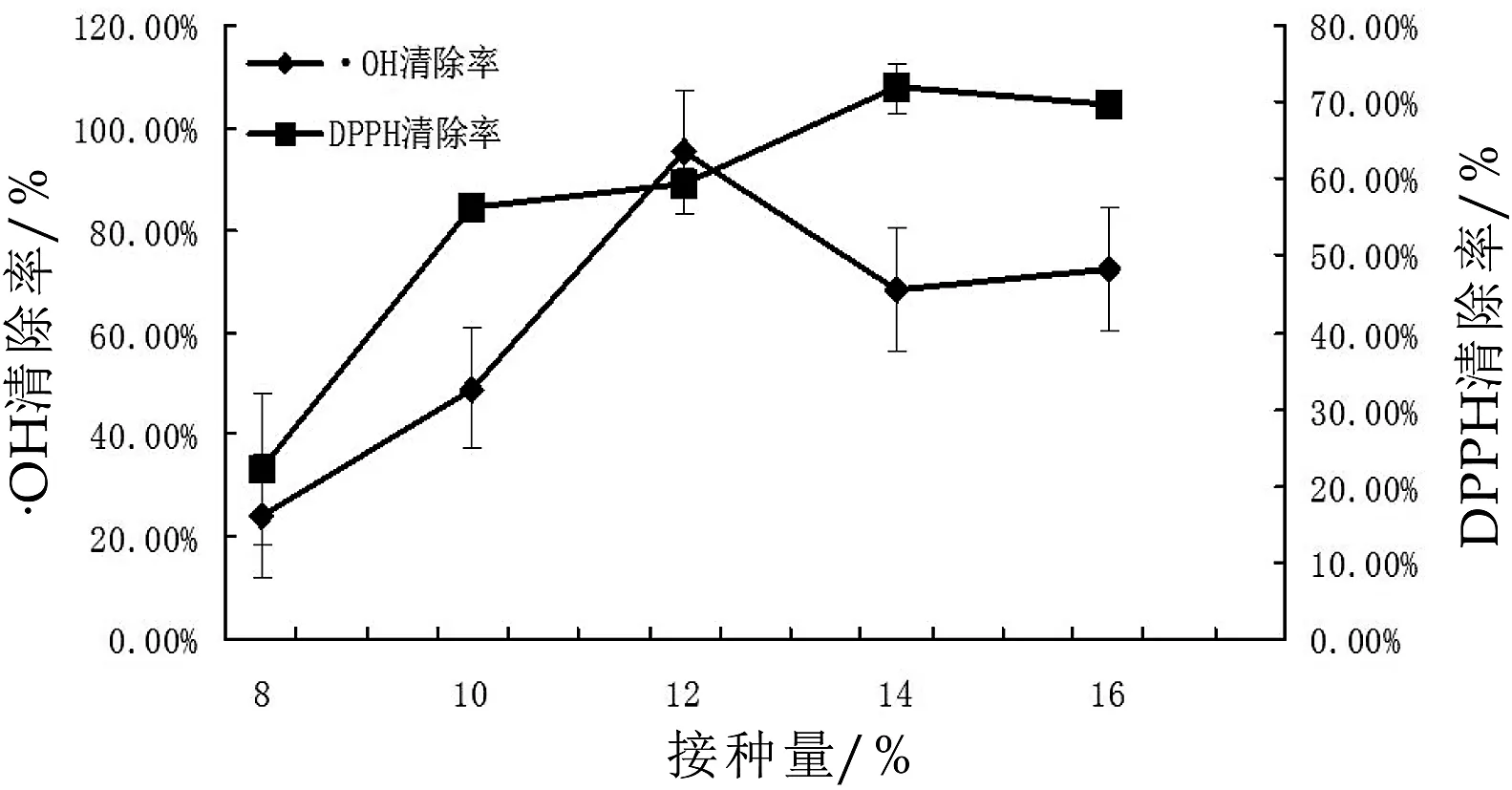
图2 加糖量对紫苏粕发酵乳体外抗氧化性的影响
蔗糖具有还原性可被氧化,具有一定的抗氧化能力,所以选取该因素进行单因素试验。由图2可得,试验制备的发酵乳用开菲尔作为发酵剂,在发酵过程中产生大量乳酸而导致产品口感过于酸,课题组经过反复试验,确定了加糖量的适宜范围为10%左右,为进一步研究加糖量对发酵乳体外抗氧化性的影响,单因素扩大了加糖量的范围至16%。随着加糖量的增多,紫苏发酵乳的·OH清除率急剧增大又减小,当加糖量为12%时,·OH清除率最高:(95.52±2.53)%,加糖量从12%增至14%时,·OH清除率迅速降低,加糖量增至16%时,与加糖量为14%时相比略有提高,但相差不大;随着加糖量的增多,紫苏发酵乳的DPPH自由基清除率迅速增大又渐趋平缓,加糖量为14%时,DPPH自由基清除率最高,为(71.79±3.16)%。所以猜测,加糖量较多时可以提高紫苏发酵乳的抗氧化性。试验选取加糖量12%、14%和16%作为正交试验中该因素的3个水平。
2.1.3 酶解液含量对紫苏粕发酵乳体外抗氧化性的影响

图3 酶解液含量对紫苏粕发酵乳体外抗氧化性的影响
由图3可得,随着发酵乳中紫苏酶解液含量的增加,紫苏发酵乳的·OH清除率急剧增大又迅速减小,当紫苏酶解液含量为25%时,·OH清除率最高,为(90.94±0.26)%;酶解液的含量从15%升到20%时,紫苏发酵乳的DPPH自由基清除率迅速提高了将近35%,之后随着酶解液含量的增加,DPPH清除率逐渐提高再降低,当紫苏酶解液含量为30%时,DPPH清除率最高,为(80.20±0.27)%。所以推测紫苏酶解液的加入可以提升紫苏发酵乳的抗氧化性。试验选取酶解液含量25%、30%和35%作为正交试验中该因素的3个水平。
2.1.4 培养时间对紫苏粕发酵乳体外抗氧化性的影响
由图4可得,随着培养时间的延长,紫苏发酵乳的·OH清除率迅速升高又急剧降低,当培养时间为12 h时,·OH清除率最高,为(45.75±3.57)%;培养时间从8 h延长至10 h,紫苏发酵乳的DPPH自由基清除率急剧增加,之后随着培养时间的延长,DPPH自由基清除率缓缓降低,所以,当培养时间为10 h时,DPPH自由基清除率最高,为(73.87±0.59)%。在发酵过程中,开菲尔菌也会吸收营养、生长扩大,所以推测随着培养时间的延长,大量营养物质被开菲尔菌代谢,影响了紫苏发酵乳的抗氧化活性。试验选取培养时间10 h、12 h和14 h作为正交试验中该因素的3个水平。
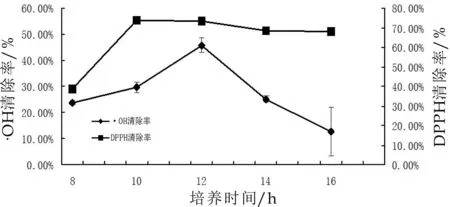
图4 培养时间对紫苏粕发酵乳体外抗氧化性的影响
2.2 正交试验结果及分析
由于各因素对紫苏发酵乳体外抗氧化活性的影响并不是单一线性的,实际上是受到开菲尔菌接种量、加糖量、紫苏酶解液含量和培养时间4个因素交叉影响,为了考察这4个因素对紫苏发酵乳抗氧化活性的交互影响,设计了正交试验(L9(34))进行实验,以紫苏发酵乳的羟基自由基清除率和DPPH自由基清除率为试验指标,正交试验因素和正交试验结果及极差分析见表1、表2,·OH清除率和DPPH自由基清除率的方差分析见表3、表4。
由表2可得,在正交试验的各因素中,酶解液含量、培养时间、开菲尔菌接种量、加糖量对紫苏发酵乳的抗氧化活性影响依次增大。通过比较指标总和与各因素的关系可看出影响紫苏发酵乳抗氧化活性的最佳的工艺条件组合是A3B1C2D1,即开菲尔菌接种量10%,加糖量12%,紫苏酶解液含量30%,培养时间10 h。
对正交试验结果进行方差分析(P<0.05),由表3可得,在正交试验的各因素中,加糖量对紫苏发酵乳的羟基自由基清除率有显著影响(P<0.05)。由表4可得,在正交试验的各因素中,开菲尔菌接种量、加糖量对紫苏发酵乳的DPPH自由基清除率有显著影响(P<0.05)。

表1 正交试验因素及水平
2.3 验证试验及结果
将正交试验所得的最佳工艺条件组合进行验证,在开菲尔菌接种量10%,加糖量12%,紫苏酶解液含量30%,培养时间10 h的工艺条件下制备紫苏发酵乳,测定其·OH清除率、DPPH自由基清除率,做三组平行试验进行验证,所得·OH清除率平均值、DPPH自由基清除率平均值分别为(97.64±0.63)%和(97.90±0.69)%。所以,开菲尔菌接种量10%,加糖量12%,酶解液含量30%,培养时间10 h即为比较稳定的较优生产条件。
3 结论
以提油之后的紫苏籽粕为原料,以开菲尔菌发酵紫苏酶解液,以羟基自由基(·OH)清除率、DPPH自由基清除率为考察指标,采用单因素法和正交试验法,对紫苏发酵乳的体外抗氧化活性工艺进行优化,研究了开菲尔菌接种量、加糖量、紫苏酶解液含量、培养时间对紫苏发酵乳的羟基自由基清除率、DPPH自由基清除率的影响,结果表明:加糖量对紫苏发酵乳的羟基自由基清除率有显著影响(P<0.05),开菲尔菌接种量、加糖量对紫苏发酵乳的DPPH清除率有显著影响(P<0.05)。所以,紫苏发酵乳的抗氧化活性的最佳生产工艺条件为:开菲尔菌接种量10%,加糖量12%,紫苏酶解液含量30%,培养时间10h,在此条件下所得紫苏发酵乳的抗氧化活性较高。

表2 L9(34)的正交试验结果及极差分析
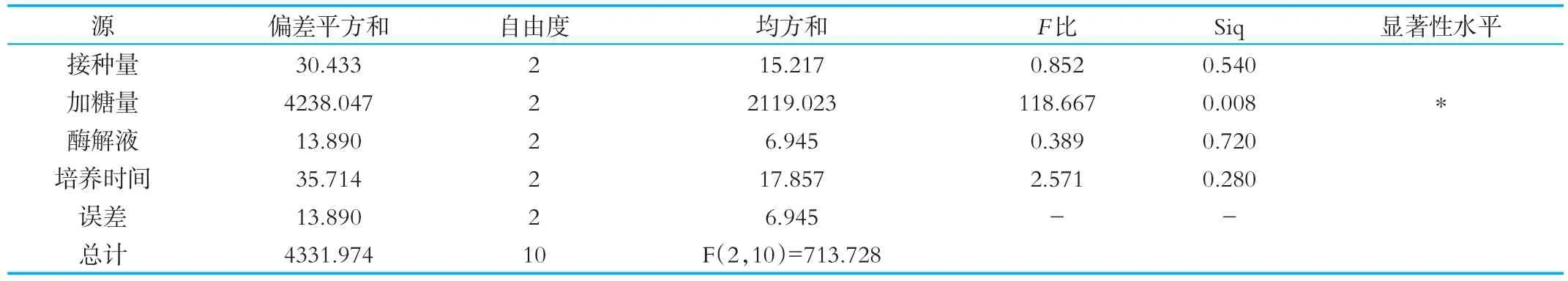
表3 正交试验羟基清除率方差分析

表4 正交试验DPPH清除率方差分析
