抗猫细小病毒嵌合抗体基因在昆虫细胞中的表达与鉴定
2019-07-30薛雨佳宋彩玲赵爽爽李彤彤王文静
薛雨佳,宋彩玲,赵爽爽,李彤彤,王文静,张 云,刘 明
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨150069)
猫细小病毒(Feline parvovirus,FPV)又名猫泛白细胞减少症病毒,最易感染断奶幼猫并造成幼猫的感染和高死亡率。犬细小病毒(Canine Parvovirus,CPV)2型,能够引起6周龄~6月龄快速生长的幼犬发生高死亡率的犬细小病毒病,是引发犬科动物传染性腹泻的重要病原[1]。FPV与CPV同属细小病毒科,二者的流行特征、临床症状、抗原性高度相似,均为引发宠物疾病的重要病毒。目前主要通过弱毒疫苗免疫来防控细小病毒病,但由于母源抗体干扰,流行株变化和畜主缺乏免疫意识往往造成疾病的发生和流行。FPV与CPV的对症治疗依赖于抗血清,而市售抗细小病毒血清多为单克隆抗体(Monoclonal antibody,MAb)或马血清,虽有一定的疗效但不能连续使用,也易造成过敏反应。同时异种动物抗体Fc段在犬、猫体内不能有效激活补体和Fc受体相关的效应系统,其治疗效果明显低于来源于同种动物的血清抗体。
本实验室前期制备了一株杂交瘤细胞株3EB,证实其分泌的MAb同时具有抗FPV和CPV的中和活性。本研究通过融合PCR构建了包含MAb 3EB可变区和犬天然抗体(NAb)恒定区的鼠-犬融合基因,克隆至杆状病毒载体后转染昆虫细胞[2-4]表达了鼠-犬嵌合抗体。相比于鼠源的MAb,本研究表达的嵌合抗体保留了原MAb对抗原的高亲和力,又因为其恒定区来源于犬NAb,能够大幅降低其在犬机体中引起的副反应,可以提高对CPV病的治疗效果。为进一步研制细小病毒临床治疗用药物奠定基础。
1 材料与方法
1.1 主要实验材料 3EB杂交瘤细胞株为本实验室制备,其同时对FPV、CPV具有中和活性;FPV、CPV病毒株为本实验室分离、纯化及保存;TRIzol试剂购自Invitrogen公司;M-MLV反转录酶、Ex-TaqDNA聚合酶、DL2000 DNA Maker、pMD18-T载体克隆试剂盒购自TaKaRa公司;FITC、HRP标记的兔抗犬IgG购自Sigma公司;琼脂糖凝胶回收试剂盒、质粒小量提取试剂盒购自AXYGEN公司;Sf9昆虫细胞培养基购自Gibco公司;BAC/PAC DNA Kit购自OMEGA公司;NAb Protein A/G Column抗体纯化柱购自Thermo公司;转染试剂Lipofectamine 2000购自Thermo公司;超滤离心管(0.5 mL 50 ku)购自密理博公司;pFastBac-Dual载体购自Invitrogen公司;F81(猫肾细胞)、Sf9细胞为本实验室保存;外周血淋巴细胞分离液购自Solarbio公司;LA-Bac 培养基由 100 μg/mL X-gal、40 μg/mL IPTG、50 μg/mL 卡那霉素、7 μg/mL 庆大霉素和 10 μg/mL四环素LB培养基组成。比格犬血液样品来自哈尔滨某宠物医院。
1.2 引物的设计与合成 根据MAb 3EB重链可变区(MH)基因(数据未给出),设计引物MH-F/MH-R扩增该MAb的MH基因;同时设计引物ML-F/ML-R扩增该MAb的轻链可变区(ML)基因;设计引物DH-L/DH-R扩增犬NAb重链恒定区(DH)基因(数据未给出),引物DL-F/DL-R扩增该Nab的轻链恒定区(DL)基因(数据未给出);图1为扩增MAb可变区、犬NAb恒定区重链、轻链引物设计示意图,序列见表1。引物由吉林库美生物公司合成。


表1 引物信息
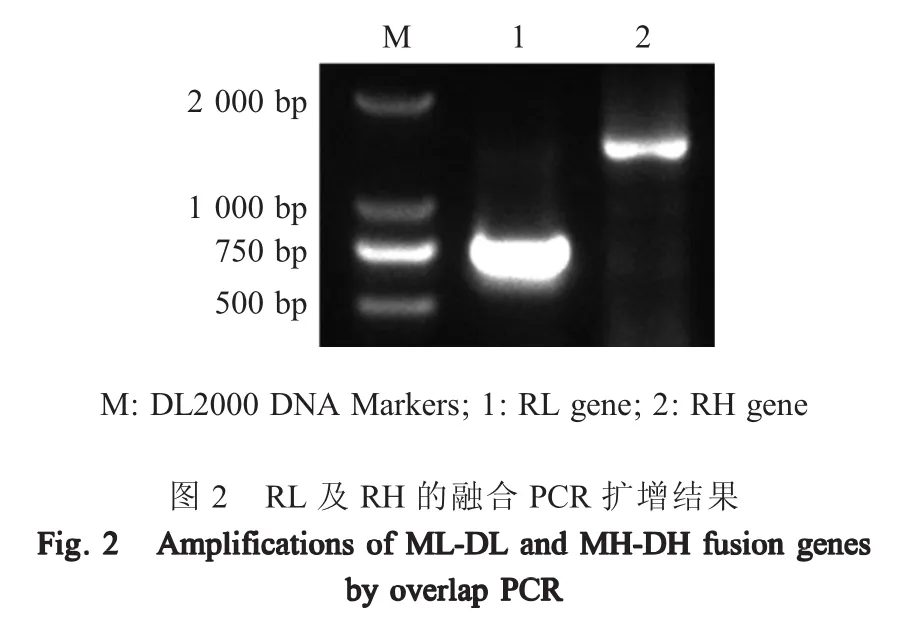
1.3 MAb、犬NAb重轻链基因的PCR扩增及融合PCR 采用TRIzol试剂提取3EB细胞株总RNA,反转录为cDNA,以其为模板,利用MH-F/R、ML-F/R引物对MAb的MH、ML基因进行PCR扩增;按照说明书使用外周血淋巴细胞分离液分离比格犬血液中的淋巴细胞,TRIzol试剂提取分离的淋巴细胞总RNA,反转录为cDNA后,以其为模板,利用DH-F/R、DL-F/R引物PCR扩增犬血清中NAb的DH、DL部分基因。PCR反应条件为:94℃5 min;94℃30 s、55℃45 s、72℃90 s,20个循环;72℃10 min。回收上述片段,分别将扩增的MH、DH部分基因、ML、DL部分基因进行融合PCR,PCR反应条件为:94℃5 min;94℃30 s、55℃45 s、72℃2 min,20个循环;72℃10 min。构建ML-DL融合基因(RL)、MH-DH融合基因(RH)。预期扩增片段分别约为700 bp、1 500 bp。2种PCR产物经琼脂糖凝胶电泳检测并回收,由吉林库美公司测序鉴定。
1.4 重组杆粒Bacmid-RL-RH的构建和鉴定 将回收得到的RH基因和RL基因分别克隆至pFast-Bac-Dual质粒的p10启动子(酶切位点XhoⅠ、NheⅠ)和多角体启动子(酶切位点BamHⅠ、HindⅢ)后,构建重组质粒pFastBac-Dual-RL-RH并测序鉴定。将测序正确的重组质粒转化至E.coliDH10Bac感受态细胞中,经蓝白斑筛选阳性克隆。将阳性克隆接种于LA-Bac液体培养基,用BAC/PAC DNA Kit提取重组杆粒(Bacmid),采用通用引物pUC/M13对提取的重组杆粒进行PCR鉴定,鉴定正确的重组杆粒命名为Bacmid-RL-RH。
1.5 嵌合抗体RL-RH的表达 取适量重组杆粒Bacmid-RL-RH与脂质体Lipofectamine 2000混合转染6孔板中的Sf9昆虫细胞,置27℃培养,72 h后收集细胞上清(P1代)。将P1接种Sf9细胞扩大培养获得病毒(P2代)。通过病毒空斑试验[5]测定P2代滴度后,以5 MOI接种新培养的Sf9细胞。72 h后分别收集Sf9培养上清及Sf9细胞。
1.6 嵌合抗体RL-RH的表达及纯化的检测 将1.5步骤中收集的Sf9细胞超声破碎离心后,收集上清和沉淀。将超声后的上清用NAb Protein A/G Column对表达的嵌合抗体进行纯化。将超声后的上清、沉淀和纯化后的抗体各取 20 μg进行 SDSPAGE检测,并以未转染的Sf9细胞超声上清作为对照。直接用HRP标记的兔抗犬IgG进行western blot鉴定嵌合抗体的反应原性及抗体纯化效果。
1.7 嵌合抗体RL-RH的间接免疫荧光(IFA)检测将FPV接种于96孔板中F81细胞中,置37℃培养,待出现细胞病变(CPE)时弃掉培养液,PBST洗3次,用预冷的无水乙醇固定细胞。以1.5步骤中收集的Sf9培养上清(1∶20)为一抗,以FITC标记的兔抗犬IgG(1:100)为二抗,经IFA检测嵌合抗体与FPV的特异性结合情况。
1.8 嵌合抗体RL-RH对FPV和CPV的中和活性测定 将FPV和CPV病毒液10倍倍比稀释(10-1~10-10),分别取每个稀释度的病毒液100 μL,接种于96孔板中的F81单层细胞,每个稀释度接种一列。置37℃培养,在24 h~72 h之间监测CPE出现情况。用Reed-Muench法[6]计算FPV、CPV的TCID50。用固定病毒稀释抗体的方法进行中和试验:将纯化后的嵌合抗体 2倍倍比稀释(1∶8~1∶256),分别与100 TCID50的FPV、CPV病毒液等体积混合,37℃孵育1h。每一稀释度取100 μL上述上清和病毒的混合液接种96孔板的F81细胞。每日观察CPE情况,检测嵌合抗体对FPV、CPV的中和活性,实验平行重复3次。
2 结果
2.1 嵌合抗体RL-RH基因的扩增及融合PCR扩增结果 提取3EB MAb细胞株总RNA,经反转录制备的cDNA为模板,扩增MH、ML基因,得到约为420 bp、400 bp的基因片段,与预期MAb相应轻链基因大小相符;以犬淋巴细胞cDNA为模板扩增犬血清NAb DH、DL基因片段大小分别约为1 200 bp、400 bp。用融合PCR将ML基因与DL基因、MH基因与DH基因融合后,得到重组的嵌合重链基因(RH)、轻链基因(RL)基因片段。经测序显示,RL基因片段全长752 bp、RH基因全长1 523 bp,与预期结果一致(图2)。表明正确构建了鼠-犬嵌合轻链基因RL和鼠-犬嵌合重链基因RH。
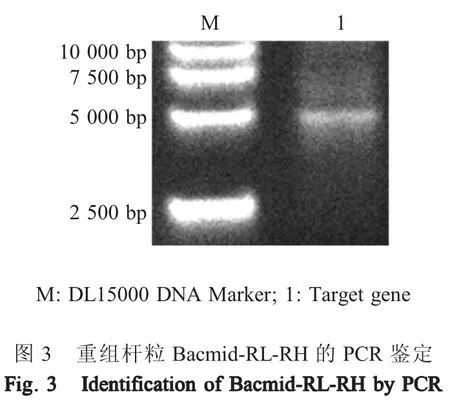
2.2 重组杆粒的构建与鉴定 将嵌合轻链基因与嵌合重链基因克隆至pFastBac-Dual质粒中,对构建的重组质粒pFastBac-Dual-RL-RH测序,结果显示嵌合轻链与嵌合重链正确克隆至质粒。将pFastBac-Dual-RL-RH质粒转化入E.coliDH10Bac,用 BAC/PAC DNA Kit提取筛选的阳性重组杆粒,使用通用引物pUC/M13对其进行鉴定,扩增出约5 000 bp的片段,与预期结果一致(图3)。表明正确构建了重组杆粒Bacmid-RL-RH。
2.3 嵌合抗体RL-RH的表达与纯化检测结果 重组杆粒Bacmid-RL-RH转染Sf9细胞后,收集细胞并超声离心,对超声后的上清、沉淀及纯化后的嵌合抗体进行SDS-PAGE检测。结果显示,获得了两条分别约为55 ku和25 ku的目的蛋白条带,与预期相符,且纯化效果较好(图4A)。表明嵌合抗体RL-RH能够在昆虫细胞中正确表达。以HRP标记的兔抗犬IgG进行western blot鉴定,结果显示在55 ku处有1条特异性反应条带(4B)。表明抗犬IgG能够与嵌合抗体RL-RH发生特异性结合。表明嵌合抗体RL-RH的相应区域已经替换为犬源的相应区域。

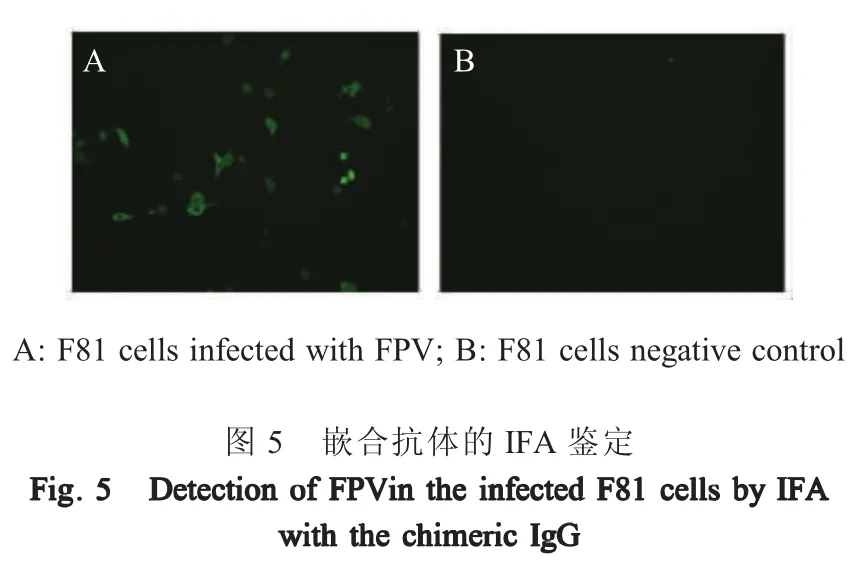
2.4 嵌合抗体的IFA鉴定结果 待感染FPV的F81细胞出现CPE后以纯化后的嵌合抗体作一抗,FITC标记的兔抗犬IgG为二抗,经IFA检测结果显示,F81细胞出现特异绿色荧光(图5)。嵌合抗体能够与FPV发生特异性结合,表明嵌合抗体保留了原MAb可变区对FPV的特异性结合能力,同时原MAb的鼠源恒定区已经替换为犬源恒定区。
2.5 嵌合抗体中和活性的测定结果 根据Reed-Muench法计算出FPV的TCID50=10-6.6/0.1 mL,CPV的TCID50=10-5.9/0.1 mL。通过3次平行试验测定嵌合抗体对FPV、CPV的中和活性,结果显示当嵌合抗体1∶16稀释时仍能够完全中和100 TCID50的FPV、CPV。表明昆虫细胞表达的嵌合抗体保留了原来MAb对FPV和CPV的中和活性。
3 讨论
抗病毒抗体在治疗CPV中起着十分重要的作用。但作为异种动物的抗体,无论是鼠源的MAb还是马源的多抗血清,均会由于异源抗体的免疫原性而引发动物机体产生抗-抗体反应[7]。对CPV来说,抗体的免疫原性是影响治疗效果主要原因。而将MAb的鼠源恒定区替换为同种动物源恒定区,可以显著降低这种免疫原性,但由于其可变区仍是鼠源序列,有时仍会对异种动物产生免疫原性[8]。根据对抗体序列及空间构象的相关研究显示,抗体的可变区可以进一步分为骨架区(Framework region,FWR)和互补决定区(Complementarity determining region,CDR)[9]。有的研究者为了进一步减弱疫原性,将抗体的FWR也进行了替换,阿仑单抗(CAMPATH-1H)便是由此而来[10],目前该嵌合抗体现已经在50多个国家获得批准用于人的复发缓解型多发性硬化症的治疗[11]。
阿仑单抗虽然是进一步减弱了免疫原性的成功例子,但有报道称某些抗体FWR中的某些关键氨基酸残基起着稳定抗体结构的作用,并且在抗体与抗原结合过程中起到变构作用[12]。本研究将3EB MAb的重轻链可变区替换为犬源NAb可变区,获得的嵌合抗体保留了对FPV和CPV的中和活性。虽然没有进一步替换MAb可变区的FWR,一方面是因为相对于人源抗体,犬的天然抗体结构及功能的研究[13-14]相对较少,贸然替换FWR可能会造成嵌合抗体丧失对病毒的中和活性。而且在替换FWR时,还需要对MAb及犬NAb结构进行预测并通过相关实验验证[9]。另一方面是目前还无犬源嵌合抗体上市,将鼠源MAb恒定区部分替换分为犬源的嵌合抗体的研究及应用也未见报道。与进一步减弱MAb的免疫原性相比,保持原有MAb对病毒的中和活性才是目前研发嵌合抗体的重点。本研究为嵌合抗体及犬源化MAb的研究奠定了良好的基础,对临床用犬源抗体药物研究具有重要的参考价值。
