幽门螺旋杆菌lpp20-cagA融合基因在乳酸球菌中的表达及免疫原性研究
2019-07-30赵文萱赵福广
赵 翠,赵文萱,赵福广
(吉林农业大学生命科学学院,吉林长春130118)
幽门螺旋杆菌(Helicobacter pylori,HP)感染仍然是全球性的问题,据不完全统计,全球有近50%的人口感染或携带HP。通常情况下采用抗生素和质子泵抑制剂治疗,但抗生素的耐药性、治疗费用昂贵、治愈后再复发等因素成为影响治疗不可忽视的因素。治疗性疫苗已经成为攻克HP感染的必然趋势,已 经有 Urase[1]、VacA[2]、CagA[3]、HpaA[4]等作为HP疫苗抗原的研究设计,但这些疫苗诱导的免疫应答及免疫效果有限。
lpp20基因的表达产物Lpp20是一种高度保守的外膜性脂蛋白,在细菌存活和宿主定植过程中发挥关键作用,并且具有良好的免疫活性[5]。近年来有研究显示,Lpp20可以促进胃癌细胞的迁移和增殖[6]。cagA基因的表达产物CagA蛋白同样是一种免疫原性较强,存在于菌体表面的外膜蛋白,不同毒力菌株之间的同源性高达80%以上,可以作为候选抗原刺激机体产生免疫反应[7]。因此,本实验选择lpp20和cagA作为候选抗原基因,设计并构建了表达融合蛋白的重组乳酸球菌(L.lactis),以期提高抗HP感染的同时,为研究防治性HP疫苗奠定基础。
1 材料与方法
1.1 主要实验材料L.lactisNZ3900和表达载体pNZ8149由吉林农业大学动物科学技术学院胡桂学教授惠赠;本实验所用HP菌株分离自消化性胃溃疡患者的胃黏膜中,经鉴定为HP I型菌株(cagA+vacA+);哥伦比亚选择培养基、M17、Elliker培养基购自青岛海博生物技术有限公司;DAB显色试剂盒购自北京索莱宝生物技术有限公司;IFN-γ、IL-4、IgG、IgG1、IgG2a、SIgA ELISA检测试剂盒、细菌基因组提取试剂盒均购自康维世纪有限公司;基因重组试剂盒购自中美泰和生物技术有限公司;Seamless Assembly Cloning kit购自中美泰和生物技术有限公司;聚合酶ExTaqHot Start Version购自TaKaRa生物技术有限公司;羊抗小鼠IgG-HRP购自北京博奥森生物技术有限公司;鼠抗重组L.lactis的抗血清由本实验室制备;8周龄SPF级BALB/c雄性小鼠购自长春高新产业开发区实验动物中心。
1.2 重组表达载体的构建与鉴定 根据GenBank中lpp20(899837)和cagA(898927)基因序列设计无缝克隆引物P1/P2和P3/P4,所用引物均由长春库美生物有限公司合成(表1),其中加粗字体部分为载体同源臂,下划线部分为柔性Linker GGGSGGGS序列。参照细菌基因组提取试剂盒说明方法提取HP基因组,并以此为模板,分别以P1/P2和P3/P4为引物,按照ExTaqHot Start Version说明方法扩增目的基因lpp20和cagA。扩增产物经1%的琼脂糖凝胶电泳检测并回收产物。
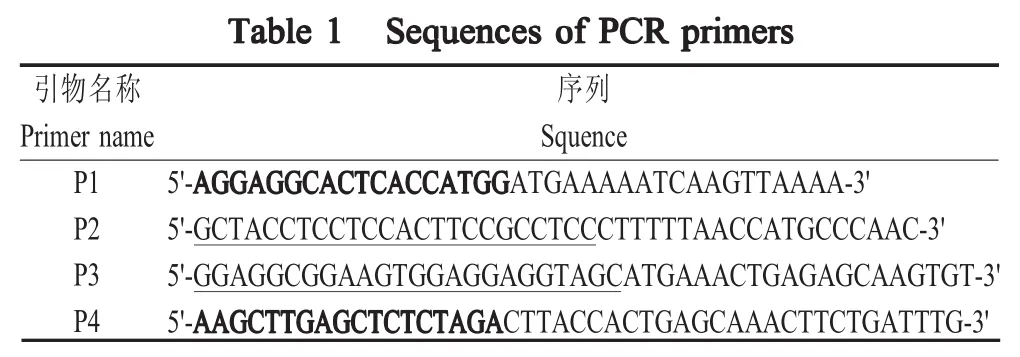
表1 PCR引物序列
利用限制性内切酶NcoⅠ和XbaⅠ对表达载体pNZ8149进行线性化处理,采用无缝克隆技术,按照Seamless Assembly Cloning Kit说明方法将目的基因lpp20和cagA克隆于pNZ8149中,构建重组质粒 。将 10 μL重 组质粒电转 化 100 μLL.lactisNZ3900,利用Elliker选择培养基筛选的阳性克隆子为金黄色。挑取阳性克隆子于M17培养基中扩大培养,并由长春库美生物有限公司测序,测序正确的重组质粒命名为pNZ8149-lpp20-cagA。
1.3 融合蛋白Lpp20-CagA的表达和反应原性研究调整pNZ8149-lpp20-cagA/NZ3900重组菌株OD600nm为0.6,经 nisin(终浓度 20 μg/mL)诱导表达 4 h,离心收集菌体后,再由浓度为10 mg/mL的溶菌酶消化,离心取上清制备蛋白样品。以鼠抗重组L.lactis的抗血清(1∶100)为一抗,羊抗小鼠 IgG-HRP(1∶5 000)为二抗进行western blot检测。
1.4 融合蛋白Lpp20-CagA的免疫原性研究 将8周龄SPF级BALB/c雄性小鼠随机分为6组,每组12只,即pNZ8149-lpp20-cagA/NZ3900(5×109cfu/mL)的高(1 000 μL)、中(500 μL)和低剂量组(250 μL),全菌疫苗组(甲醛灭活 HP,5×109cfu/mL,1 000 μL),pNZ149/NZ900 组(5×109cfu/mL,1 000 μL),PBS 组(1 000 μL)。以上各组分别在第 0、7 d、14 d、21 d、28 d灌胃给药,最后一次免疫后2周,对全部小鼠经眼眶静脉取血并制备血清,应用相应的ELISA试剂盒检测各组小鼠血清中IgG、IgG1、IgG2a及细胞因子IL-4、IFN-γ水平;同时每组随机选取6只小鼠迫杀,取其胃部组织、小肠及粪便,用无菌PBS匀浆处理后,离心取上清液,利用SIgA ELISA试剂盒检测黏膜抗体SIgA水平。
1.5 HP攻毒试验 将以上免疫后2周的所有小鼠均灌胃1 mL 5×109cfu/mL HP进行攻毒试验,每隔3 d灌胃一次,共计5次,最后一次攻毒2周后,迫杀每组剩余的6只小鼠并分离胃组织。准确称量胃组织,加入同等体积的无菌PBS缓冲液,对胃组织进行匀浆处理,离心吸取上清液200 μL,接种于哥伦比亚选择培养基中,37℃微需氧条件下培养3 d完成HP的定量培养;同时,按照脲酶诊断试剂盒说明对胃组织中脲酶活性进行检测。
1.6 数据分析 本实验应用GraphPad Prism 5.0软件进行数据分析,采用单向方差分析比较各组数据的 差 异 性 , 其 中 *:p<0.05、 **:p<0.01、 ***:p<0.001有统计学意义。
2 结果
2.1 pNZ8149-lpp20-cagA的构建与鉴定结果 以HP基因组为模板,分别以P1/P2和P3/P4为引物扩增基因lpp20(528 bp)和cagA(843 bp),产物经1%的琼脂糖凝胶电泳检测结果与预期大小相符(图1)。将以上目的基因的胶回收产物应用无缝克隆试剂盒连接表达载体pNZ8149构建pNZ8149-lpp20-cagA,将重组质粒转化L.lactisNZ3900,提取质粒经测序分析,结果显示,插入基因片段与GenBank中相应基因序列(lpp20Gene ID:899837、cagAGene ID:898927)同源性均为99%,表明表达载体pNZ8149-lpp20-cagA构建正确。

2.2 融合蛋白Lpp20-CagA的反应原性鉴定pNZ8149-lpp20-cagA/NZ3900经 20 μg/mL 的 nisin诱导后进行western blot检测,结果显示,在约为50.3 ku处出现特异条带,与预期相符(图2),表明本实验表达的融合蛋白具有良好的反应原性。

2.3 融合蛋白Lpp20-CagA的免疫原性鉴定 在小鼠灌胃免疫本实验制备的重组L.lactis后,应用ELISA试剂盒对各组小鼠血清中特异性抗体及细胞因子水平进行检测。结果显示,IL-4在实验组(pNZ8149-lpp20-cagA/NZ3900的高剂量组、中剂量组,低剂量组)和PBS组相比呈现显著差异(p<0.001或p<0.05),但是IFN-γ水平在各实验组和PBS组之间无差异性 (p>0.05)(图3)。另外,IgG、IgG1在实验组与PBS组比较差异显著(p<0.001或p<0.05)(图4A、B),但IgG2a的实验组和PBS组比较无差异性(p>0.05)(图4C)。黏膜抗体SIgA检测结果显示,在胃黏膜和小肠黏膜中,高剂量组和中剂量组与PBS组相比呈现显著差异(p<0.05),在粪便中,高中低3个剂量组与PBS组相比均呈现显著差异(p<0.05)(图4D)。综合以上,本实验表达的融合蛋白Lpp20-CagA具有良好的免疫原性,可以诱导体液免疫和黏膜免疫应答。

2.4 HP攻毒试验结果 最后一次攻毒后2周迫杀小鼠,对小鼠胃组织中HP的定量培养及脲酶活性进行检测,结果显示,高剂量组相比于PBS组差异极显著(p<0.001),高剂量组相比于全菌疫苗组差异显著(p<0.01)(图5)。以上结果显示本实验构建的重组L.lactis可以减少HP在小鼠胃组织中的定植,尤其以高剂量组的效果最为显著。表明本实验构建的重组L.lactis可以抵抗HP的感染。


3 讨论
本实验所采用的L.lactis是异源蛋白在适宜条件下表达的常用宿主,其无毒的特性优于其它疫苗载体。Zhang Hong-xin等以L.lactis作为疫苗载体,表达了融合蛋白ureB-IL-2,结果显示该载体疫苗可以诱导较高水平的特异性抗体反应,且小鼠胃组织中HP的负荷及脲酶活性相比于对照组显著降低[8],相似的结果也体现在Zhang Rong-guang等的研究中[5]。这表明L.lactis作为抗原递呈载体的巨大潜力,但小鼠胃组织中仍然存在一定数量的HP并未完全清除,是以上两个研究的共同之处,这也与本研究结果一致。
本实验在L.lactis中表达了融合蛋白Lpp20-CagA,western blot结果表明,该融合蛋白具有良好的反应原性。以pNZ8149-lpp20-cagA/NZ3900对小鼠实施免疫保护性试验,其血清中IL-4与PBS组相比差异显著,但IFN-γ与PBS组相比并无差异性。IFN-γ和IL-4分别是Th1型和Th2型细胞分化的标志,细胞因子的检测结果表明本实验表达的融合蛋白诱导了以Th2型免疫为主的体液免疫应答模式,而HP的清除与体液免疫和细胞免疫高度相关,在参与对抗胞外病原体以及HP感染中发挥了重要作用,这或许是HP不能完全被根除的原因所在。在评估血清中特异性抗体方面,IgG1/IgG2a是评估Th1/Th2之间平衡的重要指标,IgG2a在组别之间无任何差异性,从侧面验证了融合蛋白Lpp20-CagA诱导Th2型免疫应答的结论。Liu Kai-yun等以CagA、VacA、UreB作为抗原表达融合蛋白,在检测特异性抗体方面,IgG2a的表达水平在实验组与PBS组之间差异显著,相反IgG1在任何组别无差异,表明Liu Kai-yun等表达的融合蛋白诱导了以Th1型为主的细胞免疫应答[3],此研究结果有别于本实验的研究结果。造成结果不同的原因可能是不同抗原组合表达的融合蛋白诱导不同的免疫类型。最后对小鼠进行HP攻毒,胃组织中HP的定植密度及脲酶活性检测结果均显示,与PBS组相比,高剂量组的HP负荷量显著降低。但同时发现,即使在高剂量组,小鼠胃黏膜中仍有一定数量的HP定植并未完全根除,这也是目前为止,中外学者面临的共同难题[9-10]。
综合以上,口服重组L.lactis在对抗HP感染方面是安全有效且其具有较强的免疫原性,也证实了L.lactis作为抗原递呈载体的有效性,其潜在应用价值不容忽视。
