以免疫纳米微球为凝集原的犬细小病毒2型抗体凝集检测方法的建立
2019-07-30苏瑞红侯美佳孙思萌冯启峥董秀梅师东方
唐 毓,苏瑞红,侯美佳,孙思萌,冯启峥,董秀梅,2,张 萍,2,师东方,2*
(1.东北农业大学动物医学学院,黑龙江哈尔滨150030;2.农业部动物疫病病原生物学东北科学观测实验站,黑龙江哈尔滨150030)
犬细小病毒病是由犬细小病毒2型(Canine parvovirus type 2,CPV-2)引起的,以发热、呕吐、出血性肠炎和幼犬心肌炎为主要特征的接触性传染病,对幼犬的危害尤为严重[1]。CPV-2无囊膜,基因组为单股负链DNA,编码非结构蛋白NS1、NS2和结构蛋白VP1和VP2[2]。VP2是病毒的主要衣壳蛋白,可以诱导机体产生抗病毒中和抗体,为该病免疫防制和诊断研究中的重要靶蛋白[3-4]。疫苗免疫是预防该病的主要措施,但在临床上常见免疫犬发病的病例,其原因除疫苗株与感染株抗原性存在差异外,母源抗体或免疫抗体干扰也是造成免疫失败的主要原因[5]。因此,监测CPV-2抗体水平,不仅有助于确定最佳免疫时机,还可以及时评估免疫效果。检测CPV-2抗体常用的方法有血凝抑制试验(HI)、血清中和试验(SN)和酶联免疫吸附试验(ELISA)等[6-7],但这些方法由于操作复杂,耗时费力,有散毒风险或需要特殊仪器,不适于临床应用。国内宠物医院虽然有进口试剂盒检测CPV-2抗体,但价格昂贵,因此很少有犬接种疫苗前检测CPV-2抗体水平,多数犬的免疫程序是凭经验制定的,缺乏抗体检测依据。
间接凝集试验是一种简便、快速用于病原或抗体检测的血清学方法,常以红细胞、聚苯乙烯乳胶等作为载体[8-9]。近年来,彩色聚苯乙烯、二氧化硅等纳米微球在凝集试验中的应用[10-12],使得凝集现象更明显,易于判定,值得借鉴。本研究以重组VP2蛋白致敏彩色聚苯乙烯纳米微球,建立检测CPV-2抗体的间接凝集试验,为幼犬母源抗体或免疫犬抗体检测提供一种快速、简便、经济的方法。
1 材料与方法
1.1 主要实验材料 F81细胞、犬腺病毒(CAV)阳性血清、狂犬病病毒(RABV)阳性血清由中国农业科学院哈尔滨兽医研究所曲连东研究员提供;CAV分离株CPV-DN17-1(New CPV-2a,病毒滴度为103.6TCID50/0.1 mL)、兔抗CPV-2阳性血清、分别用卫佳伍犬五联疫苗(美国硕腾,CPV NL-35-D株)、宠必威二联苗(荷兰英特威,CPV C-154株)、犬五联疫苗(吉林五星,CPV CR86106株)、犬六联疫苗(法国梅里亚,CPV B114株)4种常规弱毒疫苗免疫成年犬获得的犬血清、CPV-2阴性血清、犬瘟热病毒(CDV)阳性血清、质粒pGEX-6P-1均由东北农业大学动物医学院传染病教研室分离制备或保存;40份CPV-2弱毒疫苗免疫犬血清采自哈尔滨铁路局警犬基地和东北农业大学动物医院;病毒DNA提取试剂盒购自天根生化科技(北京)有限公司;DNA聚合酶购自全式金公司;pMD-19T Simple载体、限制性内切酶购自宝生物(大连)有限公司;山羊抗兔IgGHRP购自北京中杉金桥有限公司;粒径为410 nm的彩色聚苯乙烯微球购自上海涛宇微球有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC·HCL)购自哈尔滨百杰斯生物公司;ImmunoCombCanine VacciCheck试剂盒(以色列,Dot-ELISA,以下简称CPV抗体检测试剂盒)购自哈尔滨中兴动物医药有限公司;谷胱甘肽(GST)标签蛋白纯化试剂盒购自上海碧云天生物科技有限公司。
1.2 引物的设计与合成 参照CPV-DN17-1和Gen-Bank中CPV-2 VP2基因序列(KT156835)主要抗原保守区的截短片段svp2(1 093 bp~1 458 bp,366 bp),应用软件Primer 5设计引物:sVP2-F:5'-CGGGA TCCCAAACAGATGAAAATCAAGCAG-3'(BamHⅠ)/sVP2-R:5'-CCGCTCGATGCATTTACATGAAGTCTT GG-3')(XhoⅠ)。
1.3svp2基因的PCR扩增 参照病毒基因组提取试剂盒说明书提取CPV-DN17-1 DNA作为模板,以sVP2-F/sVP2-R为引物进行PCR扩增。反应条件为:95℃ 5 min;95℃ 30 s、55℃ 30 s、72℃ 2 min,30个循环;72℃10 min。胶回收PCR产物,由上海生工生物工程技术服务有限公司测序后克隆至经BamHⅠ/XhoⅠ处理的pGEX-6P-1中,经酶切和测序正确的重组表达质粒命名为pGEX-svp2。
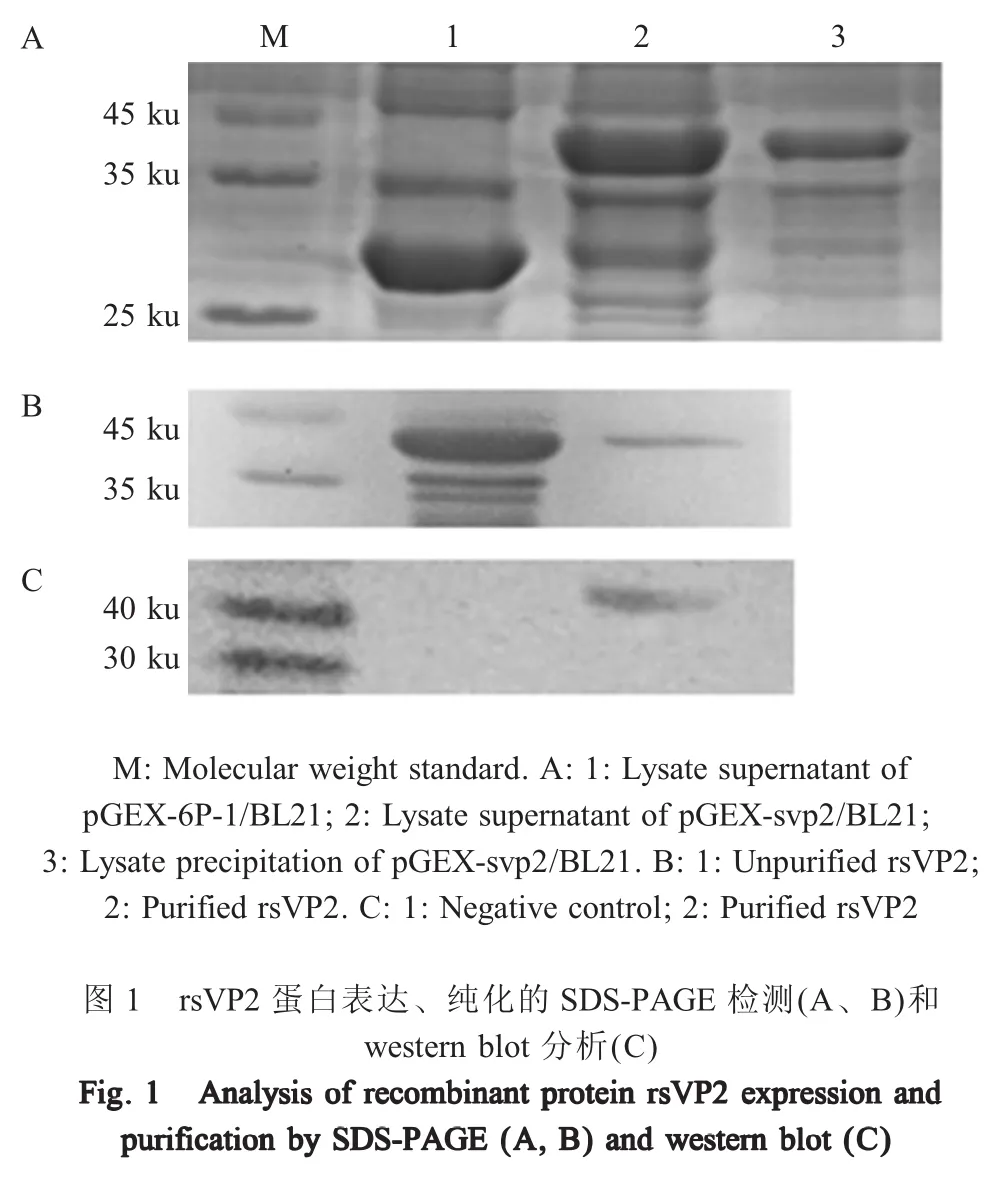
1.4 重组蛋白rsVP2的表达与鉴定 将pGEX-svp2转化大肠杆菌BL21感受态细胞,PCR鉴定正确的重组菌按1:50接种于LB液体培养基中,37℃震荡培养至OD600nm为0.4~0.6时,加IPTG至终浓度为1 mmol/L诱导表达,继续震荡培养4 h后,1 200 r/min离心收集菌体,超声裂解后取上清和沉淀经SDS-PAEG分析重组蛋白的大小及表达形式。
参照GST标签蛋白纯化试剂盒说明书纯化重组蛋白后,SDS-PAGE检测该蛋白的纯化效果。以兔抗CPV-2阳性血清(1∶500)为一抗,山羊抗兔IgGHRP(1∶5 000)为二抗,采用western blot分析重组蛋白的反应原性。鉴定正确的重组蛋白命名为rsVP2。
1.5 CPV-2抗体间接凝集检测方法的建立 采用方阵法优化制备致敏微球,首先固定纳米微球的量为 25 μL(5%w/v)。分别取 1 mL醋酸盐缓冲液(pH5.0)稀释的不同浓度的 rsVP2(0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL),分别加入不同量(0.015 g、0.030 g、0.045 g)EDC·HCL,再加入25 μL纳米微球(5%w/v),各成分混匀后,置脱色摇床,100 r/min室温摇动2 h,8 000 r/min离心15 min,弃上清,加入1 mL乙磺酸缓冲液(MES,pH4.7)充分悬起,相同条件离心15 min后弃上清,用250 μL MES重悬,即为致敏微球,4℃保存。取兔抗CPV-2阳性血清与制备的致敏微球进行凝集试验,确定最佳抗原蛋白rsVP2和EDC·HCL的量。
各取1 mL分别用醋酸盐缓冲液(pH5.0)、磷酸缓冲液(PBS,pH7.2)、乙磺酸缓冲液(MES,pH4.7)稀释成优化浓度的rsVP2,加入适量的EDC与25 μL纳米微球(5%w/v),混匀,按同样方法制备致敏微球,根据凝集试验结果确定最佳的致敏缓冲液。
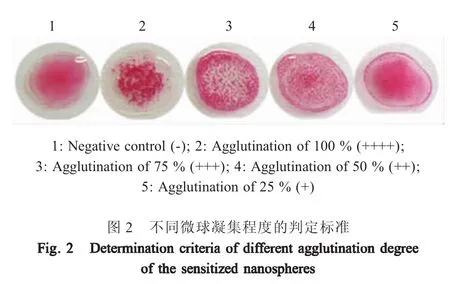
取干净的载玻片先后滴加10 μL 2倍倍比稀释的兔抗 CPV-2 阳性血清(1∶2~1∶16)和 10 μL 按优化条件制备的致敏微球,混匀,摇晃1 min~2 min并观察凝集现象。同时以PBS代替检测血清作为阴性对照。凝集程度判定:“++++”为100%凝集,颗粒大量聚集成团,周边液体清亮;“+++”为75%凝集,颗粒明显,分散,周边液体澄清;“++”为50%凝集,密集的小颗粒,周边液体较清亮;“+”为25%凝集,无明显凝集颗粒,液体浑浊;“-”液滴呈原有的均匀混浊红色,无凝集现象。
1.6 特异性试验 取CDV阳性血清、CAV阳性血清、RABV阳性血清和CPV-2阳性血清分别与致敏微球进行凝集试验,同时设PBS、CPV-2阴性血清作为阴性对照,检测该间接凝集试验的特异性。
1.7 敏感性试验 随机取4种不同的CPV-2弱毒疫苗免疫后采集的犬阳性血清各1份,检测其中和抗体效价[13]。将上述各阳性血清2倍倍比稀释(1∶2~1∶16)后利用本研究建立的凝集试验检测,使致敏微球呈现50%凝集(++)的血清最低稀释倍数对应的中和抗体效价即为凝集试验的最低检测抗体效价。
利用本实验建立的凝集方法检测20份CPV-2弱毒疫苗免疫犬的阳性血清样品,同时采用CPV抗体检测试剂盒(Dot-ELISA)检测相同血清样品的CPV-2抗体,评估该凝集方法的敏感性。
1.8 重复性、稳定性试验 以兔抗CPV-2阳性血清、CPV-2阴性血清、CDV阳性血清和CAV阳性血清为检测血清,分别与标记为A、B、C,批号为1104的3份致敏微球进行凝集试验,每个样品设3个重复,检测该方法的批内重复性;将以上述血清分别与批号为1012、1015、1020 3个批次的致敏微球进行凝集试验,每个样品设3个重复,检测该方法的批间重复性;取兔抗CPV-2阳性血清、CPV-2阴性血清、CDV阳性血清和CAV阳性血清分别与4℃保存15 d、30 d、45 d、60 d、90 d的致敏微球进行该凝集试验,检测致敏微球在不同保存条件下的稳定性。
1.9 临床样品的检测 随机选取4份CPV-2弱毒疫苗免疫的犬血清,用CPV抗体检测试剂盒、间接凝集试验和中和试验分别检测并比较检测的血清抗体效价及三者的相关性。
另外,利用CPV抗体检测试剂盒和本研究建立的间接凝集试验检测40份采自警犬基地和宠物医院的犬血清样品,分析间接凝集试验与试剂盒检测结果的符合率。
2 结果
2.1 重组蛋白rsVP2的表达、纯化及鉴定
2.2 CPV-2抗体间接凝集方法的建立 经方阵试验优化该凝集方法的结果为:致敏微球所用纯化的rsVP2的量为0.3 mg,EDC的量为0.015 g,缓冲液为500 μL(pH5.0)醋酸缓冲液,致敏的微球凝集效果最好。根据凝集试验结果,不同凝集程度的判定如图2。
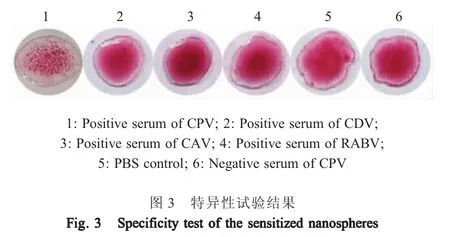
2.3 特异性试验结果 分别采用CPV-2、CDV、CAV、RABV阳性血清进行该凝集方法的特异性试验。结果显示,仅CPV-2阳性血清与致敏微球发生凝集反应,其它血清与阴性对照均不与致敏微球发生凝集反应(图3)。表明该凝集试验具有较强的特异性。
2.4 敏感性试验结果 经中和试验检测,4份CPV-2弱毒疫苗免疫的犬血清中和抗体效价分别是1∶5 000、1∶512、1∶625 和 1∶1 111。凝集试验敏感性试验结果显示,使致敏微球发生50%(++)凝集的血清最高稀释倍数分别为 1∶8、1∶2、1∶2 和 1∶4,对应的中和抗体效价分别为 1∶625、1∶256、1∶312 和1∶278,凝集试验对血清的最低检出中和效价为1∶256。
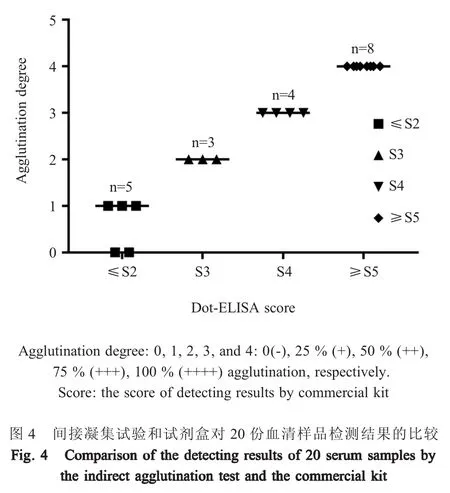
利用CPV抗体检测试剂盒和凝集试验对20份免疫犬血清样品的检测结果显示,试剂盒检测呈阳性的血清(分值≥S3)15份,阴性血清5份(分值<S3);凝集试验检测该15份阳性血清均呈50%(++)凝集,判定为阳性血清。凝集试验检测该5份阴性血清均呈25%(+)或无凝集现象(-)(图4)。表明本研究建立的凝集方法敏感性较高,且与CPV抗体检测试剂盒的检测结果一致性较高。
2.5 重复性、稳定性试验结果 重复性试验结果显示,仅兔抗CPV-2阳性血清与同批次制备的(编号:1104)的3份致敏微球A、B、C以及不同批次(编号:1012、1015、1020)制备的致敏微球发生凝集反应,CPV-2阴性血清、CDV阳性血清和CAV阳性血清与同批次以及不同批次制备的致敏微球均不发生凝集反应。凝集反应的特异性和凝集程度一致,表明同一批次和不同批次制备的致敏微球的重复性均较好。
稳定性试验结果显示,仅兔抗CPV-2阳性血清与4℃保存不同时间的致敏微球均发生凝集反应,CPV-2阴性血清、CDV阳性血清和CAV阳性血清均不与其发生凝集反应。特异性和凝集程度与新鲜制备的致敏微球无明显差别,表明4℃保存90 d的致敏微球仍具有较好的稳定性。
2.6 临床样品检测结果的比较 取4份CPV-2弱毒疫苗免疫的犬血清,分别用CPV抗体检测试剂盒、间接凝集试验和中和试验进行检测。结果显示,虽然4份血清的抗体效价不同,但中和抗体效价高的血清,CPV抗体检测试剂盒的检测结果分值也高,发生凝集反应(++)时血清的稀释倍数也高;中和抗体效价较低的血清,CPV抗体检测试剂盒的检测结果分值也较低,发生凝集反应(++)的血清稀释倍数也较低,3种方法的检测结果具有相同的趋势(表1)。表明,间接凝集试验检测结果可以反映机体内CPV-2抗体产生的趋势和水平。
采用本研究建立的间接凝集方法和CPV抗体检测试剂盒检测40份犬血清样品的结果显示,凝集方法检测阳性的血清有35份,阴性血清5份;试剂盒检测阳性的血清有36份,阴性血清4份。凝集方法与CPV抗体检测试剂盒检测的阳性结果符合率为97%(表2)。表明本研究建立的间接凝集方法可以用于临床检测犬CPV-2血清抗体。

表1 不同方法检测的CPV-2抗血清效价结果
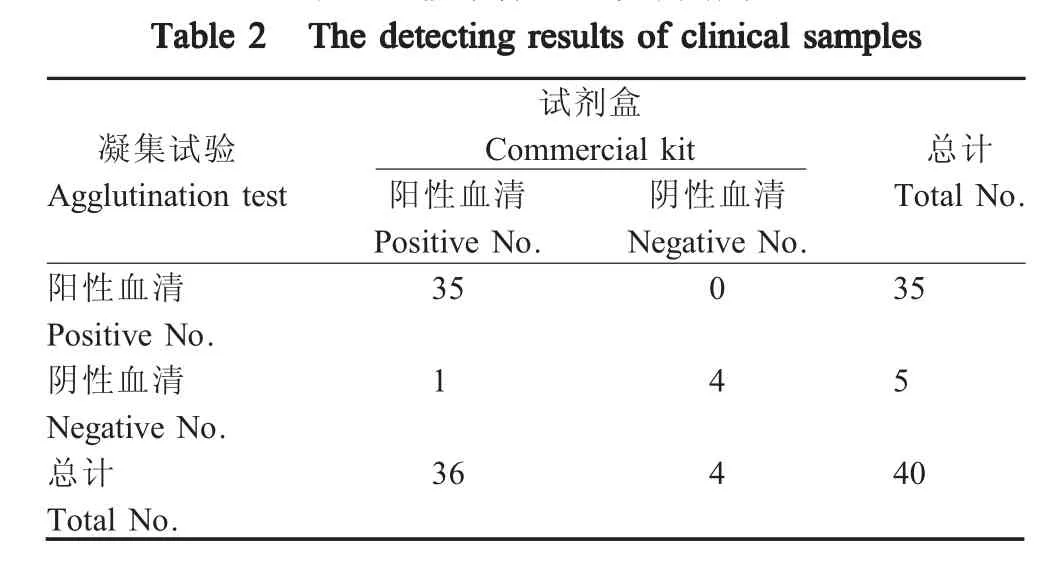
表2 临床样品的检测结果
3 讨论
CPV病主要危害6周龄~20周龄幼犬,目前以疫苗免疫为主要防制措施。研究表明,母源抗体对疫苗免疫有干扰作用,当母源抗体的HI效价>1:20或<1:80时,幼犬对疫苗无免疫应答而导致免疫失败[14]。因此,在免疫接种前监测CPV-2抗体水平对确定最佳免疫时机,或评估免疫效果是非常必要的。尽管HI试验操作繁琐,有散毒风险,以及红细胞悬液保存时间较短等问题不适于临床应用,但仍认为该方法是检测CPV-2抗体水平的“金标准”。Pollock等研究显示,幼犬CPV-2抗体HI≥1∶80时可以抵抗 CPV-2 的感染,而 1∶10≤HI<1∶80 时常导致免疫失败[15]。目前在宠物医院多使用Immuno-CombCanine VacciCheck(以色列)试剂盒检测CPV-2抗体,但其价格昂贵甚至超过一次免疫的疫苗价格,限制了其在抗体监测中的广泛应用。该CPV抗体检测试剂盒是一种半定量的Dot-ELISA方法,检测分值≥S3时判定为阳性结果,此分值对应的HI效价≥1:80,即分值≥S3时血清抗体对犬有免疫保护作用。本研究采用VP2截短蛋白制备的免疫彩色纳米微球仅与CPV-2阳性血清发生凝集反应,具有较强的特异性。虽然本研究建立的间接凝集试验不能准确检测血清样品的抗体效价,但从试验结果来看,CPV抗体检测试剂盒检测分值≥S3的血清样品,凝集试验结果≥++,并且与试验盒检测结果的阳性符合率为97%,表明该凝集试验可以定性检测幼犬CPV-2母源抗体和疫苗免疫抗体。
自1978年首次报道CPV-2以来,已经陆续出现了新的亚型变异株CPV-2a、CPV-2b、CPV-2c、new CPV-2a和new CPV-2b,这些变异株的主要突变位点在基因组的第426位和297位氨基酸[16]。本研究中致敏微球所用的重组蛋白是new CPV-2a亚型流行株VP2的aa365~aa486的截短蛋白,其氨基酸序列除第440位的丙氨酸(Ala)与目前常用的CPV疫苗株 NL-35-D(CPV-2a)、C-154(CPV-2a)、B114(CPV-2)和CR86106(CPV-2)该位点的苏氨酸(Thr)不同外,其余氨基酸序列均相同,抗原性也无明显不同,这一点在4份不同疫苗免疫犬血清的检测结果中可以得到证明。血清中和试验表明rsVP2的免疫血清对new CPV-2a病毒株具有中和作用,因此,用其作为抗原同样也可以检测到血清中和抗体,后者在一定程度反映血清抗体的免疫保护作用。从对4种疫苗分别免疫的犬血清检测结果来看,凝集试验可以检测出不同疫苗免疫犬的CPV-2阳性血清,且与CPV抗体检测试剂盒(Dot-ELISA)、中和试验的检测结果趋势一致,可以用于目前常用CPV疫苗免疫抗体的检测。本研究建立的间接凝集试验具有良好的特异性、稳定性和重复性,操作简便、检测成本低,适用于临床对犬血清样品的及时检测,有助于提高临床上对CPV抗体监测的普及率,为科学制定CPV疫苗免疫程序提供参考依据。
