PP1和PP2对鸡传染性喉气管炎病毒感染影响的研究
2019-07-30孙邦耀邵昱昊刘胜旺
孙邦耀,邵昱昊,高 琦,李 海,刘胜旺
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽呼吸道传染病创新团队,黑龙江哈尔滨150069)
鸡传染性喉气管炎(Avian infectious laryngotracheitis,AILT)是由疱疹病毒科、α型疱疹病毒亚科的传染性喉气管炎病毒(Infectious laryngotracheitis virus,ILTV)引起的一种急性、接触性上呼吸道传染病,在世界各国家和地区时有发生。该病毒传播速度快,感染率高,感染后难以清除。虽然ILTV的致死率依据病毒株毒力强弱以及鸡只个体免疫力差异从5%~70%不等,但该病毒可以感染所有年龄的蛋、肉、种用家禽,严重降低鸡的生产性能,是危害我国养禽业的主要传染病之一[1]。目前,基于机体细胞免疫应答的ILTV弱毒活疫苗接种是防控AILT的主要方法,在我国及世界AILT防控中发挥着重要作用。近年来,很多国家和地区流行病学调查显示,用以免疫的活病毒可以潜伏在宿主的三叉神经节,造成免疫个体终生带毒且不定期向外界排毒,从而导致部分接种过该类疫苗的鸡群在产蛋、应激及免疫抑制病病原感染等情况下反复暴发疫情[2]。结合当前我国禽病混合感染频发的现状,这一问题显得尤为突出。因此,深入研究ILTV与宿主细胞的互作机制,探索基于宿主细胞内源性抗病毒机制的防制策略,有望为完善当前AILT防制体系提供新的切入点。
病毒有两种基本传播方式:游离传播和细胞-细胞间传播。游离传播使病毒能在脱离宿主细胞后感染远端细胞、其它组织乃至扩散到体外感染群体中的其它个体,对于病毒在体内及群体内的传播至关重要。但病毒的游离传播很容易被体内各种屏障尤其是中和抗体所阻断。细胞-细胞间传播能有效避免中和抗体等机体防御机制的阻拦,帮助病毒跨过体内各类屏障,实现有效的传播[3-4]。有研究表明,在机体应答ILTV感染过程中,细胞免疫应答起到决定性作用,而抗体介导的体液免疫应答不足以给感染个体提供足够的保护[5]。因此,细胞-细胞间传播可能在ILTV感染过程中起到至关重要的作用。因此,研究ILTV在细胞间的扩散机制显得尤为重要。本实验室前期研究鉴定SRC(原癌基因酪氨酸蛋白激酶)是ILTV感染细胞过程中的主要宿主调节因子[6]。化学小分子PP1和PP2是两种常用的SRC抑制剂,被广泛应用于包括抑制HIV感染在内的SRC生物学功能研究[7-9]。目前,尚无关于PP1和PP2对ILTV感染宿主细胞影响的报道。本研究系统探究了两种化学小分子PP1和PP2对ILTV感染的影响,为后续ILTV感染分子机制的研究奠定基础。
1 材料与方法
1.1 主要实验材料和仪器 鸡肝癌细胞系(LMH细胞)、ILTV-LJS09株、抗ILTV gI糖蛋白兔多克隆抗体(简称 ILTV gI抗体)均由本实验室保存[10];带EGFP标签的ILTV-EGFP株为本实验室以ILTVLJS09株为骨架通过基因重组技术获得[11];红色荧光染料Dil购自上海碧云天生物技术有限公司;红色荧光染料十八脘基氯化罗丹明(R18)购自Life Technologies公司;化学小分子PP1和PP2、0.1%结晶紫染色液、绿色荧光染料钙黄绿素(Calcein-AM)、Hoechst33342染料、羊抗兔IgG-FITC、小牛血清、青霉素和链霉素均购自Sigma公司;AxyPrep体液病毒DNA/RNA小量制备试剂盒购自美国Axygen公司;Premix ExTaqTM试剂盒购自TaKaRa公司;流式细胞仪购自美国BD FACSAria;高内涵细胞筛选检测分析系统购自美国PerkinElmer。
1.2 PP1和PP2对ILTV感染细胞死亡影响的检测将LMH细胞接种于6孔板,利用DMEM全培养基(DMEM培养基添加10%小牛血清、100 U/mL青霉素及l00 μg/mL链霉素)在37℃ 5%CO2条件下培养。根据前期研究结果,感染前2 h以2 μmol/L PP1和20 μmol/L分别处理细胞可以在不影响细胞活性前提下有效抑制SRC的Y416位点磷酸化,所设置的感染后2 h处理组能够有效排除PP1和PP2对病毒吸附和进入宿主细胞过程的影响。因此,当LMH细胞密度达到50%时,将ILTV以MOI 0.1的剂量接种LMH细胞。分别在ILTV感染前2 h和感染后 2 h 采用 PP1(2 μmol/L)和 PP2(20 μmol/L)处理LMH细胞,并以相同体积的DMSO作为化学分子对照,同时设置未接种ILTV的细胞为阴性对照。待病毒感染24 h后经结晶紫染色后观察,拍照,分析细胞死亡情况。
1.3 PP1和PP2对ILTV扩散影响的检测 将LMH细胞接种于96孔板中,待细胞长满单层后采用 PP1(2 μmol/L)和 PP2(20 μmol/L)分别处理细胞,37℃孵育2 h,以MOI 0.1的剂量接种ILTV-EGFP,于4℃在无血清培养基中培养1 h后转移至37℃5%CO2培养箱内培养1 h,以促进病毒进入。然后换成含PP1和PP2的DMEM全培养基培养,在病毒感染6 h、18 h和24 h后采用高内涵细胞筛选检测分析系统统计EGFP荧光面积,EGFP荧光面积的大小反映了ILTV在细胞间的扩散水平。试验设DMSO处理LMH细胞作为对照。
1.4 PP1和PP2对ILTV复制影响的检测 参照“1.3”所述处理细胞后感染ILTV,待病毒感染24 h后,利用AxyPrep体液病毒DNA/RNA小量制备试剂盒提取病毒基因组,利用本实验室前期建立的qPCR方法[6]检测ILTV的载量。
1.5 PP1和PP2对ILTV游离扩散影响的检测 中和抗体被广泛用于阻断病毒的游离扩散,为了检测ILTV gI抗体对ILTV的中和作用,将ILTV病毒液与 ILTV gI抗体分别按照体积比 1∶0、1∶1、1∶2 和 1∶5的比例混匀后,分别感染LMH细胞24 h后按照“1.2”所述进行结晶紫染色。为探究PP1和PP2是否对ILTV扩散有促进作用,将ILTV-EGFP(MOI 1)与抗ILTV gI抗体按1∶5的体积比混匀后感染LMH细胞,收集细胞,将此感染细胞与未感染病毒的LMH细胞按照1∶50比例混匀后共同接种96孔板,按“1.3”方法,采用高内涵细胞筛选检测分析系统统计EGFP荧光面积。
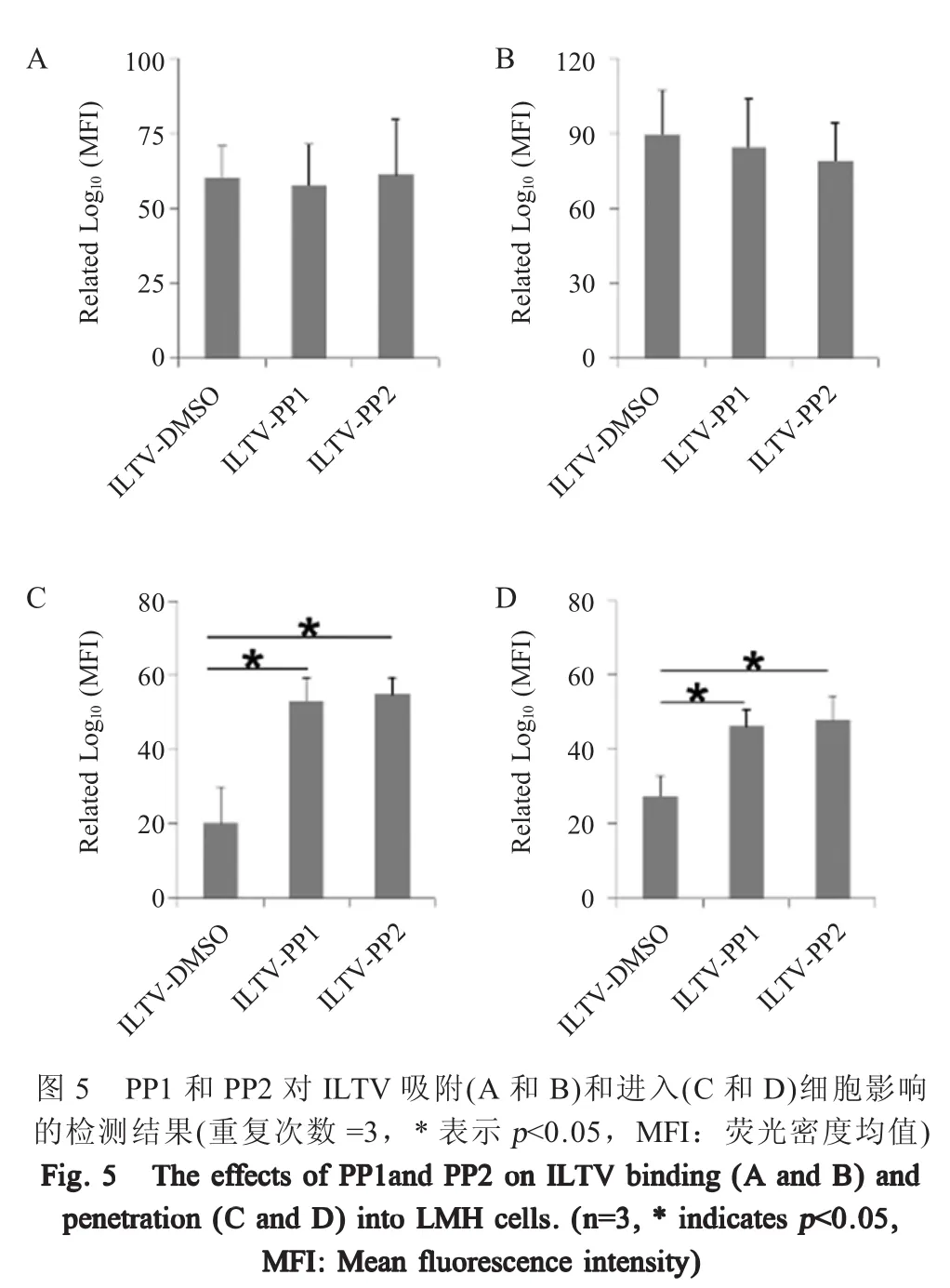
1.6 PP1和PP2对ILTV吸附和进入细胞影响的检测 病毒吸附和进入宿主细胞均可能影响ILTV在细胞-细胞间的扩散,为检测PP1和PP2对ILTV吸附细胞的影响,本试验按“1.3”所述培养细胞并添加PP1和PP2后获得悬浮细胞,与Dil(3 μmol/L)预染色的病毒(MOI 1)4℃避光孵育1 h,收集细胞,利用流式细胞仪检测。同时,获得悬浮细胞与未染色的病毒(MOI 1)4℃避光孵育细胞1 h后收集细胞,利用ILTV gI抗体作为一抗,羊抗兔IgGFITC为二抗,利用流式细胞仪进行检测。
本研究采用流式细胞仪检测荧光染料R18在细胞膜上的扩散程度以确定PP1和PP2对ILTV进入细胞的影响。用R18(3 μmol/L)对病毒囊膜进行染色,按“1.3”所述培养细胞,分别在接种病毒前后添加PP1和PP2,DMSO处理作为对照。按“1.5”所述获得悬浮的未感染细胞,用预染色的病毒(MOI 1)在4℃避光孵育细胞,1 h后转移至37℃、5%CO2培养箱内培养1 h以促进病毒进入,消化离心获得的细胞应用流式细胞仪检测。上述实验结果均以流式细胞仪检测得到的荧光密度均值(MFI)反映病毒吸附或进入LMH细胞的水平。
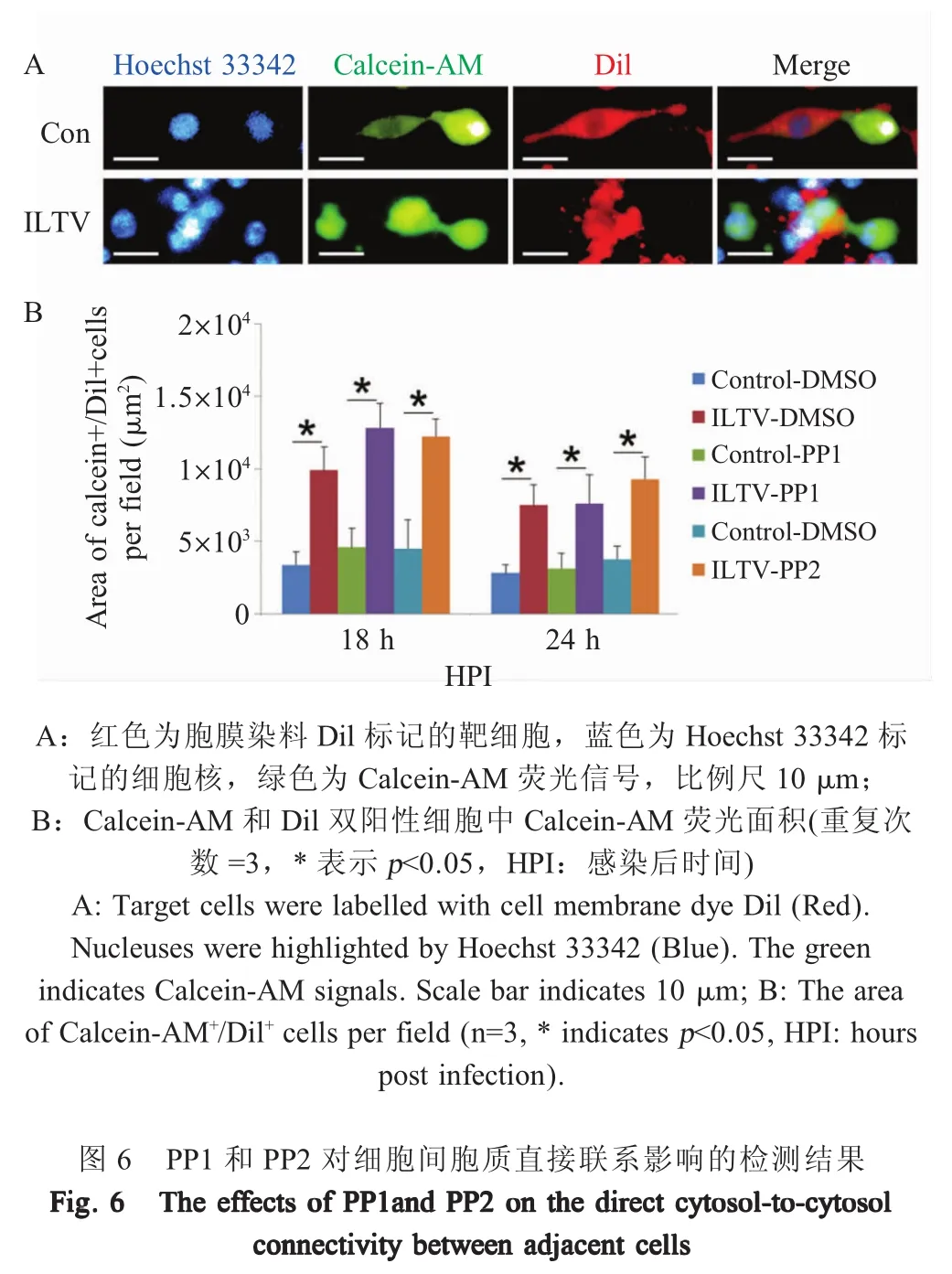
1.7 PP1和PP2对细胞间胞质直接联系影响的检测 为了明确细胞间胞质直接联系是否参与PP1和PP2促进ILTV在细胞-细胞间扩散的过程,本试验将ILTV以MOI 1的剂量接种LMH细胞,收集细胞后在37℃避光条件下采用Hoechst33342对细胞核染色,Calcein-AM(10 μmol/L)对病毒感染细胞质染色,采用Dil(3 μmol/L)对未感染细胞胞膜染色,染色时间均为30 min。将Calcein-AM染色细胞和Dil染色靶细胞按照1:50比例混匀后共同接种96孔板,于37℃、5%CO2条件下继续培养至单层后分别添加 PP1(2 μmol/L)和 PP2(20 μmol/L),在病毒感染 18 h和24 h后通过高内涵细胞筛选检测分析系统统计Calcein-AM和Dil双阳性细胞中的Calcein-AM荧光面积。试验设Calcein-AM(10 μmol/L)染色的未感染细胞为对照。
1.8 数据统计分析 高内涵细胞筛选系统检测应用系统中的Columbus软件统计分析染料荧光面积,统计参数如下:(1)Common Threshold=0.4;(2)Area>100 μm2;(3)Relative Spot Intensity=0.060;(4)Splitting Coefficient=1.0;(5)Insensity Cell Mean>150。本研究中的其它数据用SPSS软件包进行统计分析,数据以平均值±标准偏差(SD)的形式给出,应用双尾学生t检验检测差异的显著性,当p<0.05时表示差异统计显著。
2 结果
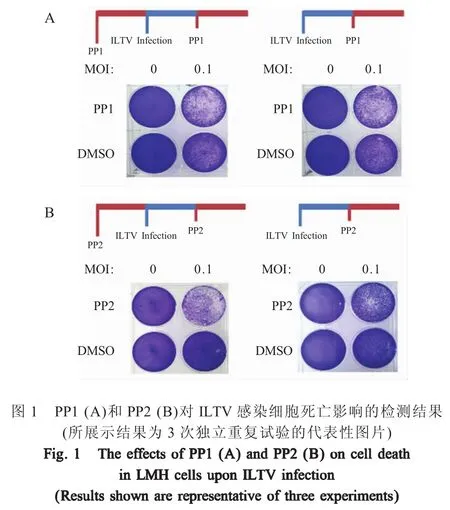
2.1 PP1和PP2对ILTV感染细胞死亡影响的检测结果 通过结晶紫染色检测PP1和PP2对ILTV感染细胞死亡的影响,结果显示ILTV感染24 h后细胞开始出现死亡,与DMSO处理细胞相比,经PP1和PP2处理的ILTV感染细胞死亡均明显增多,表明PP1和PP2对ILTV感染导致的细胞死亡具有促进作用(图1)。此外,与感染后添加PP1和PP2相比,在ILTV感染前预先添加PP1和PP2可以进一步促进高ILTV感染的细胞死亡(图1),提示PP1和PP2可能影响了ILTV的吸附或进入宿主细胞的过程。
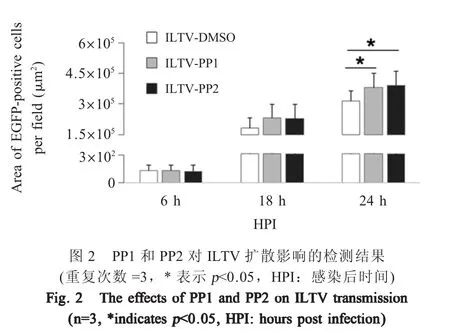
2.2 PP1和PP2对ILTV扩散影响的检测结果 应用高内涵细胞筛选检测分析系统检测并统计ILTV-EGFP感染经PP1、PP2预处理的LMH细胞后的EGFP荧光面积。结果显示,EGFP荧光在感染6 h已经出现,并随着时间的推移荧光强度不断增加。在病毒感染6 h和18 h时,PP1和PP2处理组EGFP荧光面积与对照组EGFP荧光面积相比均无显著差异(p>0.05);但在病毒感染24 h时PP1和PP2处理组EGFP荧光面积均显著大于对照组(p<0.05);PP1和PP2处理组之间EGFP荧光面积在所有检测时间点均无显著差异(图2)。表明PP1和PP2可以促进ILTV的扩散。
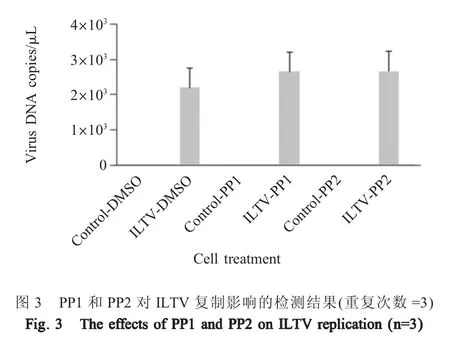
2.3 PP1和PP2对ILTV复制影响的检测结果 应用病毒特异性qPCR检测ILTV感染24 h后细胞中的病毒基因组拷贝数。结果显示,经PP1和PP2处理的细胞中病毒基因组拷贝数与DMSO对照组相比均无显著差异,PP1和PP2处理组之间的病毒基因组拷贝数也无显著差异(p>0.05)(图3)。表明PP1和PP2对ILTV复制均无影响,提示PP1和PP2对ILTV扩散的促进作用不依赖于病毒的复制。
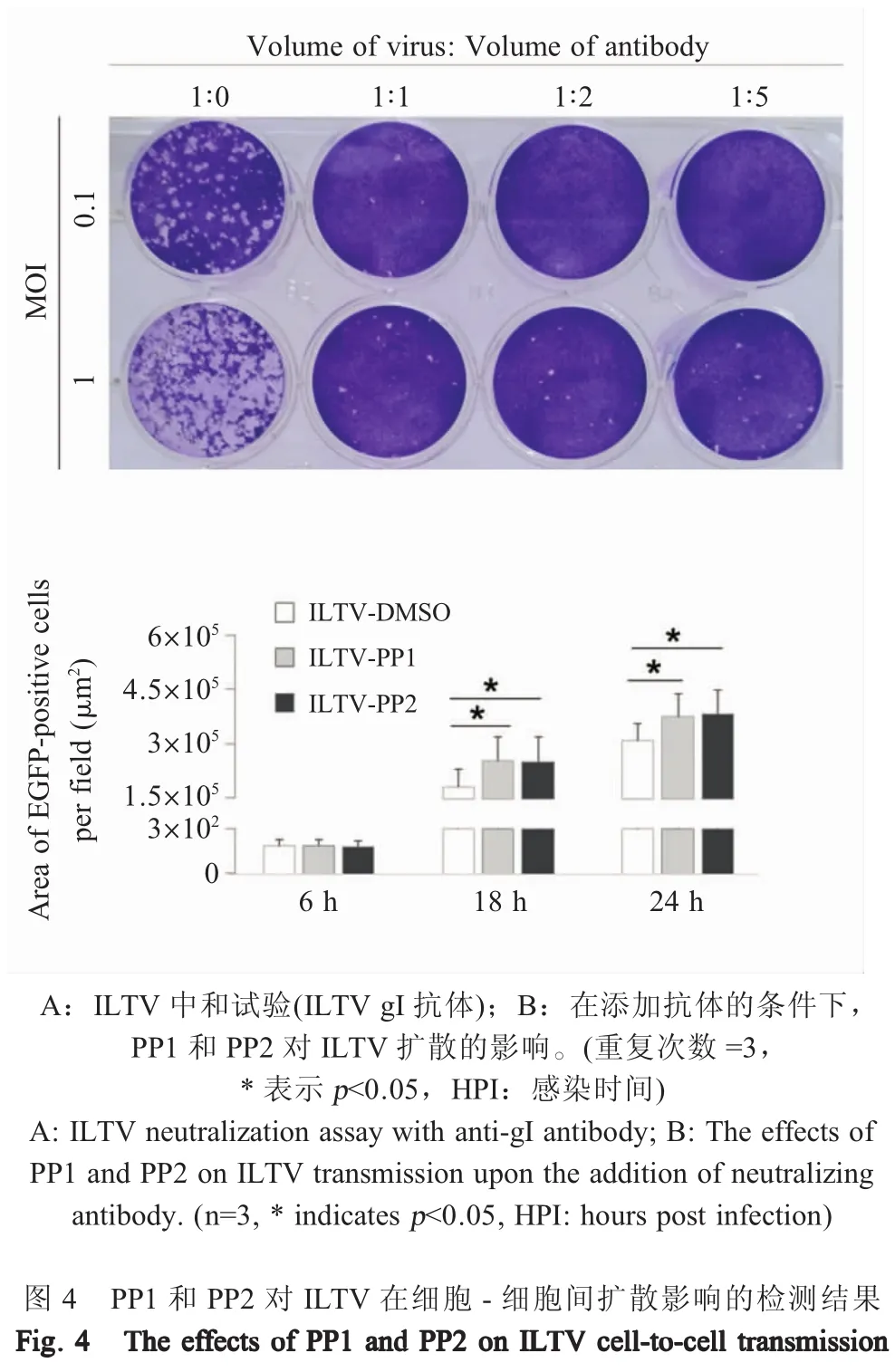
2.4 PP1和PP2对ILTV游离扩散影响的检测结果将ILTV gI抗体与病毒预混后感染LMH细胞,待感染24 h后经结晶紫染色,结果显示,在未添加ILTV gI抗体时,ILTV感染明显且引发细胞死亡,并且随着ILTV MOI的增加细胞死亡数量增多;在添加抗体后,细胞死亡明显减少,当病毒与抗体体积比为1∶2和1∶5时,MOI 0.1感染组已经观察不到细胞死亡(图4A)。以上结果表明,ILTV gI抗体能够中和病毒的感染,可以用于阻断病毒的游离扩散。进一步应用高内涵细胞筛选分析系统检测并统计ILTV-EGFP在LMH细胞中的扩散。结果显示,在感染6 h可以检测到EGFP荧光,荧光信号随着时间的推移不断增强,并且各处理组细胞荧光面积与未添加中和抗体细胞无明显差异(图2和图4B,p>0.05)。在添加抗体的情况下,在病毒感染18 h和24 h时均可以观察到PP1和PP2处理细胞EGFP荧光面积显著大于DMSO对照组(p<0.05)(图4B)。此外,PP1和PP2处理组之间EGFP荧光面积在所有检测时间点均无显著差异。以上结果表明,PP1和PP2对病毒扩散的促进作用并不依赖于ILTV在细胞间的游离扩散,提示PP1和PP2是通过调控ILTV在细胞-细胞间的传播来促进ILTV扩散的。
2.5 PP1和PP2对ILTV吸附和进入细胞影响的检测结果 在本研究应用Dil标记病毒囊膜,ILTV gI抗体标记细胞膜上吸附的病毒两种策略检测PP1和PP2对病毒吸附的影响,通过检测R18染料从病毒囊膜向宿主细胞膜扩散的程度检测PP1和PP2对病毒进入细胞的影响。结果显示,无论是PP1和PP2处理的细胞分别与DMSO对照细胞相比还是PP1和PP2处理的细胞之间相比,Dil荧光密度均值均无显著差异(图5A,p>0.05)。同时,ILTV gI抗体检测结果也获得了相同的结论(图5B,p>0.05)。上述结果表明PP1和PP2对ILTV吸附细胞均无显著影响。
R18荧光信号监测结果显示,无论在病毒吸附细胞前(图5C)还是病毒吸附细胞后(图5D)孵育PP1和PP2,PP1和PP2处理细胞R18的荧光密度均值均显著高于 DMSO对照组(图 5C和 5D,p<0.05),但PP1和PP2处理组之间的R18荧光密度均值无显著差异。表明PP1和PP2可以促进ILTV进入细胞。
2.6 PP1和PP2对细胞间胞质直接联系的影响应用高内涵细胞筛选检测分析系统检测供体细胞中Calcein-AM向Dil预染靶细胞转移的情况。结果显示,在未感染病毒的细胞中能够观察到Calcein-AM通过细胞-细胞间连接向Dil预染靶细胞扩散(图6A),对Calcein-AM和Dil双染细胞中的Calcein-AM荧光面积进行统计显示,病毒未感染组内的Calcein-AM荧光面积均在5 000 μm2以下,且PP1和PP2处理细胞与DMSO对照细胞之间均无显著差异(图6B,p>0.05),表明其发生概率极小。在病毒感染18 h和24 h时,无论PP1和PP2处理细胞与DMSO处理细胞相比还是PP1和PP2处理细胞之间相比,各组间Calcein-AM荧光面积均无显著差异(图6B,p>0.05),表明PP1和PP2对细胞间胞质直接联系无显著影响,提示细胞间胞质直接联系未参与PP1和PP2促进ILTV细胞-细胞间扩散这一过程,PP1和PP2可能通过其它方式促进ILTV细胞-细胞间扩散。
3 讨论
研究病毒和宿主的相互作用可以为AILT的防控开拓新思路。本研究探讨了两种化学小分子SRC抑制剂PP1和PP2对ILTV感染各阶段的影响。结果显示,PP1和PP2能促进ILTV感染后的细胞死亡。这与前期已发表研究发现敲低SRC表达水平可以促进ILTV感染细胞死亡的结果是一致的[6]。目前,宿主SRC和p53被鉴定是宿主细胞应答ILTV感染的重要调控因子[12-13],但是其发挥作用的具体分子机制尚不完全明确。本研究初步确定,PP1和PP2可以通过不依赖病毒复制、病毒游离扩散及细胞间胞质直接联系的方式调控ILTV在宿主细胞间的直接扩散,从而影响ILTV感染,为对其进一步的分子机制研究奠定了基础。
研究病毒的扩散机制对于理解病毒感染发病机理至关重要。目前,关于人疱疹病毒1型和牛疱疹病毒1型扩散机制研究报道较多,而关于ILTV扩散机制[14-15]的研究相对较少。本研究结果表明,PP1和PP2可以促进ILTV的扩散,并且该现象既不依赖于病毒复制也不受ILTV中和抗体的影响,表明PP1和PP2主要通过调控ILTV细胞-细胞间传播影响ILTV的扩散。细胞-细胞间传播可以被病毒吸附细胞、进入细胞、细胞-细胞间直接连接及细胞-细胞间接触传播等过程影响。本研究采用Dil标记病毒囊膜和抗ILTV gI糖蛋白的兔多克隆抗体标记细胞膜上吸附的病毒这两种策略检测PP1和PP2对病毒吸附的影响。其中,Dil是一种红色亲脂性囊膜染料,可以嵌入ILTV的囊膜中,在本研究对其所使用浓度和检测时间内对细胞及病毒活力没有显著影响。两种方法均发现,PP1和PP2对ILTV吸附LMH细胞没有影响,提示PP1和PP2可能不影响ILTV在宿主细胞膜上受体的表达及活性。本研究通过检测R18在宿主细胞膜上的扩散来研究PP1和PP2对ILTV进入细胞的影响。R18是一种能与脂膜结合的红色染料,在高浓度状态下为无荧光的二聚体,在低浓度时(膜融合)变成可以发光的单体。本研究在不影响病毒和细胞活性的前提下,使用高浓度R18预染ILTV囊膜,结果表明PP1和PP2能促进ILTV进入细胞,提示PP1和PP2可能改变了细胞膜的通透性,但其确切机制仍需进一步研究。细胞间胞质直接联系是病毒细胞-细胞间传播的途径之一,可以通过转运病毒基因组等多种方式促进病毒传播。其作用机制在HIV-1中已有深入研究[16]。本研究通过检测Calcein-AM在相邻细胞间的扩散来研究PP1和PP2对细胞间胞质直接联系的影响。Calcein-AM是一种绿色荧光染料,它能与细胞质亲密结合,并在细胞质内自由流动。当两个细胞之间相互连通时,Calcein-AM能通过细胞膜上的孔道直接进入相邻细胞的细胞质。本研究结果表明,细胞间胞质直接联系并没有参与到PP1和PP2促进ILTV扩散这一过程,提示PP1和PP2可能是通过其它方式促进ILTV在细胞-细胞间扩散。目前,多种不依赖于细胞间胞质直接联系的病毒细胞-细胞间扩散机制已经被报道。例如,病毒在感染细胞后可以通过诱导感染细胞与未感染细胞之间形成病毒性突触而进行传播[3];在人疱疹病毒感染中,未感染细胞发生极化迁移至感染细胞周围,从而促进病毒有效地传播[14];在牛痘病毒感染中,感染细胞通过在宿主表面表达两种蛋白分子而促进病毒在细胞间的快速传播[17]。为确定PP1和PP2具体通过何种方式促进ILTV在细胞间传播还需进一步研究。本研究初步确定了PP1和PP2影响ILTV感染的具体作用方式,为进一步对ILTV的分子机制研究奠定了基础,对其它疱疹病毒与宿主互作研究也具有一定的参考意义。
