脾脏硬化性血管瘤样结节性转化超声表现
2019-07-30张秀娟陈志奎钱清富陈卉品童林燕薛恩生林礼务
张秀娟,陈志奎*,钱清富,陈卉品,童林燕,薛恩生,林礼务
(1.福建医科大学附属协和医院超声科暨福建省超声医学研究所,福建 福州 350001;2.厦门大学附属中山医院超声科,福建 厦门 361004;3.福建医科大学附属漳州市医院超声科,福建 漳州 363000)
脾脏硬化性血管瘤样结节性转化(sclerosing angiomatoid nodular transformations, SANT)是脾脏原发良性瘤样病变[1],较罕见,对其临床及影像学特征认识不足,术前正确诊断率低[2-3]。本研究回顾性分析经手术切除后病理确诊的8例脾脏SANT的声像图特征,并与病理表现进行对照,以期提高对本病的认识及超声诊断准确性。
1 资料与方法
1.1 一般资料 收集2012年1月—2017年12月于福建医科大学附属协和医院手术并经病理证实的8例脾脏SANT患者,男5例,女3例,年龄31~60岁,中位年龄39岁。8例患者均无腹痛等症状,其中7例因健康体检超声检查时发现,另1例因其他疾病住院接受超声检查时发现。
1.2 仪器与方法 采用Toshiba Aplio 500、GE Logiq E9等彩色多普勒超声诊断仪,凸阵探头,频率3.5~5.0 MHz。嘱患者平卧或右侧卧,探头置于左肋间进行斜切扫查,必要时建立胃窗经左肋下斜切扫查。以二维超声常规测量脾脏大小,观察脾实质回声及脾周围毗邻组织结构;以彩色多普勒超声观察脾门及脾内血管。发现病灶时,观察病灶的部位、大小、最小径/最大径比值、形态、边界、内部回声、病灶血流分布情况和血流Adler分级。对其中1例患者行CEUS,造影剂为SonoVue,加入5 ml生理盐水制成微泡混悬液,抽取2.5 ml经左肘正中静脉团注,观察120 s结节强化情况。
1.3 病理检查 对8例患者均行脾切除术,标本经固定、脱水、石蜡包埋后连续切片,行HE染色及CD31、CD34、CD8、SMA、Vimentin等免疫组织化学检查。
2 结果
2.1 脾脏SANT的超声表现 8例脾脏SANT中,5例单发,3例多发,对其中1例可见2个病灶、2例多于2个病灶者取其体积最大病灶,共计9个病灶。病灶位于脾上部3个,下部3个,中上部1个,中下部2个;其中7个病灶呈外生性生长,肿块突出于脾脏表面(图1)。病灶最大径3.3~8.2 cm,平均(5.48±1.69)cm,最小径3.0~6.9 cm,平均(4.46±1.32)cm,最小径/最大径比值为0.66~1.00,平均0.87±0.10,病灶形态均较规则,呈类圆形,边界尚清晰,呈等或偏低回声,内部回声欠均匀,可见数量不等的条状或小片状高回声分布(图2);血流信号稀少或无血供,部分肿块周边可见受压绕行的血管(图3)。1例患者CEUS动脉期可见不均匀增强,增强强度明显低于周边正常脾脏组织,静脉期呈低增强。所有病灶均未见明显囊性变或钙化(表1)。术前超声诊断为血管瘤3例,1例考虑良性病变,4例未能定性诊断。
2.2 病理表现 大体病理剖面见病灶边界尚清楚,但无明显包膜,病灶内可见黄白色的纤维硬化组织包绕、分隔棕褐色的血管瘤样结节(图4A)。镜下呈增生纤维组织包绕的单个或多个血管瘤样结节,结节内为裂隙样或不规则扩张的血管腔,内衬肿胀的内皮细胞,未见出血或坏死(图4B)。免疫组织化学检查可见结节内毛细血管内皮细胞CD31(+)、CD34(+)、CD8(-),部分血窦内皮细胞CD31(+;图4C)、CD34(-)、CD8(+),梭形细胞Vimentin(+)、SMA(+)。
3 讨论
脾脏原发性肿瘤或肿瘤样病变较少见[4],SANT更为罕见,目前对其发病机制仍缺乏足够的认识。一般认为SANT是一种慢性反应性病变,与脾内病变如血管瘤、炎症性肌纤维母细胞瘤、错构瘤等关系密切,是脾内多种病变的最后转归[5]。脾脏SANT呈良性生物学行为,手术切除预后良好[6]。脾脏SANT较多见于中老年女性,男女比例约1.0∶1.3,偶见于儿童[7];临床缺乏特异性症状和体征,少数可出现上腹部隐痛,患者大多为体检超声检查时发现而就诊。本组8例SANT均无症状,为影像学检查时偶然发现。
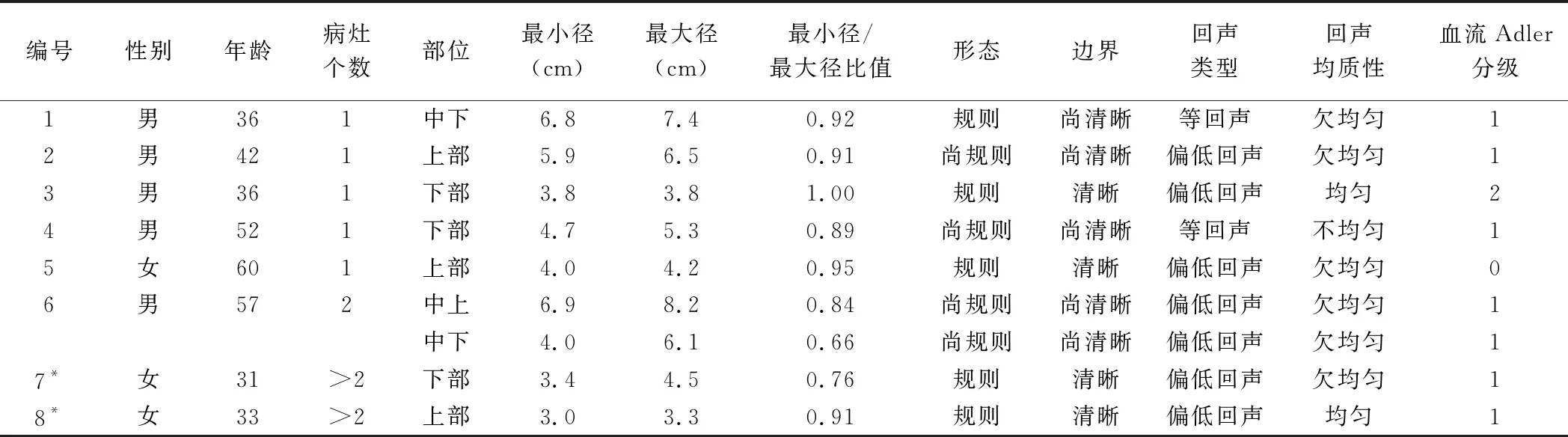
表1 8例脾脏SANT患者的一般资料及超声表现
注:*:多个病灶,取最大病灶进行分析
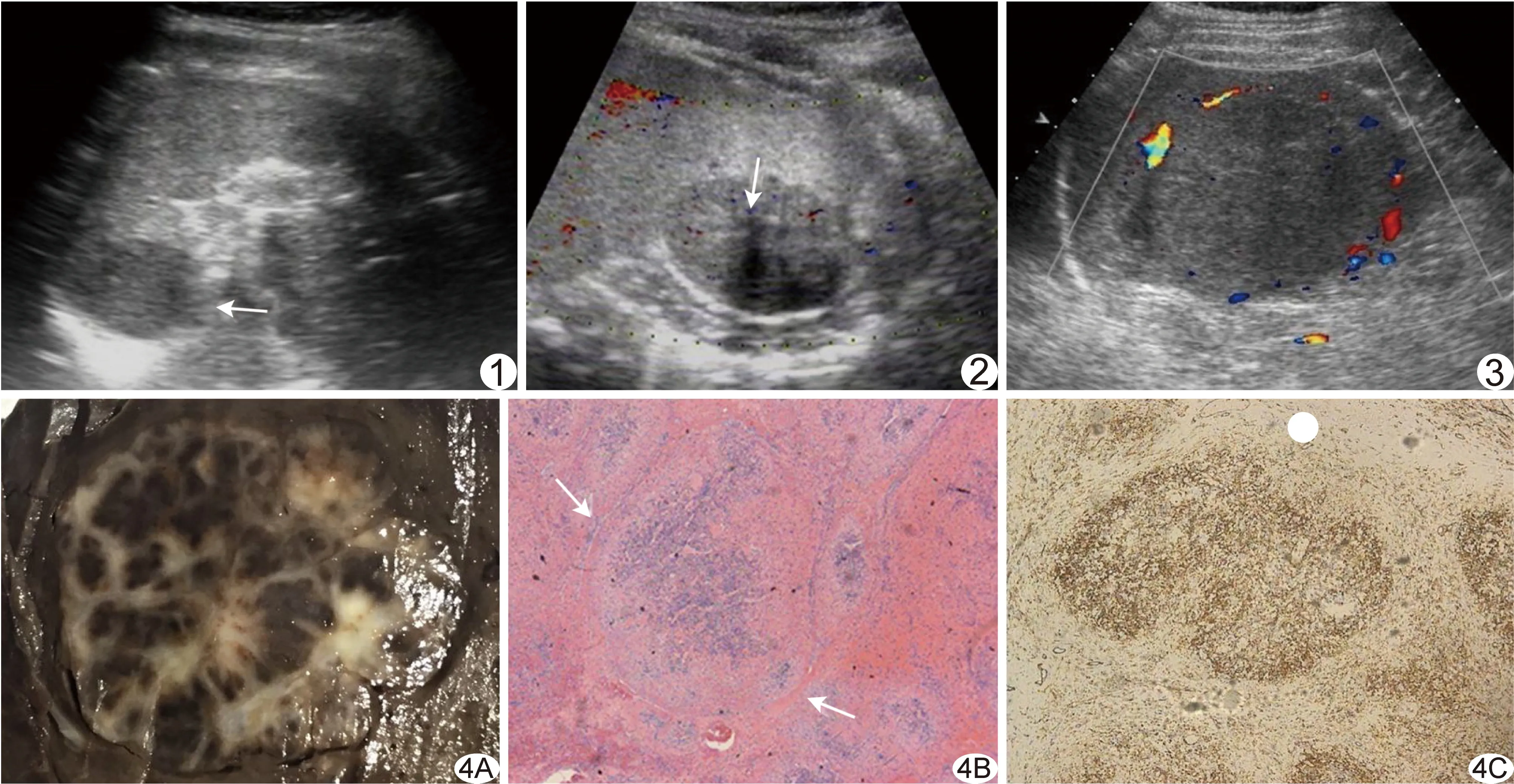
图1 患者女,33岁 脾脏SANT病灶位于脾上部,突出于脏面外(箭) 图2 患者女,31岁 脾脏SANT病灶呈偏低回声(箭),内可见条状高回声 图3 患者男,36岁 脾脏SANT病灶血供稀少,周边可见受压绕行血管 图4 病理图 A.大体病理示病灶内可见黄白色纤维硬化组织包绕棕褐色的血管瘤样结节; B.镜下血管瘤样结节周边见纤维组织包绕(箭;HE,×40); C.免疫组织化学检查见血管瘤样结节呈棕黄色(CD31,×40)
多数研究[8-9]报道脾脏SANT的病例数均较少,病灶单发多见,本组8例中5例为单发病灶。由于脾脏SANT患者多无症状,为偶然发现,病灶多较大,本组病灶平均最大径为(5.48±1.69)cm,形态较规则,呈类圆形,最小径/最大径比值为0.87±0.10。本组发现脾脏SANT病灶多靠近脾脏表面,并向外生长。脾脏SANT病灶无包膜,部分可见假包膜,超声检查病灶边界多较清晰,与大体病理表现一致。本组脾脏SANT病灶超声多表现为等或偏低回声,内部回声多欠均匀,可见数量不等的条索状或小片状高回声,为病灶内较粗大的纤维硬化组织,包绕、分隔血管瘤样结节[10]。脾脏SANT病灶少有出血囊性变或钙化,本组9个病灶均未见相应超声表现。
由于SANT发病率低,临床对其认识不足,影像学检查易误诊。本组8例SANT,3例诊断为血管瘤,1例考虑良性病变,4例未能定性诊断。脾脏SANT应与血管瘤、淋巴管瘤以及转移性肿瘤等相鉴别。典型脾血管瘤呈形态较规则的高回声病灶,边界清,内部回声可呈筛窦样,部分病灶可呈囊实性;而SANT多表现为中等或偏低回声,病灶体积较大,囊性变罕见。脾淋巴管瘤多呈囊性或囊实性,呈实性中高回声的海绵状淋巴管瘤较少见;而SANT多为实性,呈等或偏低回声,病灶内常可见条状或小片状纤维硬化组织,有助于鉴别。脾转移性肿瘤并不多见,患者一般有相应原发肿瘤病史。本组1例乳腺癌术后患者,定期复查发现脾脏占位,PET/CT与MRI均考虑为转移瘤,超声表现为脾中上部边界清晰的偏低回声团块,内可见条索状高回声,诊断为血管瘤,术后病理证实为SANT。
对比影像学检查对定性诊断脾脏SANT具有一定参考价值[1,11]。杨旦君等[12]报道10例脾脏SANT的增强MRI表现,发现病灶多呈向心性、渐进性强化,其中7例可见辐条轮状强化,延迟期呈等或高信号,内均见裂隙。Watanabe等[10]报道1例SANT的CEUS表现,发现病灶在动脉早期见多条动脉从周边穿入肿块中央,呈轮辐状,动脉期呈高增强,静脉期消退略早于周边脾脏实质。本组1例脾脏SANT接受CEUS,动脉期可见不均匀增强,但增强强度明显低于周边正常脾脏组织,静脉期呈低增强。脾脏SANT的CEUS特征仍有待积累更多病例资料分析。
综上所述,脾脏SANT好发于中老年人,临床缺乏特异性表现,病灶体积多较大,单发多见,常呈外生性生长;病灶形态较规则、边界较清晰,呈等或偏低回声,内回声欠均匀,常可见条索状或小片状分布的中高回声,但少有囊性变或钙化,血供稀少。
