解淀粉芽孢杆菌BA-26抗菌物质分离及对灰葡萄孢抑菌作用研究
2019-07-29刘超刘洪伟汪步青赵雯雅王雅娜张丽萍
刘超 刘洪伟 汪步青 赵雯雅 王雅娜 张丽萍
(1. 河北工业大学,天津 300000;2. 河北省科学院生物研究所,石家庄 050081;3. 河北省主要农作物病害微生物控制工程技术研究中心,石家庄 050081)
芽孢杆菌(Bacillus)由于能产生多种胞外生物活性物质,在医药、食品、农业及工业领域有着广泛的应用前景[1]。产生的胞外抑菌活性物质可分为由核糖体途径合成的抑菌物质:细菌素、抗菌蛋白、几丁质酶、β-1,3-葡聚糖酶和由非核糖体途径合成的抑菌物质:表面活性素、伊枯草素、芬荠素、聚酮类化合物等[2]。其中,细菌素及表面活性素、伊枯草素、芬荠素及抗菌蛋白类物质的研究较多[3]。从解淀粉芽孢杆菌FZB42中分离的环状细菌素(Amylocyclicin)对革兰氏阳性细菌有较好抑制作用[4];解淀粉芽孢杆菌SP-1-13LM 产生的细菌素(PPB),能抑制李斯特氏菌、沙门氏菌和志贺氏杆菌。杨瑞先等[5]分离到两株解淀粉芽孢杆菌Md31和Md33对牡丹病原菌有良好抑制效果,所产脂肽类粗提物也具有较强的体外抑菌活性。郭继平等[6]筛选到的一株解淀粉芽孢杆菌生防菌能分泌多种抗菌蛋白并对葡萄霜霉病有抑制作用。关于解淀粉芽孢杆菌抗菌物质的分子结构、功能特性及应用研究,集中在多种抑菌活性物质,对单一物质的研究缺乏。
解淀粉芽孢杆菌产生的不同抑菌活性物质其抑菌作用机制不同。细菌素可影响细胞膜的渗透压[7],几丁质酶可降解真菌的细胞壁[7],β-1,3-葡聚糖酶通过水解β-1,3-糖苷键破坏真菌细胞壁[8]。表面活性素能改变细胞膜通透性使细胞内离子流出[9],伊枯草素能使真菌菌丝分解和抑制孢子萌发[10],芬荠素有良好的脂溶性能与细胞膜磷脂层反应[11]等。潘虹余等[12]发现解淀粉芽孢杆菌 B15 产生的伊枯草素A和芬荠素以协同作用诱导细胞凋亡的形式来抑制灰葡萄孢菌丝的生长。但不同抗菌物质对灰葡萄孢的作用效果和作用机制有待进一步研究。
本实验室在前期筛选到一株解淀粉芽孢杆菌BA-26其代谢产物抑菌活性强,研究表明具有酸碱稳定性、热稳定性和蛋白酶稳定性[13]。本研究分离纯化了菌株BA-26胞外抑菌物质并将初步分离的粗提物及纯化后的抗菌物质对灰葡萄孢进行抑菌作用研究。了解此菌株发酵液中抑菌物质存在情况和抑菌作用机制,为其进一步应用尤其在防治植物病原真菌病害方面的应用奠定研究基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株 解淀粉芽孢杆菌(B. amyloliquefaciens)BA-26、番茄灰霉病菌(B. cinerea)来自于河北省科学院生物研究所微生物研究室。
1.1.2 主要试剂和仪器 Amberlity XAD-7HP大孔树脂,美国Sigma公司;乙腈、甲醇和三氟乙酸为美国Fisher Chemical色谱纯试剂;LC-20A HPLC系统,日本Shimadzu公司。
1.2 方法
1.2.1 菌株BA-26胞外抗菌物质的分离纯化
1.2.1.1 硫酸铵盐析 采用硫酸铵沉淀法制备抗菌粗提物。取菌株BA-26培养48 h的无菌发酵液2 L,加入硫酸铵固体使饱和度达到60%,4℃静置12 h,然后8 000 r/min离心30 min,收集沉淀和上清液,取沉淀溶于5 mL无菌水,检测抑菌效果。此沉淀即为抗菌粗提物(Antibacterial crude extract,A)。
1.2.1.2 大孔树脂吸附法 取由2 L发酵液所得的抗菌粗提物,以 600 mL的无菌水溶解,加入20-60目大孔树脂200 g,4℃下摇匀12 h。树脂经过滤收集后,用蒸馏水洗涤3次,再分别用200 mL 10%、20%、30%……100%乙醇(V/V)依次洗涤[14]。收集各组分洗脱液,在旋转蒸发器中42℃减压蒸干。收集蒸干组分分别溶于5 mL无菌水于4℃保存备用。
1.2.1.3 高效液相色谱法 采用SHIMADZU LC-20A高效液相色谱分析进一步纯化[15]。流动相A为含0.1%(V/V)三氟乙酸的乙腈,流动相B为含0.1%(V/V)三氟乙酸的超纯水。将大孔树脂分离样品加载到WondaSil C18 4.6 mm×150 mm、粒径5 μm色谱柱中,以10%-90%乙腈为线性梯度洗脱,流速为1 mL/min,检测波长为214 nm。收集各保留时间所对应的组分,经氮吹浓缩,冷冻干燥后称重,于-20℃保存备用。
1.2.2 抗菌物质的抑菌活性测定
为了孕育你,数月忍受胆汁俱下的呕吐之苦;为了你的降临,忍受人间最惨烈的裂骨之痛;你的一个小翻身,她都会醒来呵护,数年没睡过一晚安稳觉;你第一次抬头,第一次爬行,坐起站立学步,甚至怎样拿筷子……点滴成长都伴随着她的心血……你总认为你现在是最难的。其实,世上最难的职业,叫做妈妈。
1.2.2.1 对病原真菌活性测定 采用平板对峙法,将50 mL病原真菌孢子悬液(1×106CFU/mL)与300 mL 融化的PDA培养基混合均匀后,倒入培养皿中,待凝固后,均匀打孔直径为8 mm。每孔加100 μL待测物质,于26± 1℃下培养2-4 d,观察是否有抑菌圈产生并测量抑菌圈直径大小。每个处理重复3次。
1.2.2.2 对细菌活性测定 于平板上挑取细菌单菌落,接种至装有30 mL LB培养基的100 mL锥形瓶中,37℃,180 r/min培养14 h。采用平板倾注法[16],将细菌菌液与LB固体培养基混合均匀,在含菌平板上均匀打孔直径为8 mm。每孔加100 μL待测物质,37℃培养20 h,测量抑菌圈直径大小。每个处理重复3次。
1.2.3 BA-26活性组分对灰葡萄孢菌丝的影响 挑取灰葡萄孢菌丝于载玻片上,用无菌生理盐水冲洗后,用超纯水溶解浓度为1 mg/mL的活性组分处理灰葡萄孢菌丝6 h,无菌生理盐水冲洗后用0.04%台盼蓝染色30 min,置于显微镜下观察。以未经处理的菌丝为对照,每个处理重复3次。
1.2.4 BA-26活性组分对灰葡萄孢孢子萌发的影响 采用凹玻片悬滴法制片观察。分别取少量BA-26活性组分,用超纯水溶解制成1 mg/mL的溶液。各取50 μL无菌活性组分溶液与50 μL液体PDA 培养基混合,再与100 μL灰霉孢子悬液(1×106CFU/mL)混合后于无菌凹玻片上26 ± 1℃培养,每6 h后使用显微镜观察孢子萌发情况。以未经处理的孢子为对照,每个处理重复3次。
1.2.5 BA-26活性组分的最小抑菌浓度测定 采用二倍稀释法[17]配制浓度为 3.91、7.81、15.63、31.25、62.50、125.00、250.00、500.00和 1000.00μg/mL的抗菌物质组分,各取100 μL加入琼脂孔中。置于26 ± 1℃培养2 d后,分别测量抑制区半径来确定对菌丝体的抑制效果。以70%的乙腈水溶液为对照,每处理组分重复3次。
1.2.6 统计分析 实验数据采用SPSS 17.0统计软件分析处理,以平均值±标准差表示,经Duncan氏新复极差法检验,不同小写字母表示在P<0.05水平差异显著。
2 结果
2.1 菌株BA-26抗菌物质分离纯化及抗菌粗提物的抑菌谱
2.1.1 硫酸铵盐析 对菌株BA-26无菌发酵液,进行硫酸铵盐析。以番茄灰霉病菌为指示菌,硫酸铵盐析后上清液和无菌水为对照,检测抑菌活性。研究结果(图1)表明,不同饱和度的硫酸铵盐析时,沉淀和上清液的抑菌活性不同,在硫酸铵饱和度为60%时获得沉淀抗真菌活性最强,并且上清液没有抑菌活性。为达到将尽可能多的活性物质沉淀的效果,选择饱和度为60%作为制备抗菌粗提物的最佳硫酸铵浓度。
2.1.2 菌株BA-26抗菌粗提物的抑菌谱 饱和度为60%硫酸铵沉淀获得抗菌粗提物检测结果(表1)显示:菌株BA-26抗菌粗提物对所试12种真菌都有十分明显的抑制作用,抑菌圈直径均在15.7 mm以上。其中接骨木镰刀菌、番茄早疫病菌、立枯丝核菌、番茄灰霉病菌、苹果轮纹病菌、三七病原菌、米曲霉菌的抑制作用很强,抑菌圈直径分别达到34.7、36.3、40.0、30.3、30.7、39.3和30.4 mm;而对金黄色葡萄球菌和大肠杆菌没有抑菌作用。菌株BA-26抗菌粗提物中的抑菌物质主要为抗真菌物质,该抑菌物质抑菌谱广。
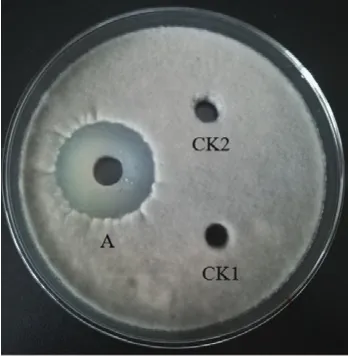
图1 解淀粉芽孢杆菌BA-26抗菌粗提物活性检测
2.1.3 大孔树脂分离结果分析 硫酸铵沉淀获得的抗菌粗提物经大孔树脂吸附分离,除未吸附的组分外,共得到了10个组分,即A1-A10。由表2可知,不同分离组分表现出不同的抑菌活性,经体积分数为60%乙醇水溶液洗涤后的组分A6的抗真菌效果最好。比较每一级组分抑菌活性大小,发现抑菌物质集中出现在中间这些级分,说明存在的抑菌活性物质可能兼有亲水性和亲脂性的特点。选择抑菌活性最强的A6组分进一步分离纯化。
2.1.4 反相高效液相色谱法分离纯化结果分析 采用反相高效液相色谱法(RP-HPLC)进一步纯化结果见图2。活性物质A6 组分在不同波长下进行检测,在214 nm 处有较大吸收峰,所以选择检测波长为214 nm。菌株BA-26活性组分A6中至少有34类组分,即A6-1-A6-34。它们中大部分都不是单一峰,表明它们不是单一物质。这与芽孢杆菌产生的抗菌物质中可能存在很多结构相似的异构体和同系物,很难分离到单一物质的特征相符。将这34类组分冷冻干燥后用70%乙腈水溶液溶解进行抑菌活性追踪。检测结果发现,对应保留时间为29 min时的A6-15组分和保留时间为34-43min时的A6-19-A6-28各组分具有抗真菌活性。

表1 解淀粉芽孢杆菌BA-26抗菌粗提物对不同病原真菌的抑菌直径

表2 解淀粉芽孢杆菌BA-26抗菌粗提物分离组分对番茄灰霉病菌的抑菌圈直径
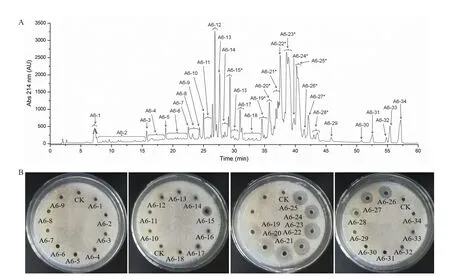
图2 菌株BA-26抗菌粗提物分离组分A6的反相高效液相色谱图及活性峰检测
2.1.5 活性组分对灰葡萄孢的抑菌作用 将经RPHPLC分离的活性组分,配制成浓度为1 mg/mL的溶液并检测抑菌活性。由图3可知,不同组分的抗菌物质对灰葡萄孢抑菌作用不同,其中A6-19组分抑制效果最好,抑菌圈直径达27.4 mm,A6-20组分的抑菌圈直径为27.1 mm与之相比无显著差异;A6-21组分抑菌圈直径为24.8 mm强于A6-22、A6-27和A6-28这些相互之间抑菌效果无差异组分;A6-22、A6-23、A6-24、A6-25组分的抑菌效果无显著差异,它们的抑菌圈直径分别为23.3、23.2、22.8和22.7 mm;A6-26组分抑菌效果相对较弱抑菌圈直径为21.0 mm;A6-15组分抑菌效果低于所有组分抑菌圈直径为17.9 mm。说明菌株BA-26的主要抗菌物质存在于A6-19-A6-28这些组分。
2.2 菌株BA-26胞外活性物质对灰葡萄孢抑菌作用研究
2.2.1 活性组分对灰葡萄孢菌丝形态的影响 如图4中所见,经抗菌物质处理培养6 h后观察,未经抗菌物质处理的灰葡萄孢菌丝形态饱满,表面光滑,正常生长并向四周扩展,在分生孢子梗末端观察到孢子的产生(图4-A)。A6-15组分处理的菌丝,菌丝形态变化不明显,与对照相比菌丝结构完整,仅能观察到菌丝明显弯曲,未出现膨大变粗,也未观察到菌丝内容物外流(图4-B)。而A6-19-A6-28这些组分在其抗菌物质的作用下菌丝形态变化明显,表现出相似的特征,菌丝细胞畸形,菌丝体弯曲变粗,中部肿胀,顶端膨大,分枝菌丝生长受阻(图 4-C,4-D)。
2.2.2 活性组分处理灰葡萄孢菌丝后台盼蓝染色台盼蓝染色结果显示:未经处理的菌丝形态正常未被染色(图5-A);A6-15组分处理的灰葡萄孢菌丝未被染色(图5-B);A6-19-A6-28这些组分处理的灰葡萄孢菌丝生长受阻,有明显的膨大,部分菌丝出现较大的囊泡部分,经台盼蓝染色后,镜检时发现菌丝呈现蓝色(图5-C)。说明A6-19-A6-28这些组分抗菌物质的作用机制可能与破坏灰葡萄孢菌丝的细胞膜有关。
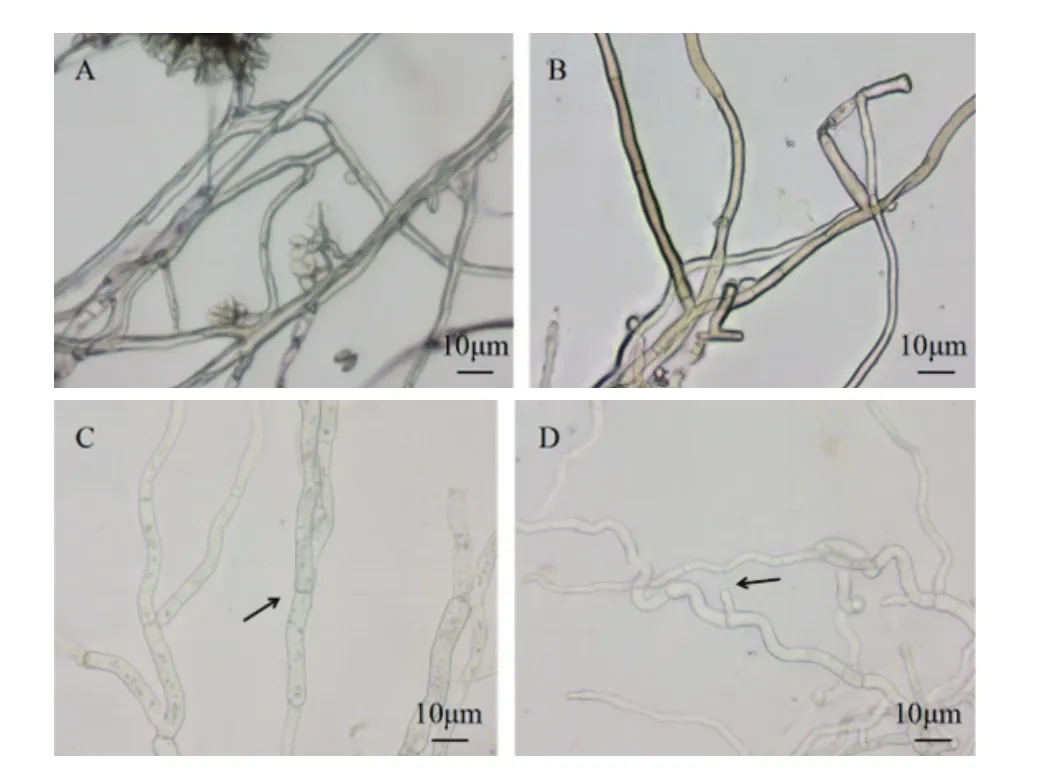
图4 菌株BA-26抗菌粗提物RP-HPLC分离活性组分对灰葡萄孢菌丝形态的影响

图5 菌株BA-26抗菌粗提物RP-HPLC分离活性组分处理灰葡萄孢菌丝台盼蓝染色
2.2.3 活性组分的最小抑菌浓度 测定A6-15和A6-19-A6-28各组分对灰葡萄孢的MIC,结果如表3所示。A6-19-A6-28这些组分对灰葡萄孢的抗菌作用高于A6-15组分。其中,A6-19和A6-20组分对灰葡萄孢的抗菌活性最强,最小抑菌浓度为7.81 μg/mL。

表3 菌株BA-26抗菌粗提物RP-HPLC分离活性组分对灰葡萄孢的MIC值
2.2.4 活性组分对灰葡萄孢孢子萌发的影响 经活性物质处理的灰葡萄孢孢子培养36 h后观察其萌发抑制情况。由图6可知,未经处理的孢子萌发明显,长出相当于孢子径6-10倍的菌丝(图6-A);A6-15组分对灰葡萄孢孢子萌发的抑制作用最强,从培养开始至36 h时,均未萌发,但未观察到有孢子破裂(图6-B);A6-19-A6-28这些组分对灰葡萄孢孢子萌发的抑制作用仍相对较强,培养至12 h时有少量孢子萌发,36 h时萌发菌丝长度仅相当于孢子径的2-4倍,已萌发的菌丝膨大变粗(图6-C)。

图6 菌株BA-26抗菌粗提物RP-HPLC分离活性组分对灰葡萄孢孢子萌发抑制情况
3 讨论
解淀粉芽孢杆菌是革兰氏阳性需氧型杆菌,产生的生物活性物质丰富。Ashokkumar等[18]从红树林生态系统中分离出解淀粉芽孢杆菌VCRC B483通过80%硫酸铵沉淀获得的粗提物显示对镰刀菌属和新月弯孢霉属的抗菌活性;卢彩鸽等[19]从漠河多年永冻土层中分离的拮抗菌解淀粉芽孢杆菌MH71,对多种植物病原真菌和细菌具有较强的拮抗作用,发酵液对番茄灰霉病的防效为92.8%。本研究中BA-26菌株的抗菌粗提物显示出强的抗不同真菌活性,对立枯丝核菌的抑菌活性最强,抑菌圈为40.0 mm。菌株BA-26的次级代谢产物对大部分病原真菌有显著抑菌效果,具有开发为新型生防制剂的潜力。
关于芽孢杆菌抗菌物质的抑菌作用研究,通常是通过制备无菌发酵液或抗菌粗提物进行。潘虹余等[12]探究了解淀粉芽孢杆菌B15发酵液对葡萄病原菌灰葡萄孢的抑菌机理,然而由于抗菌物质种类较多,对于某一种物质的抑菌作用并不清楚。本实验发现解淀粉芽孢杆菌BA-26发酵液中产生的抗菌物质对灰葡萄孢菌丝生长发育的影响,主要表现在菌丝畸形膨大变粗、分支菌丝生长受阻、细胞膜被破坏通透性增加。此外,最强抗真菌活性物质的最小抑菌浓度为7.81 μg/mL,对灰葡萄孢孢子萌发抑制效果明显。
显微镜观察结果显示,经A6-15组分处理的菌丝,菌丝形态变化不明显,未出现膨大变粗,也未观察到菌丝内容物外流。但A6-19-A6-28这些组分在其抗菌物质的作用下菌丝形态变化明显,表现出明显的抑制作用,菌丝细胞畸形,菌丝体弯曲变粗,中部肿胀,顶端膨大,分枝菌丝生长受阻。本实验中11种活性组分的浓度均为1 mg/mL,已达到其最小抑菌浓度。此实验结果可能是由于A6-15组分中抗菌物质的最小抑菌浓度比A6-19-A6-28这些组分明显高造成的,A6-15组分中的抗菌物质能否使真菌菌丝形态发生相似的改变,还需在不同浓度下进行实验验证。而在活性组分对孢子萌发影响的实验中,观察到相反结果,虽然A6-15组分中抗菌物质的最小抑菌浓度比A6-19-A6-28这些组分明显高,但A6-15组分中抗菌物质对孢子萌发抑制作用更强。不同抗菌物质之间是否存在协同抑菌作用,不同浓度下对真菌菌丝和孢子萌发的抑制作用有无差异,还有它们都有哪些作用机制。这些问题都将是未来的研究方向。
从解淀粉芽孢杆菌的次级代谢产物中分离抗菌物质的报道,朱弘元[20]在对解淀粉芽孢杆菌B15有效抑菌成分研究时发现了亲水性和亲脂性的脂肽类物质,包括iturin A及其同系物、fengycin和surfactin类物质,稳定性研究表明酸碱、温度和酶处理对抑菌活性没有太大影响。本研究通过硫酸铵沉淀、大孔树脂吸附及反相高效液相色谱技术,从解淀粉芽孢杆菌BA-26的发酵液中分离纯化到11类抗真菌物质,液相分析峰图显示它们不是单一物质,这与芽孢杆菌产生的抗菌物质中可能存在很多结构相似的异构体和同系物的特征相符。这些抗菌物质易溶于水和极性有机溶剂的混合物,具有一定的亲水性和亲脂性。下一步,拟通过质谱、红外光谱、核磁共振等现代波谱技术对液相色谱分离各组分活性物质进行结构鉴定。
4 结论
从解淀粉芽孢杆菌BA-26发酵液中分离纯化到11个具有抑制真菌作用的活性组分。该菌株抗真菌谱广,对立枯丝核菌等多种植物病原真菌有强抑制作用,高效液相色谱纯化活性组分中对灰葡萄孢抑菌活性最强的最小抑菌浓度为7.81 μg/mL。菌株BA-26产生的抗真菌活性物质能使灰葡萄孢菌丝生长受阻、膨大变粗、细胞膜破坏并能抑制其孢子萌发。
