奥美拉唑对小鼠精原干细胞生长与增殖分化的影响
2019-07-29张奎原孙泽坤杨薛枫孙兆林胡建新
张奎原,南 涛,张 虎,孙泽坤,杨薛枫,孙兆林,胡建新
(1.贵州医科大学 贵州 贵阳 550000;2.贵州省人民医院泌尿外科,贵州 贵阳 550000)
精原干细胞(spermatogonial stem cells,SSCs)是一种定向分化为成熟精子的干细胞[1~3]。然而,如何促进小鼠SSCs生长、增殖与分化作用尚不明确。近年来,男性精子总量及精子质量较前明显下降。男性少、弱精子症及无精症发病率明显呈增高趋势,男性不育率已占不育夫妇的20% 以上[4~6]。有相关研究表明胃酸相关症状药物治疗对活动精子总数和浓度有影响,提示抑酸药物使用与男性不育者精子质量较差相关[7],但具体作用的分子机制尚不明确。2015年12月至2019年3月本研究探讨抑酸药物对体外培养SSCs增殖与分化的影响,探讨其对男性生殖能力的不良影响。
1 材料与方法
1.1 材料5~7日龄昆明雄性小白鼠30只购置于实验动物中心(贵州医科大学);透明质酸酶、胰蛋白酶、胎牛血清、Ⅳ型胶原酶、DMEM/F-12、DMEM、双抗浓储液(1000×P/S):1×105IU/ml、青霉素钠,1×105μg/ml 硫酸链霉素、TrisHCI、kit(FITC抗体:免疫荧光)、a6-整合素(FITC抗体:疫荧光)等(sigma公司);奥美拉唑胶囊(20 mg),购自浙江金华康恩贝公司;Trizol:碧云天生物;反转录试剂盒,PCR Mix 试剂盒:Fermentas。DNA Marker DL2,000:5×DNA上样缓冲液:美国ProMab,SJ-TD20085201。TaKaRa D501 A,PCR仪,ABI公司;水平电泳槽(北京仪器公司);离心机、JY-SPC、DG-Ⅲ电泳仪、 SIGMA,1-13(北京鼎国公司);成像系统等。
1.2 方法
1.2.1小鼠SSCs体外分离、培养 ①酒精(75%)浸泡昆明小鼠15 min。②分离出小鼠双侧睾丸组织,置于培养皿中(含有PBS),PBS清洗2~3次。③充分去除睾丸外层组织,并将睾丸组织移入10 ml离心管。④加入10倍体积PBS,反复充分吹打(进一步祛除白膜),静置,待沉淀后弃上清。⑤加入胶原酶Ⅳ(10倍体积),置于37 ℃恒温箱,放置10 min。⑥加入5~10 mlPBS,轻轻吹打1~2 min,600r离心5 min,弃上清(重复2~3次)。⑦加入胰蛋白酶(5倍体积),置于37 ℃水浴锅,消化10 min,并不断吹打(充分消化)。⑧加入等体积DMEM,400目细胞筛,滤过细胞(祛除杂质)。⑨滤液16 ℃1000r 6 min,弃上清,洗涤2~3次。⑩计数5×105个/ml,接种于培养基。6~8 h后,采用差速贴壁法分离小鼠 SSCs和Sertoli。
1.2.2小鼠SSCs生长情况 共培养24、72、120、192及240 h后,用400×显微镜分别观察二组细胞生长状态、数目的变化。
1.2.3小鼠SSCs的鉴定 ①加入PBS液,浸洗2次,5 min/次。②4% PFA(多聚甲醛)固定细胞20 min,PBS液浸洗3次,5 min/次。③0.1 TWeen-20(PBST)10 min,透化细胞,PBS洗一次,5 min/次。④加入5%BSA的PBST,封闭45 min。⑤加入一抗(1∶200稀释封闭液,置于4 ℃培养箱过夜)。⑥加入二抗稀释液,细胞洗涤3次,5 min/次。⑦加入二抗(1∶200稀释于二抗稀释液中),37 ℃,60 min。⑧PBS洗3次,5 min/次。加入DAPI 3~5 min,PBS洗3次,5 min/次。⑨置于显微镜(免疫荧光)下检测。
1.2.4小鼠SSCs生长增殖检测 取实验组及对照组生长状态良好的两组细胞,调控细胞浓度为(5×104/ml),并种植于96孔板中,190 μl/孔,分别孵育24 h后,加入查尔酮类衍生物C10,并设置5个复孔,分别共培养24、72、120、192、240 h后,每孔加入20 μl MTT,孵育6~8 h后离心,弃上清液,然后加入150 μl DMSO,室温震荡15分钟,并置于490 nm光激发下用酶标仪测吸光度(OD值)。
1.2.5小鼠精原干细胞基因水平检测 运用PCR技术,检测实验组及对照组SSCs 基因水平。
1.2.6RNA提取 ①样本中加入0.8 ml Trizol,吹打使细胞充分溶解。②室温下静置5~10 min,后添加氯仿(0.2倍体积),需震动15秒,后在2~8 ℃下离心机12,000×g离心15 min。③将水样层样本转移至试管中,加入异丙醇(0.5倍体积),二者充分混匀后置于-20 ℃冰箱10~15 min,后在2~8 ℃下离心机12,000×g离心10 min。④去上层悬液,将RNA沉淀用1 ml 75%乙醇清洗,在震荡器上混匀,置于2~8 ℃离心机7,500×g,5 min,保留下层沉淀。5.待RNA沉淀适度干燥后,加入无RNase的水(使RNA溶解)。⑥室温下离心机2000 rpm离心20 sec。⑦将获得的RNA溶液,保存于-80 ℃待用。
1.2.7PCR扩增程序 获得所需样品。
1.2.8琼脂糖凝胶电泳检测 上样:须预电泳5 min(上样前),后加入上样孔。电泳:5~6 V/cm电压2~2.5 h,使溴酚兰指示剂进入凝胶(2~3 cm即可)。紫外透射光下,观察结果并拍照。
1.3 统计学方法采用SPSS 21.0软件分析数据,重复测量数据比较采用方差分析及LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组小鼠SSCs生长状态观察对照组精原干细胞 小鼠SSCs接种12~24 h后,细胞开始黏附、分裂增殖,呈体积中等、圆形、大小均一。细胞之间见未断开的间桥,边缘呈透明状。随着共培养时间的延长,精原干细胞生长、增殖逐渐明显,并在接种后第240 h形成数百个细胞的细胞团,细胞总数达高峰。实验组小鼠SSCs 实验组SSCS相对较对照组细胞贴壁慢,并且较为散乱,细胞之间未见明显相互连接。培养240 h时,可见小鼠SSCs有增殖,但细胞的数目、细胞相互连接仍不明显。如图1。
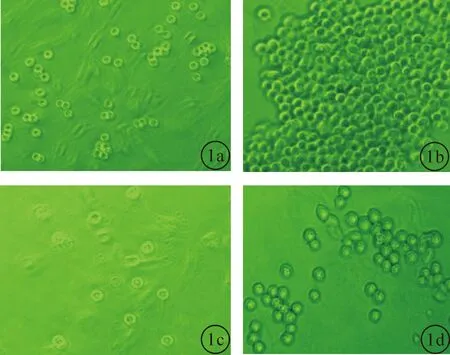
图1 各组 SSCs生长形态检测(显微镜检测,×400) a:对照组培养24 h;b:对照组培养240 h;c:实验组培养24 h;d 实验组培养240 h
2.2 实验组与对照组精原干细胞检测结果培养240 h后分别运用免疫荧光显微镜(400倍)检测实验组与对照组SSCs:两组小鼠SSCs大小、生长状态相似,但实验组小鼠SSCs总数明显低于对照组。如图2。
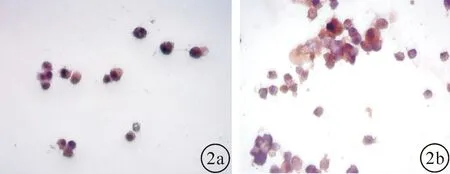
图2 各组细胞检测结果(免疫荧光检测,×400) a:实验组;b:对照组
2.3 小鼠SSCs生长、增殖检测随共培养时间的延长,对照组小鼠SSCs OD值,逐渐增高,相对实验组小鼠SSCs,OD值则增高不明显。不同时间点内,二组小鼠SSCs OD值结果性差异有统计学意义(P< 0.01)。见表1。

培养时间(h)实验组(n=30)对照组(n=30)240.122±0.031∗0.174±0.027720.165±0.016∗0.273±0.0561200.217±0.029∗0.324±0.0301920.345±0.042∗0.599±0.0472400.400±0.082∗1.052±0.097
* 与对照组比较,P< 0.01
2.4 小鼠SSCs生长、增殖基因(PCR)检测共培养240 h时,提取小鼠实验组SSCs及对照组SSCs,运用PCR技术(聚合酶链反应),分别检测两组小乳鼠SSCs DNA。可见对照组小鼠SSCsDNA量明显高于实验组小鼠SSCs,见图3。
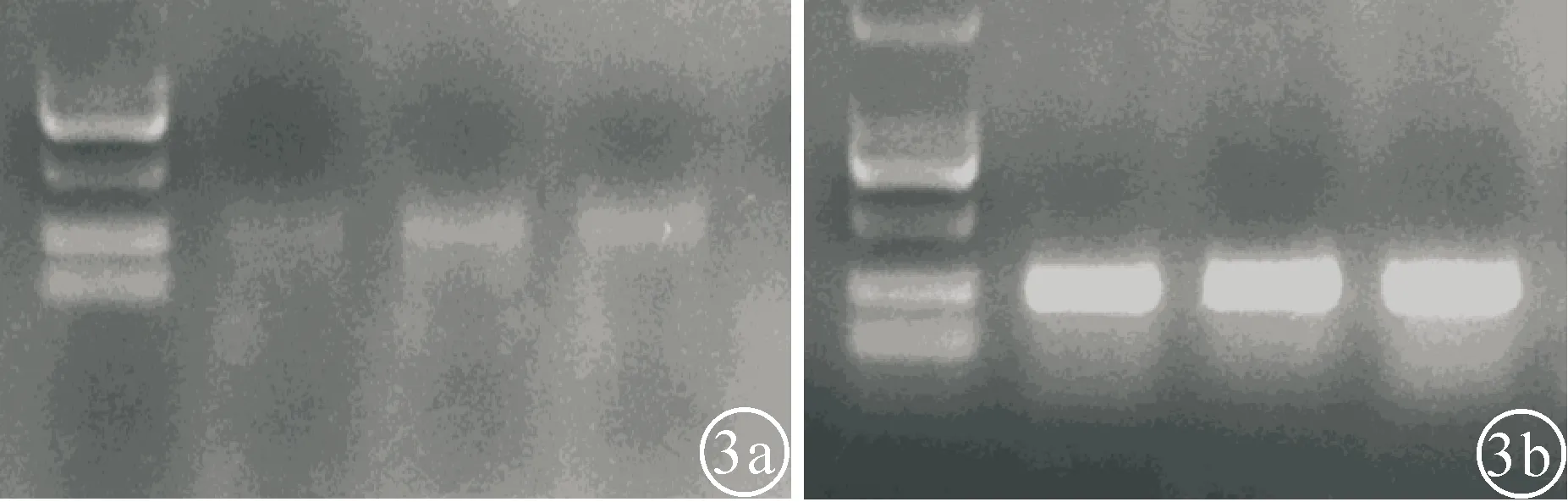
图3 实验组与对照组PCR结果(Marker自上而下为750bp、500bp、250bp、100bp)a:实验组:b:对照组
3 讨论
小鼠睾丸SSCs是定向分化为精子的起始细胞,受其周围的内环境因素影响较大。影响精子总数及质量的原因有很多种,尤其是药物对男性生育能力的不良作用,受到其的种类、剂量、药代动力学、疗程、患者年龄等诸多因素的影响[8~10]。一般来说,药物的剂量越大、药代动力学越长、疗程越长、年龄越小,对男性生育功能的损害就越严重,从而造成精子总数量及精子质量的下降[11]。本研究发现,在体外培养的精原干细胞培养液中添加质子泵抑制药奥美拉唑后,SSCs的生长变慢,增殖与分化也受到了不良影响。前期实验表明:SSCs贴壁速度较慢,为12~24 h,潜伏期为24~96 h,故选择在培养24、72、120、192、240 h分别用显微镜直视下观察两组SSCs在不同时间点SSCs生长形态及数目;结果表明,培养240 h时,实验组细胞数目明显低于对照组,故选择培养240 h时进行PCR技术检测。研究提示质子泵抑酸药对SSCs产生了不良影响,很可能造成男性不育。另有研究表明,抑酸药物对活动精子总数和浓度有影响,与男性不育者精子质量较差相关,以及与精子浓度降低相关。并假设抑酸药物降低小肠吸收维生素B的可得性,从而造成一碳物质代谢紊乱,并对精子形成造成不利影响[12]。但具体作用机制尚不清楚。Kadam等[13]研究发现,色域解旋酶/ATP酶DNA结合蛋白(Chd1)是一种新的SSCs存活和自我更新调节因子,并用高通量的小RNA测序揭示Chd1控制的microRNA(MiR)表达谱,结果表明,在SSCs中,124 miR转录本的表达受到Chd1的不同调控。KEGG通路分析表明,Chd1抑制的差异表达miRs蛋白,在干细胞多能性和增殖相关的通路呈现中明显富集的作用。并证明了上调miRs之一miR-486控制着SSCs基因的表达和生长特性。即Chd1、miR-486和MMP 2协同调控SSCs基因表达和生长特性。我们猜想抑酸药物(奥美拉唑)是通过作用于色域解旋酶/ATP酶DNA结合蛋白(Chd1l),抑制调控miR-486和MMP 2,从而抑制SSCs生长与增值分化。Chd1l-miR-486-MMP 2是调控SSCs基因表达和生长特性的一个新的调节轴。我们通过向DMEM/F12完全培养液中添加中抑酸药物药后培养SSCs,培养结果显示SSCs生长与增殖分化明显受到抑制,这可能与抑酸药物中的质子泵抑制剂抑制了SSCsChd1l-miR-486-MMP 2靶向轴有关将,也将加快人们对这一领域的深入认识,也为治疗男性不育提供一种新的治疗方法。
