口灌醋酸棉酚对鲤血清转氨酶、肝脏抗氧化酶活力及肝细胞凋亡的影响
2019-07-29张孟丹梁俊平许振山张建新聂国兴
张孟丹,梁俊平,张 静,许振山,李 慧,张建新,聂国兴
(河南师范大学 水产学院,河南 新乡 453007)
鲤(Cyprinuscarpio)是我国重要的淡水鱼养殖品种之一,2017年全国产量达300.43万t,占全国鱼类总产量的11.82%[1]。近年来,鱼粉、豆粕等蛋白质原料价格的上涨给鲤的养殖成本带来巨大压力,寻求廉价适宜的蛋白质原料已成为解决鲤养殖业可持续发展的重要途径之一[2-3]。我国棉粕资源丰富,年产量达600万t,棉粕中蛋白质含量为46%~53%,与鱼粉和豆粕中的蛋白质含量相近,是水产饲料中重要的蛋白质来源之一[4-6]。但棉粕中含有的游离棉酚等抗营养因子会影响动物对营养素的吸收,同时对动物也具有一定毒性,从而限制了棉粕的广泛使用[7-8]。
在草鱼(Ctenopharyngodonidellus)幼鱼的研究中发现,随着棉粕替代鱼粉比例的升高,草鱼的特定生长率呈下降趋势,当替代比例达到60%(含游离棉酚68.28 mg/kg)时,草鱼的特定生长率显著下降[9]。有研究表明,在基础饲料中添加1 200 mg/kg醋酸棉酚,投喂大菱鲆(ScophthalmusmaximusL.)幼鱼11周后,其特定生长率和体质量增加率显著下降[10]。蒋春琴等[11]以含醋酸棉酚300 mg/kg的饲料投喂异育银鲫(Carassiusauratusgibelio)8周后,其特定生长率、体质量增加率也显著下降。SUN等[12]用发酵棉粕替代鱼粉投喂凡纳滨对虾(Litopenaeusvannamei),4周后发现,当饲料中游离棉酚含量超过116 mg/kg时,特定生长率显著降低。用棉粕100%替代豆粕投喂尼罗罗非鱼(Oreochromisniloticus×O.aureus)幼鱼,虽然游离棉酚含量只有46.74 mg/kg,但经过8周投喂,尼罗罗非鱼的特定生长率显著低于对照组[13]。在对鲤研究中也发现,以棉粕替代鱼粉投喂幼鱼,当游离棉酚含量超过431 mg/kg时会显著降低鲤的特定生长率[14]。另有研究表明,长期投喂棉粕饲料,会影响水产动物的生长,大量游离棉酚会蓄积在水产动物的肝脏,严重影响其肝脏功能,使肝细胞出现肿胀、空泡化或萎缩现象,从而影响水产动物的健康[14-15]。
目前关于游离棉酚对水产动物毒性的研究,主要集中在通过棉粕替代豆粕、鱼粉或在基础饲料中添加醋酸棉酚的方式来评价其对动物生长、生理的影响方面。由于棉粕中除含有游离棉酚外,还有环丙烯类脂肪酸等其他抗营养因子,对水产动物的直接毒性作用可能是各种抗营养因子共同作用的结果[16];此外,游离棉酚能够与某些营养因子结合,长期投喂后,降低了水产动物对营养素的利用率,从而影响水产动物生长[9]。因此,本研究通过口灌鲤醋酸棉酚后,测定其血清转氨酶和肝脏抗氧化酶活力,并观察肝细胞凋亡情况,来评价醋酸棉酚对鲤肝脏的毒性作用,以期为棉粕的合理利用提供理论支持。
1 材料和方法
1.1 供试动物
黄河鲤购自郑州市中牟国家农业园,选取平均体质量为(60.0±2.5)g的健康鲤鱼,暂养于室内循环水养殖系统,投喂商品饲料,每日投喂3次,投喂时间分别为9:00、13:00、18:00,连续充氧,14 d后开始试验。鲤于正式试验前禁食24 h。
1.2 供试试剂
醋酸棉酚(纯度>97.5%)购自大连美仑生物科技有限公司;谷丙转氨酶(GPT)、谷草转氨酶(GOT)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒均购自南京建成生物工程研究所;RNAiso Plus、PrimeScriptTMRT Reagent Kit with gDNA Eraser、SYBR®Premix ExTaqTMⅡ试剂盒均购自宝生物工程(大连)有限公司;TUNEL细胞凋亡检测试剂盒(显色法)购自上海碧云天生物技术有限公司。
醋酸棉酚悬浊液的制备:准确称取0.12 g醋酸棉酚,溶于10 mL 0.65%生理盐水,超声波超声10 min,使醋酸棉酚充分溶解,配制成12 mg/mL的醋酸棉酚悬浊液。
1.3 供试仪器
供试仪器主要包括高速冷冻离心机(Eppendorf Centrifuge 5804R)、电子天平(Scout SE-SE602f)、酶标仪(Thermo multiskan spectrum)、超微量分光光度计(Nanodrop 2000)、酶标仪(Thermo)、实时荧光定量PCR仪(Roche LightCycler®96)等。
1.4 试验方法
1.4.1 试验分组与取样 醋酸棉酚处理组的鲤分别口灌0.1 mL的醋酸棉酚悬浊液(即按照鲤体质量口灌醋酸棉酚剂量为20 mg/kg),对照组的鲤口灌0.1 mL生理盐水,分别于口灌后的0.5、1、2、4、6、12、24、48、72 h对鲤进行尾静脉取血,并解剖取肝脏,每个时间点取7尾鱼。将采集到的血液于4 ℃静置12 h后,3 000 r/min、4 ℃离心15 min,收集上层血清,于-80 ℃保存,用于GOT和GPT活力测定。一部分鲤肝脏组织立即保存于4%多聚甲醛,用于组织切片制作和TUNEL分析;另一部分肝脏组织经液氮研磨后置于无RNA酶EP管中,于-80 ℃保存,用于SOD和GSH-Px活力测定和凋亡基因表达量的检测。
1.4.2 鲤血清转氨酶和肝脏抗氧化酶活力测定 血清转氨酶活力测定:将鲤血清从-80 ℃超低温冰箱取出,解冻后按照试剂盒说明书操作,使用酶标仪测定OD值,计算血清转氨酶GOT和GPT活力。
肝脏抗氧化酶活力测定:准确称0.05 g鲤肝脏组织于1.5 mL无菌EP管中,按质量(g)∶体积(mL)=1∶9加入0.45 mL 0.65%生理盐水,4 ℃、2 500 r/min离心10 min,取上清液按照试剂盒说明书操作,使用酶标仪测定OD值,计算肝脏抗氧化酶SOD和GSH-Px活力。
1.4.3 鲤肝脏组织总RNA提取及cDNA合成 称取0.05~0.10 g鲤肝脏组织并加入1 mL RNAiso Plus,参照试剂盒说明书方法提取肝脏总RNA。用超微量分光光度计测定提取的总RNA在260 nm和280 nm处的OD值,检测提取的总RNA浓度和纯度,并进行1%琼脂糖凝胶电泳以检测提取的总RNA的完整性,然后进行cDNA合成。
1.4.4 鲤肝脏组织凋亡相关基因检测 用超微量分光光度计测定合成的cDNA在260 nm和280 nm处的OD值,检测合成的cDNA浓度,参照SYBR®Premix ExTaqTMⅡ试剂盒方法处理后,进行qRT-PCR扩增,以18SribosomalRNA基因作为内参基因,采用2-ΔΔCt方法计算caspase3、caspase6、caspase7基因的相对表达量。引物序列如表1所示,由生工生物工程(上海)股份有限公司合成。

表1 qRT-PCR扩增的特异性引物
1.4.5 鲤肝脏组织切片制作和TUNEL分析 参照《临床病理学技术》[17]中的操作规范,对鲤肝脏组织样品进行石蜡包埋、切片后,一部分进行苏木精-伊红(HE)染色,并于显微镜下阅片观察鲤肝组织的形态变化;另一部分依据TUNEL细胞凋亡检测试剂盒说明书进行染色,观察鲤肝细胞凋亡情况。
1.5 数据处理
所得数据均以平均值±标准差表示,用SPSS 20.0进行Duncan’s单因素方差分析,P<0.05表示差异显著。
2 结果与分析
2.1 醋酸棉酚对鲤血清GOT、GPT活力的影响
对鲤单次口灌醋酸棉酚后,其血清中GOT活力在口灌醋酸棉酚后0.5 h时显著高于对照组(P<0.05),口灌后48 h和72 h时鲤血清中GOT活力显著低于对照组(P<0.05),其他时间点鲤血清中GOT活力与对照组相比无显著性差异(P>0.05)(图1)。鲤血清中GPT活力在口灌醋酸棉酚后0.5 h和1 h时显著高于对照组(P<0.05),口灌醋酸棉酚后2 h和12 h时鲤血清中GPT活力高于对照组,但无显著性差异(P>0.05),其他时间点鲤血清中GPT活力均低于对照组,4 h和48 h时与对照组差异显著(P<0.05)(图2)。
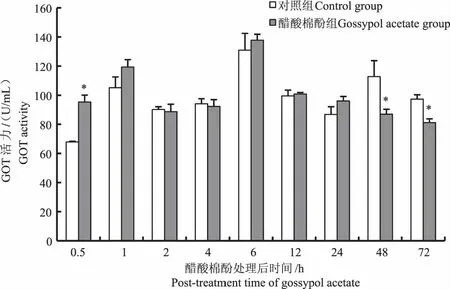
*表示不同处理组之间差异显著(P<0.05),下同
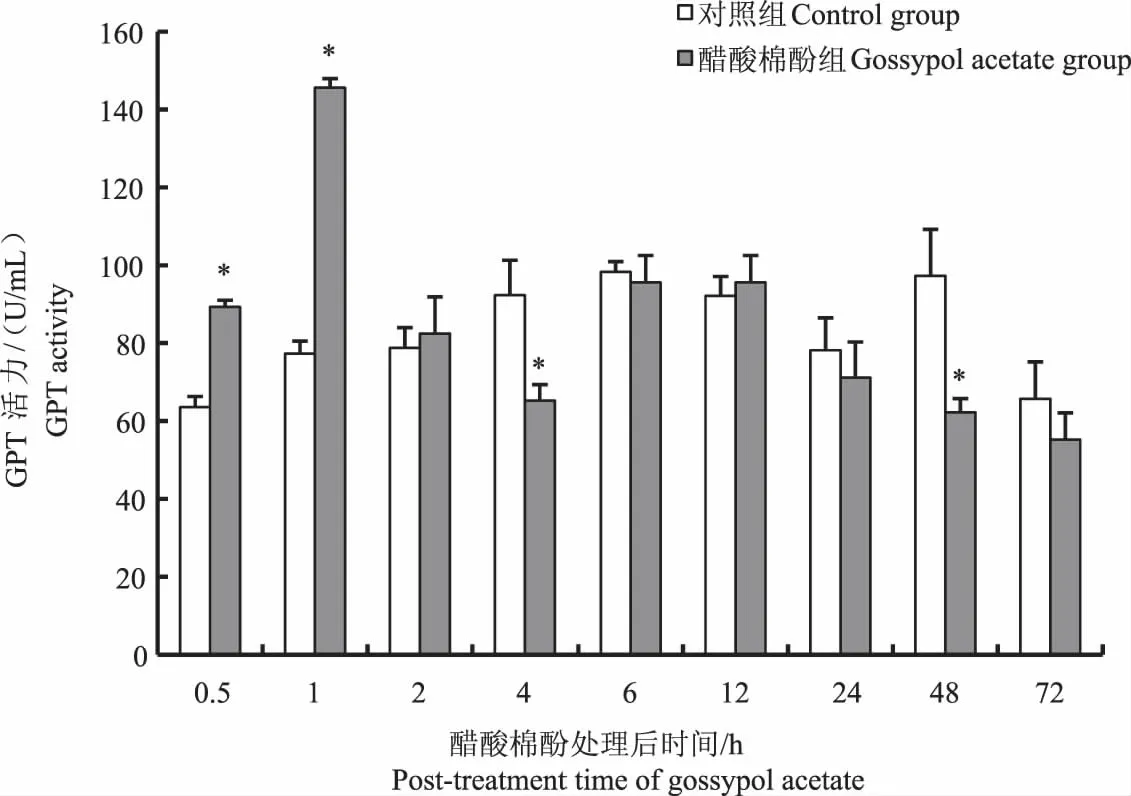
图2 醋酸棉酚对鲤血清GPT活力的影响Fig.2 Effect of gossypol acetate on GPT activity in serum of Cyprinus carpio
2.2 醋酸棉酚对鲤肝脏SOD、GSH-Px活力的影响
对鲤单次口灌醋酸棉酚后,其肝脏SOD活力在口灌后0.5、1、2、48 h时均显著高于对照组(P<0.05),在口灌后4 h和12 h时鲤肝脏SOD活力显著低于对照组(P<0.05),口灌后6、24、72 h时鲤肝脏组织SOD活力与对照组相比无显著性差异(P>0.05)(图3)。鲤肝脏的GSH-Px活力除口灌后4 h与对照组差异不显著(P>0.05)以及6、12 h时显著低于对照组(P<0.05)外,其他时间点均显著高于对照组(P<0.05)(图4)。
2.3 醋酸棉酚对鲤肝细胞形态和凋亡的影响
如图5所示,对鲤单次口灌醋酸棉酚后24 h时,与对照组相比,其肝细胞边界清晰,肝细胞大小无明显变化,细胞核大小无明显变化。如图6B所示,箭头所指的凋亡肝脏细胞被染为棕色。但对鲤单次口灌醋酸棉酚后24 h时,其肝细胞中未发现被深染的细胞核,与TUNEL阴性对照、对照组现象一致(图6A、6C和6D)。
2.4 醋酸棉酚对鲤caspase3、caspase6和caspase7基因表达的影响
如图7所示,对鲤单次口灌醋酸棉酚后24 h时,其肝脏caspase3、caspase6和caspase7基因的相对表达量均显著低于对照组(P<0.05)。
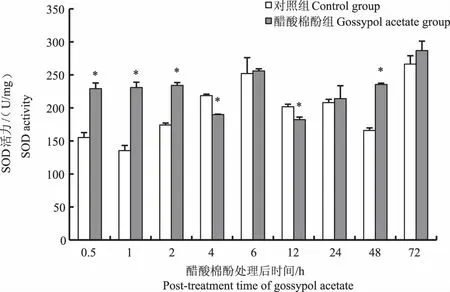
图3 醋酸棉酚对鲤肝脏SOD活力的影响Fig.3 Effect of gossypol acetate on the activity of SOD in liver of Cyprinus carpio
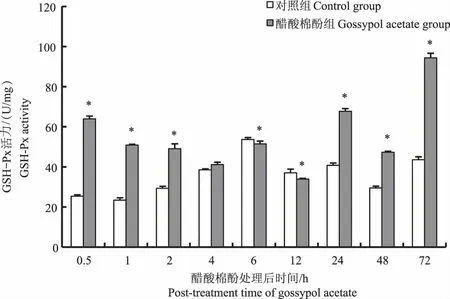
图4 醋酸棉酚对鲤肝脏GSH-Px活力的影响Fig.4 Effect of gossypol acetate on the activity of GSH-Px in liver of Cyprinus carpio
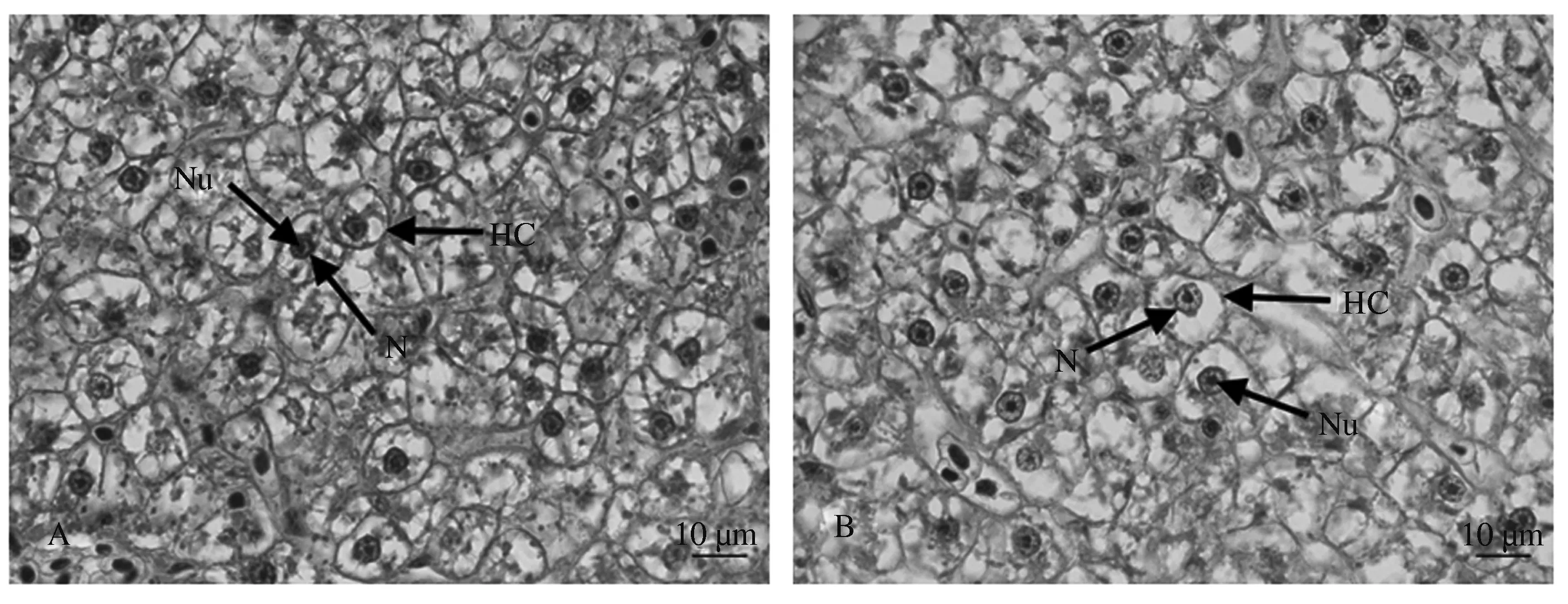
A:对照组;B:醋酸棉酚组。HC:肝细胞;N:细胞核;Nu:核仁
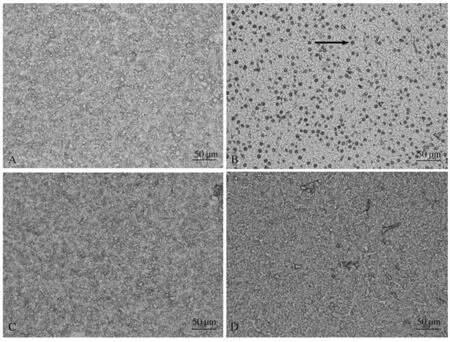
A:TUNEL阴性对照;B:TUNEL阳性对照;C:对照组;D:醋酸棉酚组。箭头标识的为3′-OH末端缺口,代表DNA断裂,细胞凋亡
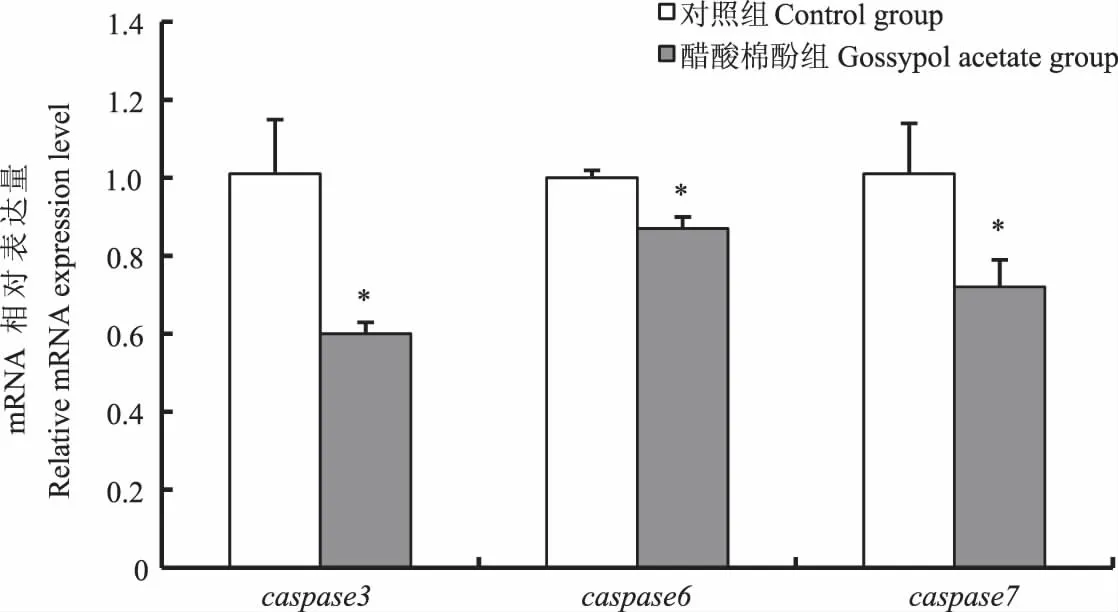
图7 醋酸棉酚对鲤肝脏凋亡基因表达的影响Fig.7 Effect of gossypol acetate on the expression of apoptosis gene in liver of Cyprinus carpio
3 结论与讨论
3.1 醋酸棉酚对鲤血清GPT和GOT活力的影响
GPT和GOT是判定肝功能的重要指标之一,其主要存在于肝脏细胞中。正常情况下,血液中GPT和GOT含量较低,当肝脏细胞发生炎症或者损伤时,会释放大量的GPT和GOT进入血液,使血液转氨酶浓度升高[18-19]。
CAI等[20]研究发现,当饲料中添加56%棉粕(游离棉酚含量为473 mg/kg)或饲料中添加642 mg/kg的醋酸棉酚投喂异育银鲫幼鱼24周后,其血清GOT和GPT活力与对照组相比无显著差异;蒋春琴等[11]研究表明,在饲料中添加300 mg/kg醋酸棉酚投喂异育银鲫幼鱼8周后,其血清GOT和GPT活力与对照组相比无显著性差异,但添加900 mg/kg醋酸棉酚时,异育银鲫幼鱼血清GOT和GPT活力显著高于对照组。在草鱼的研究中发现,当使用棉粕全部替代鱼粉(游离棉酚含量为82.3 mg/kg)的饲料投喂草鱼幼鱼6周后,其血清GPT活力显著高于对照组[21];在饲料中添加114 mg/kg的游离棉酚投喂草鱼成鱼8周后,其血清GOT和GPT活力与对照组相比无显著差异[9]。对凡纳滨对虾的研究发现,当在饲料中添加160.9 mg/kg游离棉酚投喂4周后,凡纳滨对虾血清GOT和GPT活力与对照组相比无明显差异[12]。对鲤的研究发现,当饲料中棉粕含量超过36%(游离棉酚含量为431 mg/kg),对鲤幼鱼投喂8周后,其血清GPT和GOT的活力显著高于对照组[14-15]。由此可见,游离棉酚对水产动物肝脏毒性作用与动物种类、个体大小、投喂剂量及投喂时间有很大关系。但上述研究主要是将棉粕作为蛋白质原料或在饲料中直接添加游离棉酚来研究游离棉酚对水产动物肝脏的毒性作用,结果容易受到棉粕中其他抗营养因子或饲料中其他成分影响。本研究通过单次口灌的方式来研究游离棉酚对鲤肝脏的毒性作用,避免了其他因素的影响,结果显示,对鲤单次口灌醋酸棉酚后,其血清中GOT活力在口灌醋酸棉酚后0.5 h时显著高于对照组,GPT活力在口灌醋酸棉酚后0.5 h和1 h时显著高于对照组。结果表明,游离棉酚在短时间内对鲤的肝功能具有一定影响,但这种影响随着时间推移逐渐减弱,并未造成鲤的肝脏病理性损伤。
3.2 醋酸棉酚对鲤肝脏抗氧化酶活力的影响
本研究结果显示,对鲤单次口灌醋酸棉酚后,其肝脏组织SOD活力在口灌后0.5、1、2、48 h时均显著高于对照组,GSH-Px活力在口灌后0.5、1、2、24、48、72 h时均显著高于对照组。表明在游离醋酸棉酚存在的条件下,水产动物血清GPT和GOT活动只在短时间内显著升高,与上述研究结果一致。这可能是由于SOD和GSH-Px在清除游离棉酚产生自由基的过程中发挥了关键作用,而肝脏在24 h内可完成自我修复、发挥正常功能。由此可见,不同剂量的游离棉酚对动物机体抗氧化酶活力影响不同。游离棉酚本身作为一种抗氧化剂,在低剂量时并不引起动物机体抗氧化酶活力的增加,而在高剂量时游离棉酚会产生大量自由基,促使抗氧化酶活力增加从而达到解毒作用,但当其超过一定剂量范围时,可能会破坏抗氧化酶系统,使动物肝脏失去自我解毒功能,从而导致肝脏病变。
3.3 醋酸棉酚对鲤肝细胞形态的影响
CAI等[20]研究表明,在饲料中添加642 mg/kg的游离棉酚,连续饲喂异育银鲫24周后,其肝细胞结构未发生明显变化;蒋春琴[26]研究却发现,在饲料中添加900 mg/kg的醋酸棉酚投喂异育银鲫8周后,其肝细胞核体积增大,细胞间界限变模糊。侯红利[15]研究表明,当用含有30.98%棉粕的饲料投喂鲤8周后,鲤肝细胞出现肿胀、空泡化现象;而WANG等[14]研究表明,当鲤饲料中游离棉酚添加量达54%时,连续投喂8周后,鲤肝细胞出现皱缩现象。本研究结果表明,对鲤单次口灌20 mg/kg醋酸棉酚后24 h时,鲤肝细胞排列整齐、界限清晰,细胞核清晰可见,并未引起肝脏组织病变。由此可见,鲤肝脏组织的病变是一个渐进过程,且与投喂醋酸棉酚的剂量和投喂时间有关。
3.4 醋酸棉酚对鲤肝细胞凋亡的影响
游离棉酚可抑制人肝癌等癌细胞的增殖,并诱导其凋亡。研究表明,使用不同剂量的游离棉酚处理卵巢癌细胞24 h后,随着游离棉酚剂量的升高,卵巢癌细胞的凋亡率最高增加了70%[27-28];使用不同剂量的游离棉酚处理直肠癌细胞24 h后,细胞凋亡比例最高为46%,同时上调了caspase3基因的表达[29]。细胞凋亡过程主要由caspase家族所介导,活化后的caspase激活了下游凋亡因子,最终引起DNA的降解。其中caspase3、caspase6和caspase7是执行细胞凋亡阶段的主要效应分子,可直接导致细胞核裂解,从而诱发细胞凋亡。本研究结果显示,对鲤单次口灌醋酸棉酚24 h时,未导致鲤肝细胞的DNA损伤和凋亡,并且caspase3、caspase6、caspase7基因表达量与对照组相比显著降低,这可能是由于游离棉酚进入鲤体内后,经过鲤自身的代谢和排泄作用,缓解了肝脏的毒性作用,从而未引起肝细胞凋亡;但在相关体外试验中,受试细胞始终处于棉酚溶液中,缺少机体的代谢功能,从而诱发了细胞凋亡;也可能是由于癌细胞与正常细胞的增殖机制存在差异所致,但具体原因有待进一步研究。
本研究表明,以20 mg/kg的剂量单次口灌鲤醋酸棉酚后,在短时间内引起了鲤肝脏的生理性变化,后期鲤通过增强其肝脏抗氧化酶活力来增强对醋酸棉酚的解毒作用,最终并未引起鲤肝脏的病理性损伤以及肝细胞的凋亡。
