保育猪舍中猪源、粪源、气源大肠杆菌的分离鉴定及16S rDNA同源性分析
2019-07-29郭慧慧陈剑波武守艳程晓亮韩文儒韩一超
郭慧慧,陈剑波,武守艳,程晓亮,韩文儒,韩一超
(山西省农业科学院 畜牧兽医研究所,山西 太原 030032)
保育猪又称为断奶仔猪,是指28日龄左右断奶后在保育猪舍中饲养到60~75日龄的仔猪[1]。大肠埃希氏杆菌(Escherichiacoli,E.coli)又称为大肠杆菌,属于埃希氏菌属,革兰氏阴性菌,广泛存在于动物机体、空气、水、粪便等中,其中致病性大肠杆菌可以引起断奶仔猪腹泻和断奶仔猪水肿病,从而造成仔猪生长发育不良甚至大规模死亡,给养猪业带来巨大的经济损失[2]。断奶仔猪腹泻常引起仔猪下痢、脱水;断奶仔猪水肿病引起仔猪(如头、肠胃系膜等部位)水肿和神经症状(如共济失调、震颤、后肢瘫痪等);2种疾病在同一猪群可单独发生也可同时发生,会造成仔猪死亡率升高[3-5]。目前,养殖场断奶仔猪死亡很大比例是由感染致病性大肠杆菌所致,这是造成养殖户经济损失的主要原因之一,同时随着临床抗生素药物的使用,致病性大肠杆菌的耐药性越来越强,对于该病的防治也越来越严峻[6]。因此,本研究通过对常规养殖状态下保育猪舍中猪源、粪源、气源大肠杆菌进行分离纯化以及大肠杆菌16SrDNA基因全长测序和同源性比较,寻找致病性大肠杆菌的来源,从而了解大肠杆菌在保育猪舍的流行情况,为有效切断大肠杆菌病的传播途径提供科学依据。
1 材料和方法
1.1 试验时间及地点
于山西省介休市某规模化猪养殖场中,对单栋饲养量为500头并有大肠杆菌病发生的半封闭保育猪舍1栋进行为期21 d的检测。
1.2 试验猪舍及饲养管理
试验猪舍类型为半封闭式,东西走向,南北纵墙有通风小窗30个,小窗距离地面1.5 m,小窗面积为0.53 m×0.28 m。采用通风系统,湿帘位于猪舍净道端山墙。风机位于污道端山墙上,分2层排列,每台风机功率相同,在试验阶段每栋猪舍仅开启下排中间的1台风机,并采用时间与温度双重控制通风系统(每栋猪舍通风窗的开启位置相同,但略有偏差)。试验猪舍中间为1.0 m宽过道,两侧各13个猪栏(3.5 m×3.0 m)对称分布,均采用乳头式自动饮水、自动喂料,地沟式排粪(图1)。仔猪从28日龄入舍到70日龄转舍,饮水、喂料、光照、免疫等均执行统一规定的程序。
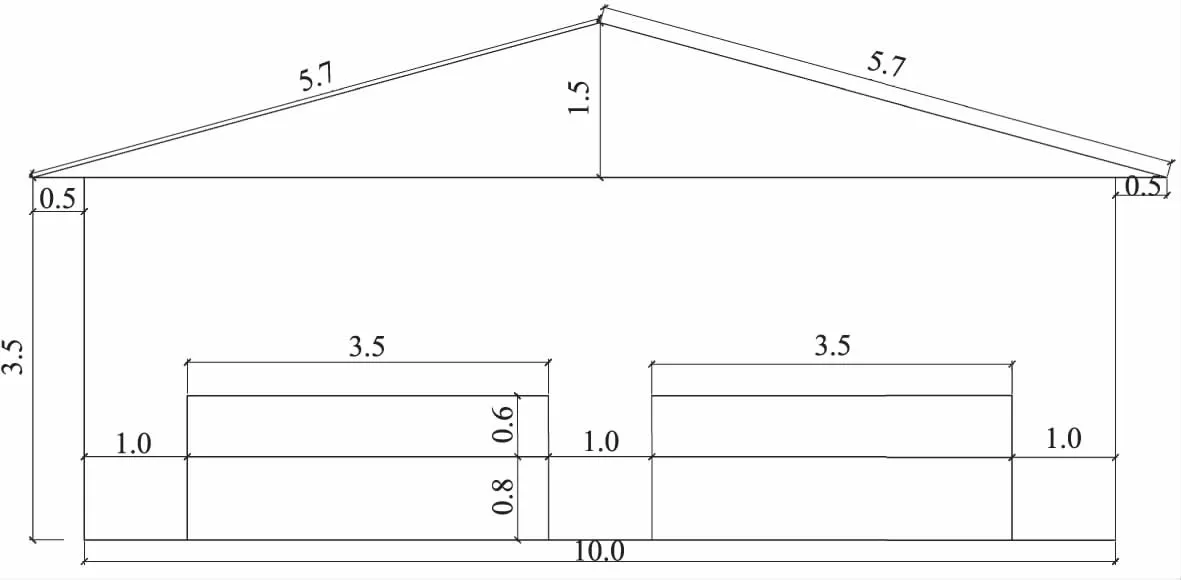
图1 保育猪舍结构平视剖面图(单位:m) Fig.1 Horizontal profile of the structure in weaning pig house (Unit: m)
1.3 主要试剂与仪器
营养琼脂、麦康凯琼脂均购自郑州安图生物工程股份有限公司;营养肉汤购自北京奥博星生物技术有限公司;EXTaq酶、dNTP均购自宝生物工程(大连)有限公司;SYBR Green购自北京索莱宝生物科技有限公司;引物由上海英骏生物技术有限公司合成。
Andersen-6级空气微生物采样器(型号为JWL-S6)购自北京先能技术开发有限责任公司;振荡培养箱(型号为HZQ-F100)、空气浴振荡器(型号为HZQ-C)均购自哈尔滨市东联电子技术开发有限公司;离心机(型号为2-16PK)购自Sigma公司;PCR仪(型号为PT-200)购自BIO-RAD公司;电泳仪(型号为DYY-6C)购自北京市六一仪器厂。
1.4 样品采集
1.4.1 保育猪舍内空气样品采集 设保育猪舍近湿帘端为始端第1组,分为南1和北1往风机端依次自然数编号至最后一栏为南13和北13,选取南1、北1、南13、北13 四个猪栏中心以及整个猪舍中心位置(A、C、D、E、G)为5个采样点[7](图2)。选取天气晴好的上午(11:00)用Andersen-6级微生物采样器(内置6个麦康凯培养皿)在每个采样点的猪背高处(距离地面1.0 m)进行空气采样。
1.4.2 保育猪舍内粪便样品采集 选取南1、北1、南7、北7、南13、北13共6个猪栏,在每个猪栏的排粪区中心位置附近,选取6个采样点(A、B、C、E、F、G)(图2),选择新鲜、无尿液等杂质的粪便,拨开表层,无菌采集内部粪便1 g左右,装入无菌管,用冰盒带回并于24 h内进行处理。
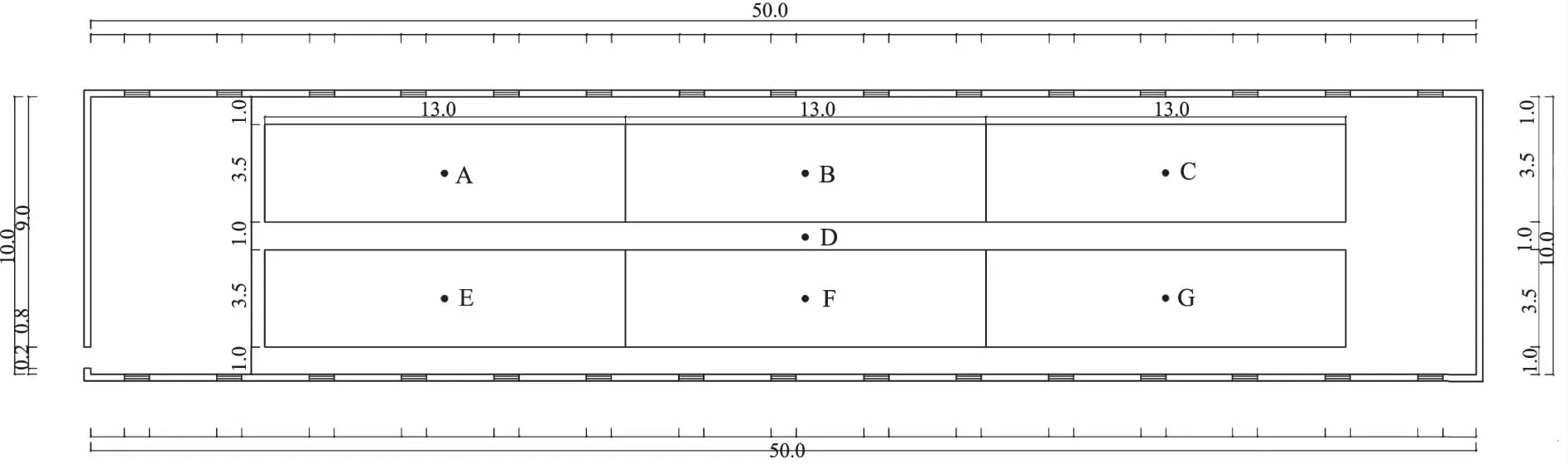
A—G:采样点 A—G: Sampling point图2 保育猪舍结构与布点俯视剖面图(单位:m) Fig.2 Overhead profile of the structure and stationing in weaning pig house (Unit: m)
1.4.3 猪鼻黏液样品采集 选取南1、北1、南7、北7、南13、北13共6个猪栏,每个猪栏随机选取1头仔猪,用洁净的医用棉拭子,伸进猪鼻腔内沾取鼻腔分泌物,然后将棉拭子迅速装入无菌管,用冰盒带回并于24 h内进行处理。
1.4.4 病猪肺部组织样品采集 选取该舍新发病(死)仔猪2头,屠宰后采集肺部组织样品。
1.5 试验方法
1.5.1 样品处理 猪的鼻腔黏液样品:于无菌管中加1 mL生理盐水,振荡混匀,取100 μL液体,分别涂板营养琼脂和麦康凯培养基。
猪的粪便样品:取样品0.1 g左右,加200 μL生理盐水稀释,吹打混匀后分别涂板营养琼脂和麦康凯培养基。
病猪的肺组织样品:剪开外部肺组织,从中间无菌取0.1 g左右的肺组织,剪碎后加200 μL生理盐水冲洗,吸取冲洗液分别涂板营养琼脂和麦康凯培养基。
1.5.2 大肠杆菌的分离与纯化 将加样品处理后的培养基置于37 ℃培养箱培养24 h,用枪头挑取麦康凯培养基上的单菌落,划线接种于麦康凯培养基,37 ℃培养箱培养24 h,得到纯化的大肠杆菌个体。挑单菌落至1 mL营养肉汤中,37 ℃、18 r/min摇菌3~4 h。
1.5.316SrDNA基因的PCR扩增及序列测定 使用细菌的16SrDNA基因通用引物27F和1492R,扩增分离出的大肠杆菌16SrDNA基因全长,将得到的菌液进行PCR鉴定,预期扩增片段长度为1 500 bp左右,引物序列:上游引物5′-AGAGTTTGATCMTGGCTCAG-3′和下游引物5′-TACGGYTACCTTGTTACGACTT-3′。
PCR反应体系为50.0 μL:10×ExTaqBuffer 5.0 μL,2.5 mmol/L dNTP Mix 4.0 μL,上、下游引物各1.0 μL,模板2.0 μL,ExTaq酶0.5 μL,ddH2O补齐至50.0 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,54 ℃复性30 s,72 ℃延伸90 s,28个循环;72 ℃延伸10 min。采用1%琼脂糖凝胶100 V 电泳40 min,检测扩增产物。电泳完毕后于凝胶成像系统中拍照。将阳性PCR产物送至北京美吉桑格生物医药科技有限公司进行测序。
1.6 数据统计分析
采用DNAStar软件对分离的大肠杆菌进行16SrDNA基因同源性分析及系统进化树构建。
2 结果与分析
2.1 疑似大肠杆菌的分离与培养
总共分离得到21株疑似大肠杆菌,包括舍内空气中12株、猪的粪便中3株、猪的鼻腔黏液中3株、发病猪的肺部组织中3株。在麦康凯琼脂平板上培养后的细菌菌落生长基本一致,菌落大小均为2~4 mm,单个菌落呈红色、圆形、扁平、湿润、光滑且边缘整齐,可初步判定所分离得到的细菌为大肠杆菌。
2.2 大肠杆菌16S rDNA基因的PCR扩增
由图3可知,分离出的21株大肠杆菌扩增出了1 500 bp左右的片段,与预期相符。
2.3 大肠杆菌16S rDNA基因核苷酸序列系统进化树构建及同源性分析
将分离的大肠杆菌16SrDNA基因PCR扩增产物测序的结果用DNAStar软件进行核苷酸序列系统进化树构建和同源性分析。由图4和图5可知,猪舍内空气环境(Aerosol-1、Aerosol-2、Aerosol-3)中的大肠杆菌与鼻腔黏液(Nasal-mucus)、病猪肺部组织(Lung)和粪便(Feces)中的大肠杆菌相似度分别为94.9%~96.3%、98.3%~99.1%、98.0%~99.2%。其中,猪粪便及病猪肺部组织中分离出的多株大肠杆菌同源性均大于99.0%,且在系统进化树上属于同一大分支由此可见它们属于同种细菌,且亲缘关系较近。

M:DL2000 DNA Marker;1—21:分离出的大肠杆菌16S rDNA全长M:DL2000 DNA Marker;1—21: 16S rDNA of Escherichia coli图3 分离的大肠杆菌16S rDNA的PCR扩增Fig.3 PCR amplification of 16S rDNA from isolated Escherichia coli

图4 分离的大肠杆菌16S rDNA核苷酸序列同源性比对 Fig.4 Homology alignment of 16S rDNA nucleotide sequence of isolated Escherichia coli
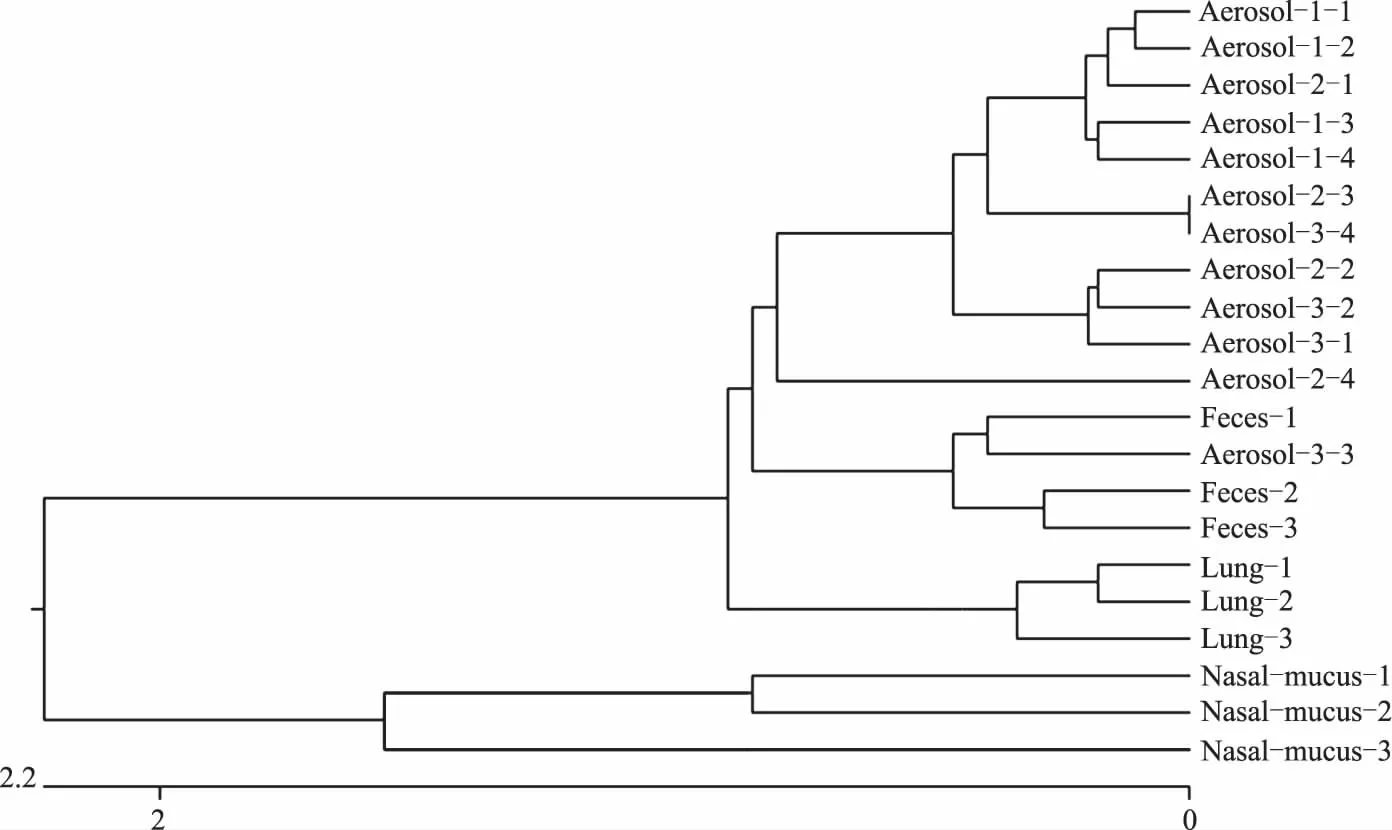
图5 分离的大肠杆菌16S rDNA核苷酸序列系统进化树Fig.5 Phylogenetic tree of 16S rDNA nucleotide sequence of isolated Escherichia coli
3 结论与讨论
本研究中,从保育猪舍内空气环境、猪粪便、猪鼻腔黏液和病猪肺部组织4种不同来源样品分离到21株疑似大肠杆菌,培养鉴定和16SrDNA基因全长测定表明,21株细菌均为大肠杆菌。计徐等[8]从保育猪舍中55日龄仔猪粪便中分离到了108株大肠杆菌。唐树霄[9]在江苏省于2011—2013年从临诊上疑似断奶仔猪腹泻或水肿病病猪的直肠棉拭以及病死猪的十二指肠共分离鉴定出228株大肠杆菌。
大肠杆菌是自然界普遍存在的一类细菌,除了存在于肠道正常菌群中的大肠杆菌对动物有益外,其他各种血清型大肠杆菌均可诱导各种动物感染发病[10-13]。仔猪断奶后从分娩哺乳舍转入保育舍,养殖环境发生改变,同时由母乳变为采食颗粒饲料,环境和采食的改变均导致仔猪的易感性增强。如果猪舍环境恶劣,卫生条件差,猪体的抗病力下降,猪只就会感染大肠杆菌,并发或继发大肠杆菌病,严重影响集约化养猪业的经济效益[14-16]。本研究中,病(死)仔猪肺部组织和粪便中的大肠杆菌与舍内空气中大肠杆菌同源性达到了98.0%以上,猪鼻腔黏液样品中大肠杆菌与舍内空气中大肠杆菌的同源性达到了94.9%以上。由系统进化树可知,舍内空气中的大肠杆菌和猪粪便中的大肠杆菌相似度最高,因此判定,粪源大肠杆菌是猪舍空气环境中大肠杆菌的主要来源,推测原因可能是粪便不能被及时清理干净,随着动物运动和空气流动等将粪源大肠杆菌带入到空气环境,造成猪舍内空气环境污染,继而引起猪只患病。
据报道,当2株大肠杆菌16SrDNA基因的同源性达到99%以上时,可推断2株菌为同种细菌;当其16SrDNA基因的同源性为95%~99%时,可推断2株大肠杆菌为同属不同种;当其16SrDNA基因的同源性小于95%时,2株大肠杆菌不同属[17-19]。本研究中,分离的21株细菌之间同源性均大于94.9%,说明它们为同属细菌,其中从病(死)仔猪肺部组织中分离出的大肠杆菌16SrDNA基因的同源性大于99.0%,病猪粪便中分离出的大肠杆菌同源性大于99.0%,说明它们之间为同种细菌且亲缘关系较近。保育猪舍内空气中的大肠杆菌与鼻腔黏液、粪便、病猪肺部组织中的大肠杆菌16SrDNA有很高的相似度。由此可见,猪舍内空气环境优劣对猪只健康起着极为重要的作用。
本研究探明了粪源大肠杆菌为半封闭保育猪舍中致病性大肠杆菌的主要来源,是猪舍主要的潜在病原菌,为猪舍制定防疫机制提供了依据,对预防断奶仔猪大肠杆菌病的发生具有重要的意义。
