流动注射-化学发光法测定猪饲料中的吡喹酮
2019-07-27陈复彬李青轻杨春艳
罗 琼,陈复彬,李青轻,黎 东,杨春艳*
(1.西华师范大学 化学化工学院 化学合成与污染控制四川省重点实验室,四川 南充 637002;2.南充市食品药品检验所,四川 南充 637000)
吡喹酮(Praziquantel)是一种合成的异喹啉—吡嗪衍生物,世界卫生组织(WHO)将其归纳为一种基本药物[1],在治疗由血吸虫病引发的发育迟缓、消瘦、缺乏体能、认知障碍及不孕等疾病中发挥着重要作用[2];与此同时,它还是治疗家畜中由各种吸虫和绦虫引发感染的重要药物[3]。然而,在实际应用中,吡喹酮却因其高效和廉价的特点而被过度滥用,产生了严重的药物残留,残留量甚至超过了“日本肯定列表制度”中对其规定的 20 μg/kg 的范围[4],给人们的健康带来了很大危害(如:萎靡不振、头痛、恶心、腹痛、产生耐药性等症状)[5]。尽管中国尚未对吡喹酮残留量做出明确的规定,但作为一个贸易大国,对吡喹酮残留量的检测是不可或缺的。目前检测吡喹酮的方法主要有:液相色谱-串联质谱法(LC-MS/MS)[6-9]、气相色谱法(GC)[10]、中红外光谱法[11]、反相高效液相色谱-紫外法(RP-HPLC-UV)[12]等。尽管这些方法对吡喹酮的检测有一定优势,但往往需要昂贵的仪器,且检测时间长、操作复杂,因此寻找一种仪器便宜,并能简单、快速检测吡喹酮的方法至关重要。而流动注射-化学发光法(FI-CL)可满足以上优点,此外其还有很高的检测灵敏度,在医药[13-15]、环境[16-17]、食品[18-19]等各个领域均具有广泛的应用。
本研究发现,Luminol与NaIO4能产生化学发光,而吡喹酮可使其化学发光强度显著降低,且发光强度与吡喹酮浓度在一定范围内呈线性关系,基于此建立了测定吡喹酮的新方法,并成功运用于猪饲料中吡喹酮含量的测定,结果令人满意。
1 实验部分
1.1 仪器与试剂
RFL-1型超微弱化学发光/生物发光检测仪(西安瑞迈分析仪器有限公司),UV-2550型紫外可见分光光度计(日本岛津公司),Cary Eclipse荧光分光光度计(安捷伦公司)。
Luminol储备液(1.0×10-2mol/L):称取0.177 2 g Luminol,用0.1 mol/L NaOH溶液溶解后转入100 mL棕色容量瓶中,用水定容,避光保存,使用前至少放置24 h,使用时逐级稀释;吡喹酮储备液(1.0×10-3mol/L):称取0.015 6 g吡喹酮用水溶解并定容后,避光保存,使用时逐级稀释;1.0×10-2mol/L的NaIO4储备液;实验所用试剂均为分析纯;实验用水均为超纯水。
1.2 实验方法
FI-CL流路如图1所示:蠕动泵P1分别输送Luminol与NaOH溶液,当流动体系平稳,化学发光信号稳定时,获得基线信号Io。吡喹酮和NaIO4溶液以及载流H2O通过蠕动泵P2输送,且吡喹酮溶液及载流H2O通过六通阀V进样,反应产生的抑制信号为Is。分别记录发光体系的基线信号(Io)和抑制信号(Is),峰高值ΔI=Io-Is。
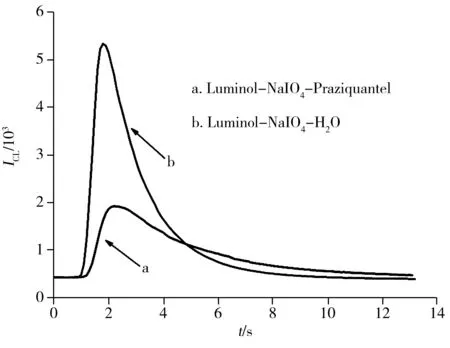
图2 鲁米诺化学反应的化学发光动力学曲线Fig.2 Chemiluminescence kinetic curve of luminol chemical reactionc(Luminol)=4.0×10-4 mol/L;c(NaIO4)=3.0×10-4 mol/L;c(NaOH)=8.0×10-3 mol/L;c(Praziquantel)=2.0×10-7 mol/L
2 结果与讨论
2.1 化学发光动力学曲线及机理的探究
吡喹酮对Luminol-NaIO4发光体系的发光信号具有很强的抑制作用,其化学发光动力学曲线如图2。由图可以看出,未加入吡喹酮时,反应产生较强的化学发光。该化学发光反应的速度很快,化学发光信号在反应开始后1.9 s达到峰值,发光强度为5 329;当加入吡喹酮后,发光强度被抑制,化学发光信号反应开始后2.3 s达到峰值,发光强度为1 908。因此,无论吡喹酮是否加入Luminol-NaIO4化学发光体系中,从化学反应开始至达到峰值的时间均很短,这表明该体系是一种快速发光反应,适合于用FI-CL方法检测吡喹酮。
为了考察Luminol-NaIO4-Praziquantel可能的反应机理,进行了如下实验:将荧光分光光度计的光源关掉,借助流动注射技术分别扫描了Luminol-NaIO4以及含有吡喹酮的Luminol-NaIO4混合溶液的化学发光光谱(图3)。结果表明:Luminol-NaIO4-Praziquantel与Luminol-NaIO4的最大发射波长均在425 nm左右,与文献报道的Luminol氧化产物—3-氨基邻苯二甲酸根离子(3-APA*)的最大发射波长类似[20],这表明无论吡喹酮是否参与反应,该体系的发光体始终为激发态的3-APA*。
为进一步探讨吡喹酮对Luminol-NaIO4体系抑制作用的反应机理,本研究采用紫外-可见分光光度计分别测定了溶液不同混合方式的紫外吸收光谱(图4)。如图所示,Luminol与NaIO4混合溶液的吸收光谱(曲线d)并不是由Luminol(曲线b)与NaIO4(曲线a)的吸收光谱纯粹叠加所形成。Luminol在221、300、347 nm处的吸收峰值降低,NaIO4在194 nm处的吸收峰值消失,说明Luminol与NaIO4发生了反应。当向Luminol-NaIO4体系加入吡喹酮溶液时,对比曲线d和g,两者吸收峰的位置大致相似,而吡喹酮在201 nm处的吸收峰消失(曲线c),NaIO4在194 nm处(曲线a)的吸收峰消失,Luminol的特征吸收峰略有降低,说明吡喹酮与体系中的NaIO4发生了反应,导致其吸收光谱的峰形发生了变化。

图3 鲁米诺化学反应的化学发光光谱Fig.3 Chemiluminescence spectra of luminol chemical reactionsc(Luminol)=5.0×10-3 mol/L;c(NaIO4)=3.0×10-4 mol/L;c(Praziquantel)=1.0×10-4 mol/L;c(NaOH)=0.1 mol/L
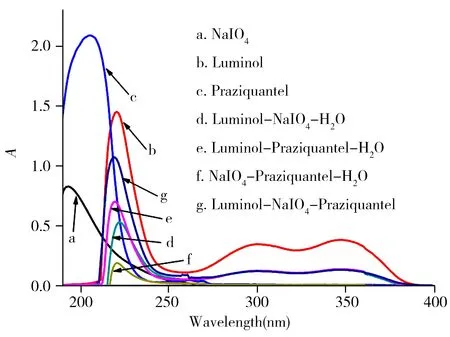
图4 不同溶液的紫外-可见吸收光谱Fig.4 Ultraviolet-Visible absorption spectra of different solutionsc(Luminol)=5.0×10-3 mol/L;c(NaIO4)=3.0×10-4 mol/L;c(Praziquantel)=1.0×10-4 mol/L;c(NaOH)=0.1 mol/L
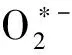
2.2 实验条件的选择
2.2.1 流路及仪器参数的选择为了获得最佳的化学发光强度,对不同流路、混合管长度(3~9 cm)以及光电倍增管负高压(500~700 V)进行考察。实验发现:当采用图1的流路,且混合管长度为7 cm,光电倍增管负高压为550 V时,化学发光强度较大且信号稳定。
2.2.2 流速的选择试剂的流速会对化学发光强度造成一定影响,因此本实验对P1泵(1.4~3.0 mL/min)与P2泵(1.3~3.0 mL/min)的流速进行了考察。结果显示,当P1泵的流速在1.4~1.9 mL/min范围时,发光强度随着流速的增加而增加;而当流速大于1.9 mL/min时,发光强度反而下降。实验表明:Luminol与NaOH混合溶液的进样速率会直接影响发光强度的大小,且当P1泵的流速为1.9 mL/min时发光强度达到最佳。因此,选择1.9 mL/min作为P1泵的最佳流速。同理分析可知,当P2泵的流速在1.3~2.4 mL/min范围时,发光强度随流速的增加而增加;当流速大于2.4 mL/min时,发光强度反而下降。因此,选择2.4 mL/min作为P2泵的最佳流速。
2.2.3 化学发光试剂的优化对该体系中所有试剂(NaOH、Luminol及NaIO4)的浓度进行优化。由于介质的碱性强弱对该体系具有重要影响,且不同的碱性介质对发光强度的作用也不同。实验配制了相同浓度的NaOH、Na2CO3和NaHCO3等碱性溶液,分别以此3种溶液作为该体系的碱性介质。结果表明,在以NaOH为碱性介质时,吡喹酮的化学发光强度相对稳定且检测信号好。因此,实验选用NaOH作为检测体系的碱性介质。进一步考察不同浓度NaOH(1.0×10-4~2.0×10-2mol/L)对体系的影响。结果显示,初始阶段,体系的化学发光信号随着NaOH浓度的增加而增加,当浓度为8.0×10-3mol/L时化学发光强度达到最高,随着NaOH浓度的继续增大,化学发光强度反而减小,因此实验选择8.0×10-3mol/L作为NaOH的最佳浓度。
Luminol作为化学发光反应中的发光剂,其浓度变化也对该体系的发光强度、检测灵敏度以及线性变化产生直接影响。本实验考察了Luminol在1.0×10-5~1.0×10-3mol/L浓度范围内的影响。结果显示,化学发光强度随Luminol浓度的增加而增加,当其达到4.0×10-4mol/L后,化学发光信号的强度逐渐趋于平稳,从试剂的节约性考虑,选择Luminol溶液的最佳浓度为4.0×10-4mol/L。
NaIO4作为该实验体系的氧化剂,其浓度同样影响着发光强度。本实验对NaIO4在1.0×10-5~1.0×10-3mol/L浓度范围内进行了考察。结果显示,体系的化学发光信号随着NaIO4浓度的增大而增大,当浓度为3.0×10-4mol/L时化学发光强度达到最大,随着其浓度的继续增大,化学发光强度的增加逐渐减缓,因此实验选择NaIO4的最佳浓度为3.0×10-4mol/L。
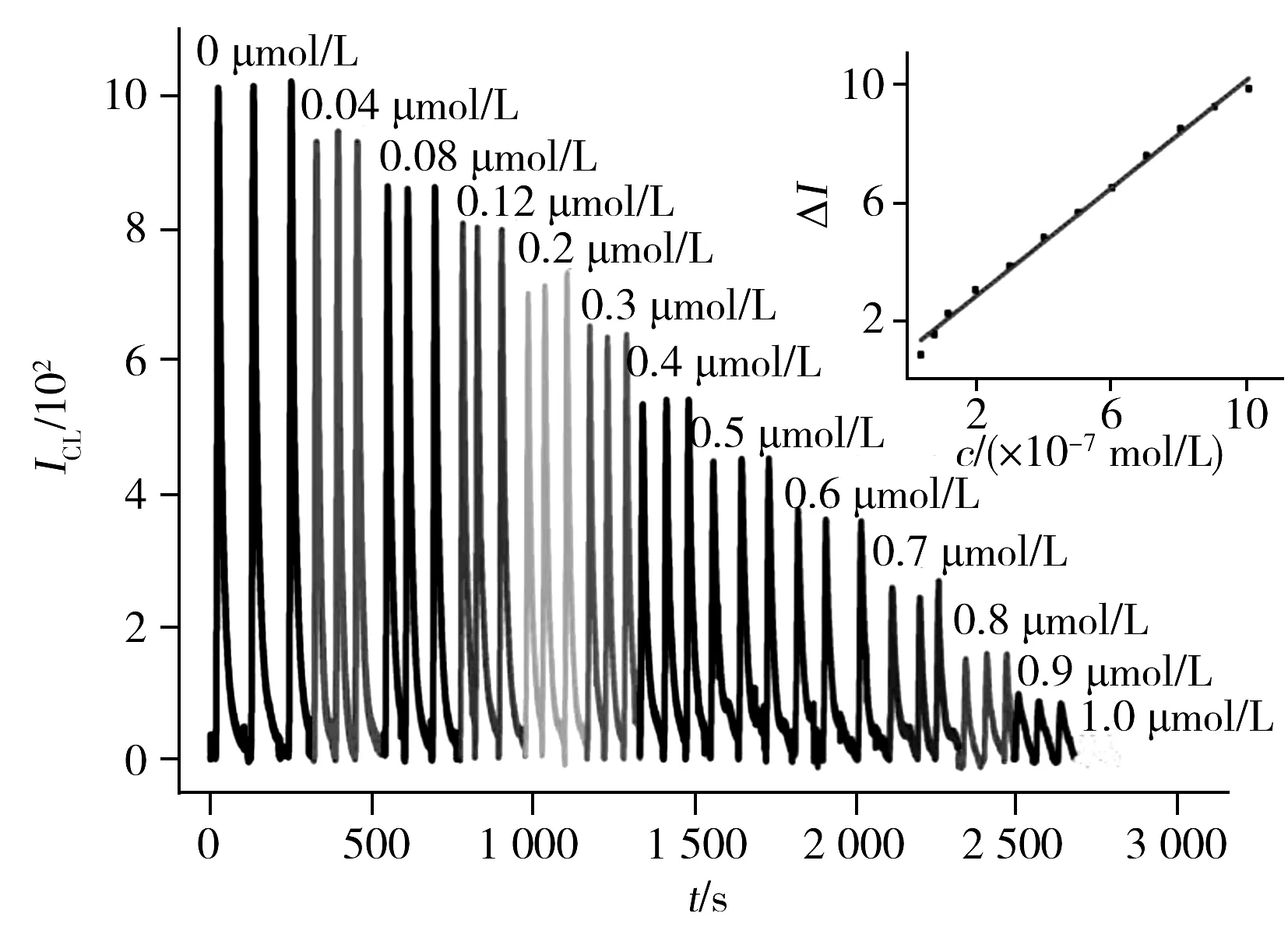
图5 不同浓度吡喹酮在Luminol-NaIO4体系的流动注射信号Fig.5 Typical flow injection signals for different concentrations of praziquantel in the Luminol-NaIO4 systeminset:linear calibration curve in different praziquantel concentrations
2.3 线性范围、检出限与精密度
在最佳条件下,考察了不同浓度吡喹酮与相对化学发光强度(ΔI)的线性关系。结果显示,吡喹酮浓度在4.0×10-8~1.0×10-6mol/L范围内与ΔI呈良好线性关系,且不同浓度的吡喹酮在Luminol-NaIO4体系中随时间的递增呈逐渐递减的规律性变化(图5)。吡喹酮的检出限(3σ)为9.9×10-9mol/L,其线性方程为:ΔI=96.48c+84.38(c的单位为10-7mol/L),r2=0.991 1。对2.0×10-7mol/L的吡喹酮溶液平行测定11次,相对标准偏差(RSD)为1.4%。
将本方法与文献报道检测吡喹酮的方法进行比较,由表1可知,与其它方法相比,此方法具有使用仪器简单、检测灵敏度高的优点。
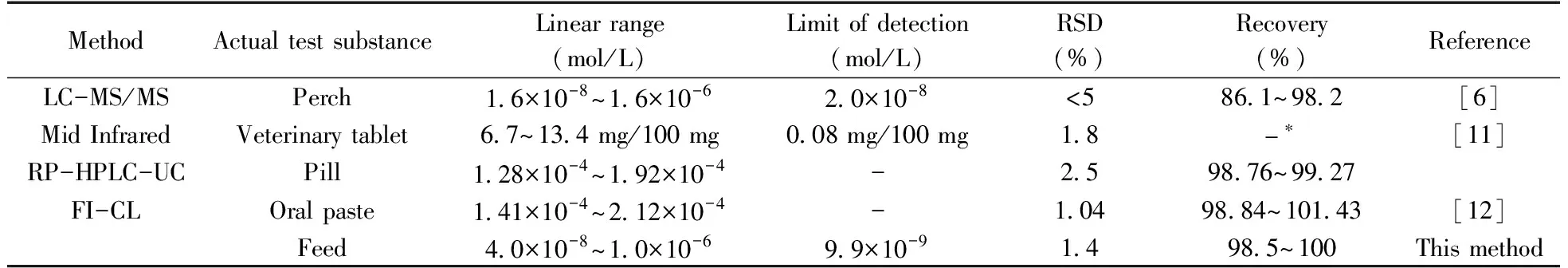
表1 不同方法测定吡喹酮的比较Table 1 Comparison of different methods for determination of praziquantel
* no data
2.4 干扰实验
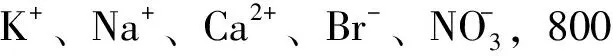
2.5 样品的测定
所测猪饲料样品均购自周边农贸市场的,对购买的猪饲料进行前处理[23],然后按照“1.2”方法,将其稀释至线性范围内进行加标回收实验以检验该方法的准确性(表2)。结果显示:按不同浓度进行加标后,测得猪饲料中吡喹酮的加标回收率为98.5%~100%,RSD为1.6%~2.4%。

表2 猪饲料中吡喹酮含量的测定结果(n=7)Table 2 Determination results of praziquantel in pig feed(n=7)
*no data
3 结 论
本文基于吡喹酮对Luminol-NaIO4化学发光体系较强的抑制作用,联合流动注射技术,建立了一种简单、快速、灵敏测定吡喹酮的新方法。该方法的检测范围为4.0×10-8~1.0×10-6mol/L,检出限为9.9×10-9mol/L,加标回收率为98.5%~100%。该方法灵敏度高、分析速度快,可用于猪饲料中吡喹酮含量的测定。
