不同种源延胡索及土壤中有机氯农药残留特征及安全评价①
2019-07-26陈华华祁俊生陈书鸿
刘 雷,戚 特,赵 丰,吕 洁,张 行,陈华华,祁俊生,陈书鸿*
不同种源延胡索及土壤中有机氯农药残留特征及安全评价①
刘 雷1,戚 特1,赵 丰1,吕 洁1,张 行1,陈华华1,祁俊生2,陈书鸿1*
(1 重庆三峡学院环境与化学工程学院,重庆万州 404100;2 三峡库区水环境演变与污染防治重点实验室,重庆万州 404100)
以万州、开县实验基地土壤和9个种源延胡索为研究对象,使用气相色谱–电子捕获检测器(GC-ECD)检测了土壤和延胡索中有机氯农药(OCPs)残留量,分析其残留特征和生态安全。结果表明:①在土壤和延胡索样品中均检出了滴滴涕(DDTs)和六六六(HCHs),DDTs的检出率分别为100% 和83.3%,HCHs的检出率分别为72.2% 和100%。DDTs和HCHs残留量具有较大的离散性和一定的区域差异性。②在土壤样品中,检出率较高的是4,4'-DDE和α-HCH,分别为100% 和66.7%。4,4'-DDE和α-HCH是OCPs残留的主要成分。③在延胡索样品中,检出率较高的是α-HCH、4,4'-DDE和β-HCH,分别为100%、77.8% 和55.6%,3种成分占OCPs残留量的73.7%。延胡索对α-HCH和4,4'-DDE有很强的生物富集作用,富集因子分别约为1.8和0.65。④实验基地土壤OCPs残留符合《土壤环境质量标准》二级标准,属于尚清洁水平,延胡索的OCPs残留量符合《药用植物及制剂外经贸委绿色行业标准》。
延胡索;土壤;有机氯农药残留;残留特征;安全评价
有机氯农药(OCPs)是持久性有机污染物,在土壤中残留时间长,并可通过生物链富集在动植物体内,而且在人体内可引起积蓄性中毒[1-3]。虽然我国已禁用OCPs 30余年,但其挥发性低,化学性质稳定,不易分解,至今仍能在土壤、生物体内检出OCPs残留[3]。我国是中药材生产大国,由于中药材的种植期较长,尤其是根类药材更易受到OCPs的污染[4-5],由此引起的中药材质量下降已成为制约我国中药材走向国际市场的“瓶颈”[6]。《中华人民共和国药典》(2000年版)[7]首次规定了9种OCPs残留的检测方法,并对甘草、黄芪等少数药材品种规定了OCPs残留的限量标准,但对其余药材均未提出限量要求。
延胡索为大宗常用中药,是国内许多著名中成药的主要原料,现已经实现了大面积人工种植[8]。据文献报道,目前仍然在延胡索中检出了OCPs残留[6,9-11]。延胡索在三峡库区已经具有一定的种植规模,为了进一步加强规范化生态种植,提高中药材质量,本课题组从浙江、安徽、陕西等地引种了延胡索,在重庆万州和开县建立了实验种植基地。这两个基地在三峡库区具有一定的典型代表性,通过试验种植,可以为三峡库区推广延胡索种植提供科学依据。但是目前对三峡库区土壤中农药残留的调查和研究还不够,仍然不清楚其OCPs残留的状况和分布、组成特征,以及土壤环境质量是否安全[12-13]。因此,本文以两个实验基地引种的延胡索和土壤为研究对象,采用超声波辅助提取技术及固相萃取分离技术,使用毛细柱气相色谱仪(ECD检测器)检测了六六六(HCHs)和滴滴涕(DDTs)残留量,分析其残留状况和组成特征,并结合相关标准和方法予以安全评价,以期为延胡索的质量监控和生态种植提供科学依据和理论指导。
1 材料与方法
1.1 仪器和试剂
7890A气相色谱仪(ECD检测器)(美国安捷伦公司);TDZ5-WS型多管架自动平衡离心机(湖南赛特湘仪离心机仪器有限公司);THZ-82型恒温振荡器(国华企业);MTH-2800D 型氮吹仪(天津奥特赛恩斯仪器有限公司)、SB-5200DTN型超声波清洗机(宁波新芝生物科技股份有限公司);CP225D型分析天平(德国Sartorius公司);DZF-6050MBE型电热恒温真空干燥箱(上海博讯实业有限责任公司)。
α-HCH、γ-HCH、β-HCH、δ-HCH、4,4'-DDE、4,4'-DDD、0,4'-DDT、4,4'-DDT等8种有机氯标准品购于国家标准物质销售中心;弗罗里硅土小柱购于广州泛宏贸易有限公司;石油醚、正己烷、乙酸乙酯、丙酮、二氯甲烷、氯化钠、硫酸钠均为分析纯;高纯氮气购于万州衡山氧气厂。
1.2 材料样品及预处理
万州实验基地地处108º27′06″ E,30º45′26″ N,海拔约400 m,属亚热带湿润型季风气候,年平均降雨量约1 000 ~ 1 300 mm。土壤有机质18.35 g/kg,全氮1.23 g/kg,水解氮12.58 mg/kg,速效钾50.34 mg/kg,有效磷11.34 mg/kg,pH 6.5。开县实验基地地处108º25′38″ E,31º17′23″ N,海拔约700 m,属亚热带湿润型季风气候,年平均降雨量约1 000 ~ 1 300 mm。土壤有机质27.65 g/kg,全氮0.24 g/kg,水解氮9.51 mg/kg,速效钾76.54 mg/kg,有效磷21.91 mg/kg,pH 7.0。
本研究在万州和开县实验基地划片种植了9个不同种源的延胡索,种源地分别为:重庆市开县大德镇(重庆大德)、重庆市开县郭家镇(重庆郭家)、陕西省汉中市周家山镇(陕西周家山)、安徽省芜湖县花桥镇(安徽花桥)、浙江省磐安县新渥镇(浙江新渥)、浙江省磐安县尚湖镇(浙江尚湖)、浙江省磐安县仁川镇(浙江仁川)、浙江省东阳市千祥镇(浙江千祥)、江苏省通州区张芝山镇(江苏张芝山)。
在每个种源片区,按照S形曲线采集延胡索块茎样品20个,均匀混合作为1个样品,按“基地名+种源地”分类标记。在实验室洗净,晾干,70℃烘干,用植物粉粹机粉碎,过60目筛,备用。
土壤样品采集点同延胡索样品,深度约10 ~ 15 cm,为延胡索块茎生长区,用塑料自封袋包装带回实验室,标记同前。在实验室中将土壤样品自然风干后研磨,过60目筛,备用。
1.3 OCPs残留提取及分离净化
精密称取延胡索样品1.000 g(平行3个样品),装于100 ml具塞锥形瓶中,加入10 ml去离子水和20.0 ml丙酮浸泡过夜。超声处理30 min,加入6 g氯化钠和15 ml二氯甲烷,超声15 min,静置,离心,将有机相移入100 ml具塞锥形瓶中,向锥形瓶中加入适量的无水硫酸钠,静置3 h。将上清液置于氮吹仪上浓缩,1 ml正己烷溶解残渣。
用10 ml正己烷活化弗罗里硅土小柱(1 g无水硫酸钠、5 g弗罗里硅土、1 g无水硫酸钠),将提取液倾倒入柱内过柱,用10 ml正己烷-乙酸乙酯(85∶15,)淋洗小柱,将淋洗液收集于10 ml离心管中,离心10 min,取上清液置于氮吹仪上浓缩至1 ml以下,用正己烷定容至1.00ml。
土壤样品制备同上。
1.4 OCPs标准品配制
准确量取8种OCPs对照品,分别用石油醚(沸程60 ~ 90℃)稀释成浓度为400 ~ 500 µg/L的单一标准品储备溶液。然后量取各标准品储备液适量,用石油醚(沸程60 ~ 90℃)稀释成浓度梯度为5.0、10.0、25.0、50.0、100.0、200.0 µg/L的混合标准品溶液。
1.5 气相色谱条件
色谱柱为HP-5弹性石英毛细管柱,规格为(30 m × 0.32 mm,0.25 μm);进样口温度为230℃,检测器温度300 ℃,不分流进样;载气流速:1 ml/min,恒流模式。升温程序:初始温度90℃,保持1 min后以3℃/min升温至120℃,保持3 min;再以10℃/min升温至180℃,保持4 min;然后以5℃/min升温至220℃,保持2 min。每次进样量4 μl,采用外标法定量。
2 结果与讨论
2.1 OCPs残留量公式推导
首先,分别对单一标准品溶液进行测试,得到各标准品的停留时间;然后,取200.0 µg/L的混合标准品溶液4.0 µl 进行测试,得到标准样品气相色谱图,见图1所示。按保留时间顺序依次是α-HCH、β-HCH、γ-HCH、δ-HCH、4,4'-DDE、4,4'-DDD、0,4'-DDT、4,4'-DDT,对应峰分别为1、2、3、4、5、6、7、8。最后,分别取5.0、10.0、25.0、50.0、100.0、200.0 µg/L的混合标准品溶液进行测试,得到不同浓度的标样色谱峰面积,以浓度对峰面积作回归分析,如表1所示,峰面积()与浓度()呈现较好的线性关系,则样品中OCPs残留含量(μg/kg)可表示为:样样式中,为样品的农残浓度(μg/L),样为样品农残提取净化后的定容体积(ml),样为样品质量(g)。
2.2 土壤和延胡索中OCPs的残留量
万州、开县实验基地土壤样品和延胡索样品的HCHs和DDTs残留量见表2。从表2可以看出,土壤中OCPs残留的检出率相当高,DDTs的检出率为100%,HCHs的检出率为72.2%,说明三峡库区土壤中普遍存在OCPs残留。DDTs残留量显著大于HCHs,和对我国南方土壤的研究报道一致[1,14]。例如,苏南农田DDTs和HCHs平均残留量分别介于137 ~ 172 μg/kg和10 ~ 12 μg/kg[1],南京地区DDTs和HCHs残留量均值分别为64.1 μg/kg和13.6 μg/kg[14]。这是因为土壤中DDTs稳定性高于HCHs,其降解速率相对缓慢[14-16]。另外,许峰和祁士华[13]研究了三峡库区水体中OCPs残留,发现HCHs残留量大于DDTs,说明HCHs受雨水淋洗后流失较多,这可能是另外一个原因。从土壤样品的测试结果来看,万州、开县实验基地HCHs残留量分别介于1.51 ~ 20.85 μg/kg和1.69 ~ 31.79 μg/kg,DDTs残留量分别介于53.86 ~ 181.24 μg/kg和69.34 ~ 249.68 μg/kg,OCPs残留表现出了明显的区域差异性,即使在同一区域,也呈现出较大的离散性。这与安琼等[1,14]报道的:“苏南农田DDTs和HCHs残留量范围分别为17 ~ 1 115 μg/kg和5.6 ~ 22 μg/kg[1],以及南京地区DDTs和HCHs残留量范围分别为6.3 ~ 1 050 μg/kg和2.7 ~ 130 μg/kg[14]”是一致的。万州实验基地的农药残留量小于开县实验基地,可能是万州基地处于城市边缘,土壤有机质含量较低;开县基地处于农村,经常施用农家肥导致土壤有机质含量高,土壤胶团对OCPs的吸附能力强一些[14]。

表1 8种OCPs标准品的保留时间及回归方程
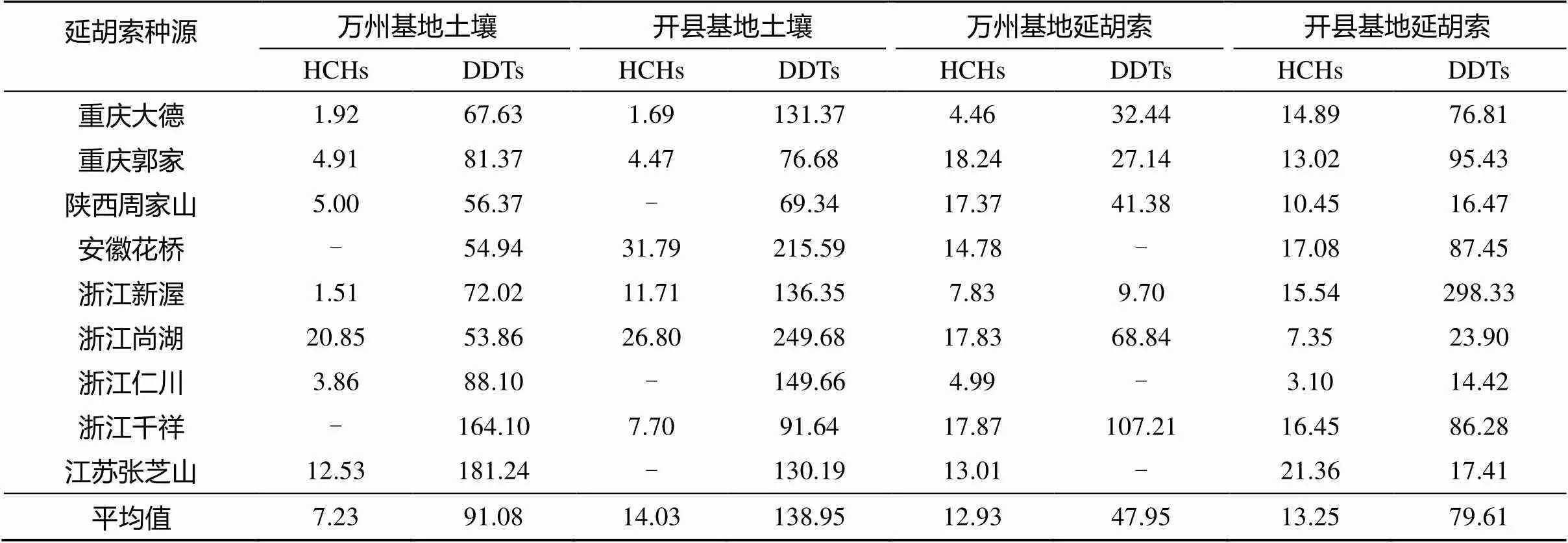
表2 实验基地土壤和不同种源延胡索中HCHs和DDTs残留状况(μg/kg)
注:“-”表示低于检出限或者没有检出;平均值,是对有检出量的样品求和然后取均值,下同。
延胡索中OCPs残留的检出率也相当高,HCHs的检出率为100%,DDTs的检出率为83.3%,说明延胡索药材中普遍存在OCPs残留,这与从晓东等[4]、邹耀华[5]、黄卫平等[6,10]研究报道的结果较为一致。延胡索中DDTs残留量显著高于HCHs以及开县基地延胡索中OCPs平均残留量大于万州基地延胡索,表明土壤中农药残留量对延胡索影响较大。延胡索样品中DDTs残留有较大的离散性,而HCHs残留离散性较小。延胡索中DDTs残留小于土壤DDTs残留,而HCHs残留大于土壤HCHs残留,表明延胡索对HCHs的生物富集作用大于DDTs。本次检测表明,11% 的延胡索样品的DDTs残留量超过了100 μg/kg,绝大部分延胡索符合《药用植物及制剂外经贸委绿色行业标准 WM/T—2004》中规定的“ HCHs≤100 μg/kg,DDTs≤100 μg/kg”标准要求。
2.3 土壤和延胡索中OCPs残留的组成
2.3.1 土壤中OCPs残留的组成 万州、开县实验基地土壤样品的α-HCH、β-HCH、γ-HCH、δ-HCH、4,4'-DDE、4,4'-DDD、0,4'-DDT、4,4'-DDT残留量见表3。从表3可以看出,α-HCH和β-HCH是土壤中HCHs残留的主要成分,二者的检出率分别为66.7% 和33.3%,平均残留量分别占80.8% 和19.2%。α-HCH残留量分别介于1.92 ~ 18.60 μg/kg和1.69 ~ 27.73 μg/kg,表现出较大的离散性和一定的区域差异性。β-HCH残留量分别介于1.25 ~ 2.25 μg/kg和1.75 ~ 4.06 μg/kg,离散性较小。
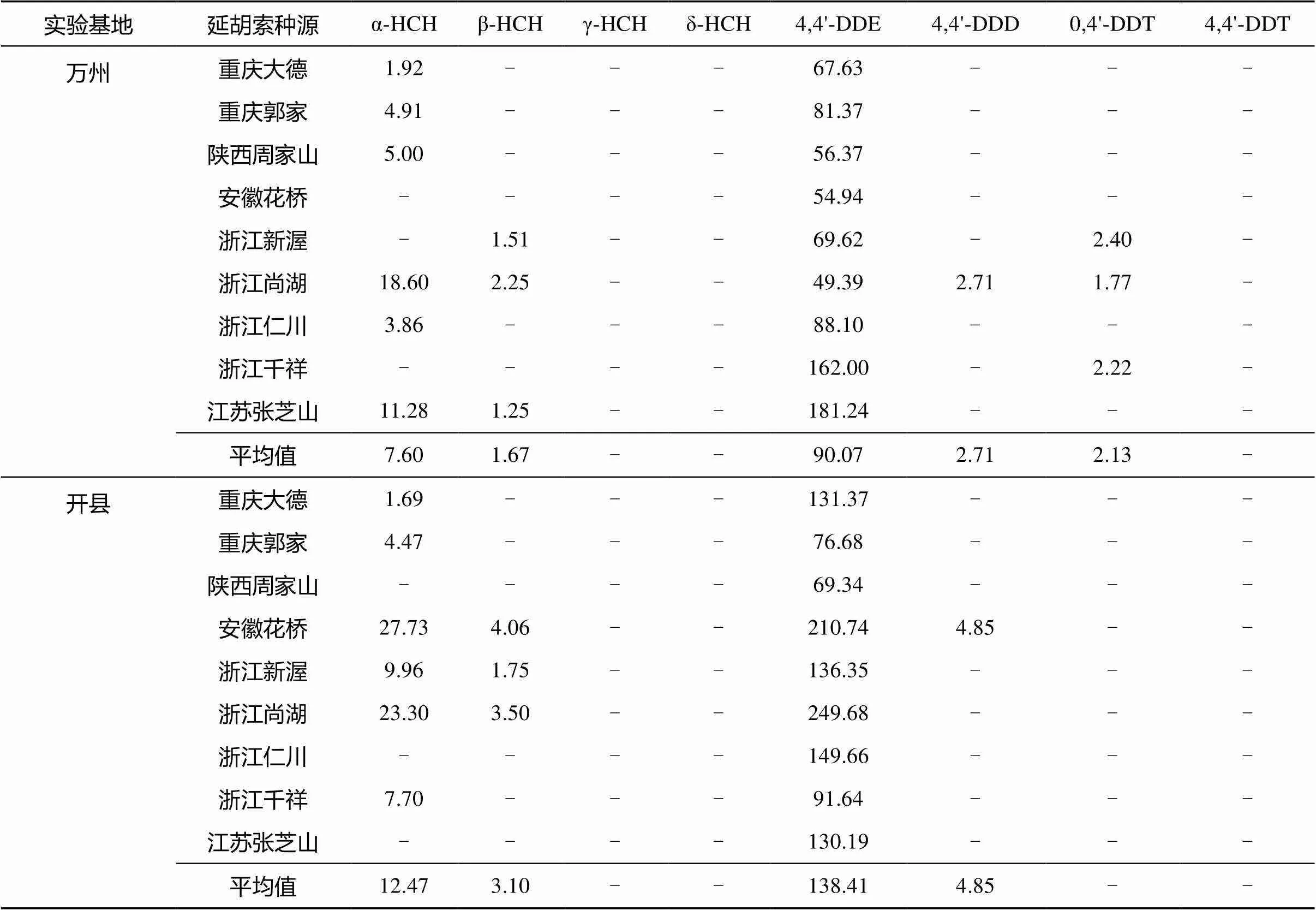
表3 实验基地土壤中8种OCPs残留量(μg/kg)
土壤中DDTs残留量较大,4,4'-DDE的检出率为100%,0,4'-DDT为16.7%,4,4'-DDD为11.1%。其中4,4'-DDE残留量分别介于49.39 ~ 181.24 μg/kg和69.34 ~ 249.68 μg/kg,表现了较大的离散性和区域差异性。4,4'-DDE是DDTs的主要残留物,与前期报道较为一致[1,14],例如南京地区4,4'-DDE占50.6%[14],苏南农田4,4'-DDE占47%[1]。虽然4,4'-DDE在DDTs原药中含量很低,但实验基地气温高、雨量大,土壤中微生物十分活跃,且基地土壤属于旱地,长期处于好氧状况。这些因素使得大部分DDT在好氧条件下转化为DDE,小部分在厌氧条件转化为DDD;而DDE几乎不为生物和环境所降解,能够长期稳定存在[16-17]。本次检测结果表明,4,4'-DDT/(4,4'-DDE+ 4,4'-DDD)的比值远小于1,说明DDTs已降解为4,4'-DDE和4,4'-DDD,土壤中的DDTs来源于历史的施用,没有新的污染源[15]。
2.3.2 延胡索中OCPs残留的组成及生物富集 表4显示了两个基地不同种源延胡索样品的8种OCPs残留量。由于延胡索有机物成分复杂[18],影响了OCPs残留提取和净化效果,测试精度有所降低,误差略大于土壤样品。
从表4可以看出,延胡索中α-HCH的检出率均为100%,4,4'-DDE在开县基地延胡索中检出率为100%,万州基地中略有下降为67%;β-HCH在开县基地延胡索中检出率为67%,但在万州基地中却只有33%;其他组成几乎没有检出。α-HCH是延胡索中HCHs残留的主要成分,平均残留量占82.3%;4,4'-DDE是DDTs残留的主要成分,平均残留量占70%。α-HCH残留量分别介于4.46 ~ 17.87 μg/kg和3.10 ~ 19.24 μg/kg,具有一定的离散性;4,4'-DDE残留量分别介于7.99 ~ 107.21 μg/kg和14.42 ~ 298.33 μg/kg,离散性较大;而β-HCH残留量差别较小。从平均残留量来看,4,4'-DDE占OCPs残留61%,α-HCH占10.4%,4,4'-DDE是延胡索OCPs残留的主要成分。
虽然延胡索中4,4'-DDE残留量明显高于α- HCH,但相对土壤而言,延胡索中α-HCH残留检出率明显提高,而且残留量也较高。这说明延胡索对α-HCH的生物富集作用大于4,4'-DDE,本文分别计算了α-HCH和4,4'-DDE的生物富集因子(bioconcentration factors,简称BCF,定义为平衡时化合物在生物体内与环境中浓度的比值,BCF=f/w)[19-20],见表5,均以干重计。如果某个样品中没有检测出农药残留,则代入平均值来计算。
从表5可知,延胡索对α-HCH、4,4'-DDE的平均生物富集因子分别约为1.8和0.65,对α-HCH的富集作用大于4,4'-DDE,与前期对胡萝卜、萝卜等的研究报道一致[19-20]。例如,南京市郊胡萝卜对HCHs和DDTs的生物富集因子分别为1.1和0.8,萝卜分别为0.9和0.4[19];我国中部某污水灌溉区胡萝卜对HCHs和DDTs的生物富集因子分别为1.95和0.03,萝卜分别为1.89和0.012[20]。同时,两个基地延胡索的生物富集因子非常接近,说明延胡索对OCPs的生物富集作用受环境的影响较小。
2.4 土壤中OCPs残留的污染指数评价
本研究所测土壤样品的OCPs残留全部低于《土壤环境质量标准GB15618—1995》二级限量(≤500 μg/kg),其中HCHs残留全部低于一级限量(≤50 μg/kg)标准,但DDTs残留全部高于一级限量(≤50 μg/kg)标准,表明实验基地土壤具有一定的OCPs污染风险,因此参照GB 15618—1995《土壤环境质量标准》的二级限量(≤500 μg/kg)进行污染指数评价。
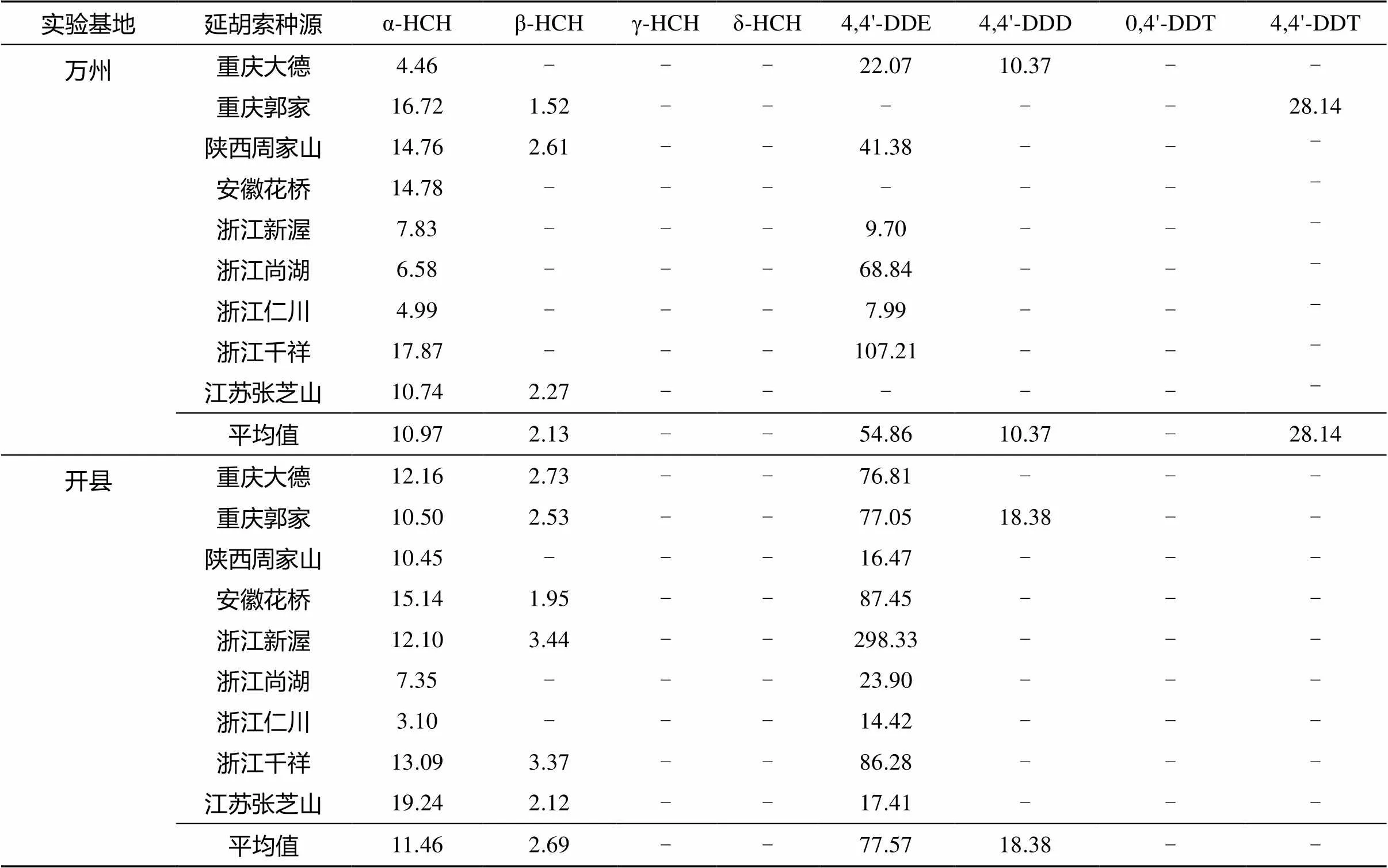
表4 实验基地延胡索中8种OCPs残留量(μg/kg)
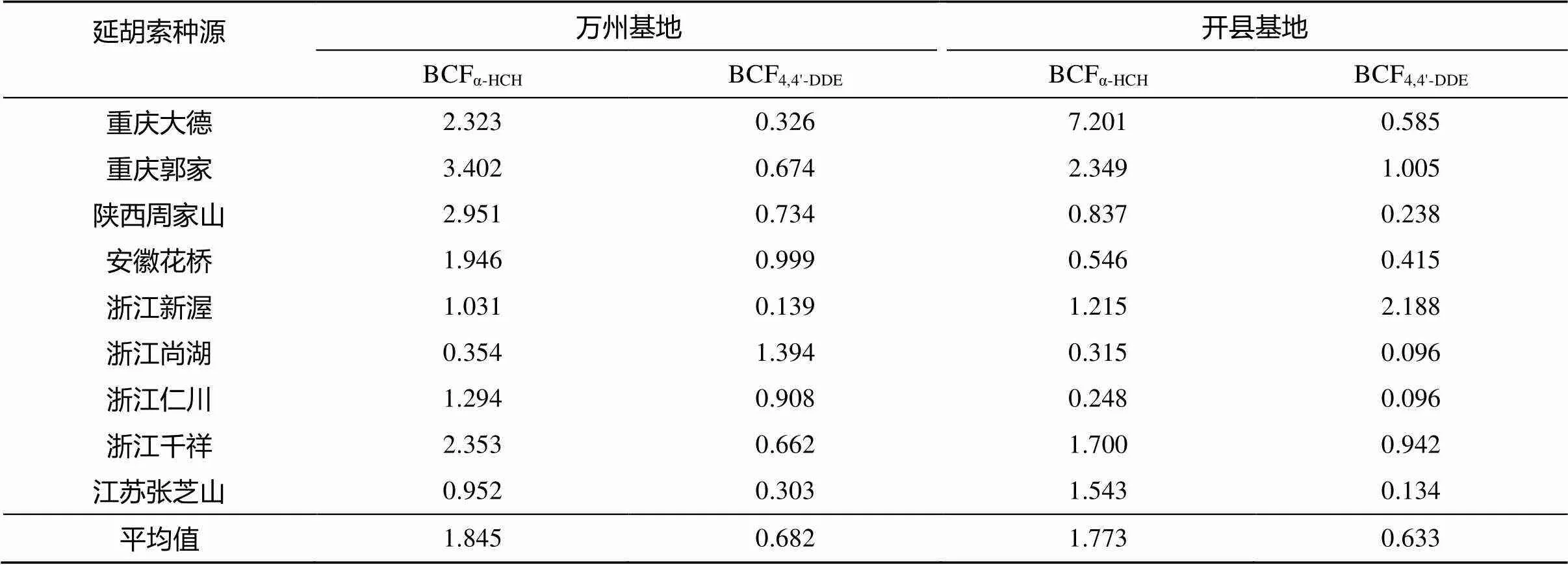
表5 实验基地不同种源延胡索的生物富集因子
单因子污染指数的计算方法为[21]:
P=C/S(2)
式中:P为土壤中污染物的污染指数;C为土壤中污染物的实测浓度,单位为μg/kg;S为污染物的评价标准,单位为μg/kg。
内梅罗综合污染指数法的计算方法为[21]:
{ [(C/S)2ave(C/S)2max]2}1/2(3)
式中:为综合质量指数;(C/S)2ave为单项质量指数的平均值;(C/S)max为单项质量指数的最大值。按照《土壤综合污染指数分级标准》,一级(≤0.7)清洁(安全),二级(0.7<≤1.0)尚清洁(警戒限),三级(1<≤2.0)轻度污染,四级(2<≤3.0)中度污染,五级(>3)重污染。
由于农药残留量的离散性较大,对于同一实验基地,本文按照HCHs和DDTs的最大残留量(max)、平均残留量(ave)、最小残留量(min)进行评价分析(仅统计有检出量的样品),评价结果列于表6。
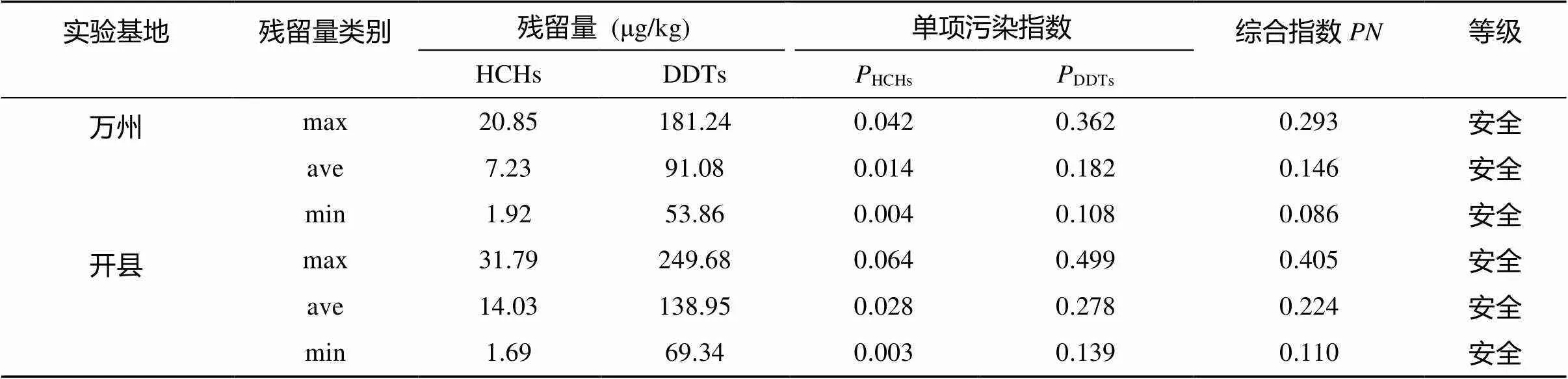
表6 实验基地土壤农药残留量的污染指数
从表6可以看出,HCHs和DDTs的单因子指数均小于1,说明土壤样品中HCHs和DDTs的含量符合二级标准。从内梅罗综合指数来看,均小于0.7,土壤环境质量属于安全水平。同时,土壤质量也符合《中药材生产质量管理规范(试行)》要求的二级标准(≤500 μg/kg)。但也有学者指出,中国现行的GB15618—1995《土壤环境质量标准》已无法满足当前土壤环境保护与质量安全管理的需求[22]。如果以HJ/T 332—2006《食用农产品产地环境质量评价标准》(≤100 μg/kg)作为评价标准,土壤的OCPs残留风险等级就处于警戒限或轻度污染水平。
3 结论
1)万州、开县实验基地土壤中仍然有OCPs残留,DDTs的检出率为100%,HCHs的检出率为72.2%。DDTs的残留量明显大于HCHs,占OCPs残留量的90% 以上。其中,4,4'-DDE的检出率为100%,α-HCH为66.7%,其他成分的检出率较低;4,4'-DDE约占OCPs残留量的86.8%,α-HCH约占7.6%。土壤OCPs残留表现出一定的区域差异性和较大的离散性。污染指数评价表明,万州、开县实验基地土壤的环境质量符合《土壤环境质量标准》二级要求,处于安全水平。
2)在延胡索样品中均检出了OCPs残留,HCHs的检出率为100%,DDTs的检出率为83.3%。DDTs残留量高于HCHs,占OCPs残留量的约83%。其中,α-HCH的检出率为100%,4,4'-DDE为77.8%,β-HCH为55.6%,其他成分的检出率较低;4,4'-DDE约占OCPs残留61.1%,α-HCH约占10.4%,β-HCH约占2.2%。延胡索中OCPs残留具有较大的离散性,但区域差异性不明显。延胡索对α-HCH和4,4'-DDE有很强的生物富集作用,检测结果表明存在OCPs残留,但残留量符合《药用植物及制剂外经贸委绿色行业标准》要求。
[1] 安琼, 董元华, 王辉, 等. 苏南农田土壤中有机氯农药残留规律[J]. 土壤学报, 2004, 41(3): 414–419
[2] 朱英月, 刘全永, 李贺, 等. 辽东与山东半岛土壤中有机氯农药残留特征研究[J]. 土壤学报, 2015, 52(4): 888– 901
[3] 赵玲, 滕应, 骆永明. 中国农田土壤农药污染现状和防控对策[J]. 土壤, 2017, 49(3): 417–427
[4] 丛晓东, 李颖, 方卫, 等. 中药元胡、丹参、芍药中有机氯残留量的测定[J]. 中国药科大学学报, 1999, 30(2): 25– 29
[5] 邹耀华. 浙江省八味中药材中有机农药和有害重金属本底调查[D]. 杭州: 浙江大学, 2006
[6] 黄卫平, 唐红芳, 金锋, 等. “浙八味”药材重金属和有机氯农药残留分析[J]. 中华中医药学刊, 2013, 31(3): 624–626
[7] 国家药典委员会. 中华人民共和国药典[M]. 北京: 化学工业出版社, 2000
[8] 陈彩霞, 李艾莲, 兰金旭, 等. 规范化种植延胡索药材的质量评价[J]. 武汉植物学研究, 2010, 28(5): 618– 622
[9] 张丽丽, 张丽艳, 杨玉琴. 贵州省本地栽培延胡索与原引种地延胡索重金属及农药残留量分析[J]. 贵阳医学院学报, 2004(4): 338–339
[10] 黄卫平, 唐红芳, 阮征. GC法检测浙八味药材中有机氯农药的残留[J]. 华西药学杂志, 2008, 23(5): 590–591
[11] 杨立新, 张永欣, 张启伟, 等. 毛细管气相色谱法测定中药材中19种有机氯类农药残留[J]. 中国实验方剂学杂志, 2013, 19(4): 96–99
[12] 唐将, 王世杰, 付绍红, 等. 三峡库区土壤环境质量评价[J]. 土壤学报, 2008, 45(4): 601–607
[13] 许峰, 祁士华. 三峡库区水体有机氯农药污染特征[J]. 长江流域资源与环境, 2012, 21(10): 1248–1253
[14] 安琼, 董元华, 王辉, 等. 南京地区土壤中有机氯农药残留及其分布特征[J]. 环境科学学报, 2005, 25(4): 470– 474
[15] 窦磊, 杨国义. 珠江三角洲地区土壤有机氯农药分布特征及风险评价[J]. 环境科学, 2015, 36(8): 2954–2963
[16] 卢桂宁, 陶雪琴, 杨琛, 等. 土壤中有机农药的自然降解行为[J]. 土壤, 2006, 38(2): 130–135
[17] 洪青, 蒋新, 李顺鹏. 微生物降解DDT研究进展[J]. 土壤, 2008, 40(3): 329–334
[18] 杨鑫宝, 刘扬子, 杨秀伟, 等. 磐安延胡索的化学成分研究[J]. 中草药, 2013, 44(16): 2200–2207
[19] 郜红建, 蒋新. 有机氯农药在南京市郊蔬菜中的生物富集与质量安全[J]. 环境科学学报, 2005, 25(1): 90–93
[20] 南淑清, 多克辛, 李红亮, 等. 两种有机氯农药在污水灌溉区蔬菜中的残留及生物富集[J]. 中国环境监测, 2007, 23(5): 59–62
[21] 王辉, 董元华, 安琼. 南京市郊区蔬菜地土壤环境质量评价[J]. 土壤, 2005, 37(3): 295-298
[22] 刘霈珈, 吴克宁, 罗明, 等. 农用地土壤重金属超标评价与安全利用分区[J]. 农业工程学报, 2016, 32(23): 254– 262
Characteristics and Evaluation of Organochlorine Pesticide Residues in Rhizoma Corydalis of Different Provenances and Soil
LIU Lei1, QI Te1, ZHAO Feng1, LÜ Jie1, ZHANG Hang1, CHEN Huahua1,QI Junsheng2, CHEN Shuhong1*
(1 College of Environmental and Chemical Engineering, Chongqing Three Gorges University, Wanzhou, Chongqing 404100, China; 2 Key Laboratory of Water Environment Evolution and Pollution Control in Three Gorges Reservoir, Wanzhou, Chongqing 404100, China)
The residual contents of organochlorine pesticide (OCPs) in rhizoma corydalis of different provenances and in soils collected from the experimental bases in Wanzhou and Kaixian of Chongqing were determined by gas chromatography with electron capture detector (GC-ECD), and the residual characteristics and ecological security of OCPs were also analyzed. The results showed that:1) DDTs and HCHs were detected both in soils and in rhizoma corydalis with the detection rates of 100% and 83.3% for DDTs, and of 72.2% and 100% for HCHs, respectively. The residual quantities of DDTs and HCHs had greater discreteness and inter-regional differences. 2) In soil samples, 4,4'-DDE and α-HCH had higher detection rates, which were 100% and 66.7%, respectively. 4,4'-DDE and α-HCH were the main components of OCPs’ residue. 3) In the rhizoma corydalis samples, α-HCH, 4,4'-DDE and β-HCH were detected, the detection rates were 100%, 77.8% and 55.6%, respectively. The three components accounted for 73.7% of OCPs’ residue. Rhizoma corydalis had a strong bioconcentration on α-HCH and 4,4'-DDE, enrichment factors was about 1.8 and 0.65, respectively. 4) OCPs’ residue in experimental base was in line with the requirements of the 2ndstandard of Environmental Quality Standard for Soils, which was in the safe level. OCPs’ residue in rhizoma corydalis was in line with the requirements of Green Standards of Medicinal Plants and Preparations for Foreign Trade and Economy.
Rhizoma corydalis; Soil; Organochlorine pesticide residues; Residual characteristics; Risk assessment
重庆市应用开发计划项目(cstc2014yykfA110024)、三峡库区水环境演变与污染防治重点实验室基金项目(WEPKL2012MS-06)和重庆三峡学院大学生创新计划项目(国家级201610643002)资助。
(shchen1975@163.com)
刘雷(1992—),男,山西吕梁人,硕士研究生,主要研究方向为环境生态学。E-mail: 1318168502@qq.com
X53
A
10.13758/j.cnki.tr.2019.03.019
