绝经后女性促甲状腺激素水平与骨质疏松性骨折的相关性研究
2019-07-26陈庆玲彭年春时立新张巧张淼胡颖
陈庆玲 彭年春 时立新 张巧 张淼 胡颖
贵州医科大学附属医院内分泌科,贵州贵阳550004
骨质疏松症及甲状腺功能紊乱是中老年群体普遍存在的慢性疾病,给女性带来的影响要多于男性,且发病率随着年龄的增长而增加[1-2]。骨折是骨质疏松症最为严重的后果之一,髋部和椎骨骨折还会增加死亡的风险。甲状腺功能紊乱对骨密度及骨质量的改变有着特别不利的影响[3]。甲状腺功能亢进症被普遍认为是骨质疏松、骨折的危险因素[4]。以往研究[5-6]认为甲状腺激素水平的增加是甲亢状态下骨转换增加的原因。然而,甲状腺激素水平正常、促甲状腺激素(thyroid stimulating hormone,TSH)水平降低的亚临床甲亢患者,亦表现出骨量减少,骨折风险增加,提示骨折发生可能与TSH的关系密切。因此,目前TSH水平是否会影响骨折已受到广泛关注,但不同TSH水平对骨折风险的影响仍存在争议。有研究[7]报道,亚临床甲亢并不会增加骨折的风险。还有研究[8]表明,绝经后女性血清TSH水平与骨折发生无关。本文旨在通过对4 073名社区居民的流行病学调查研究,探讨血清TSH水平与骨质疏松性骨折的相关性,为中老年尤其是绝经后女性伴甲状腺功能紊乱时的TSH调控水平提供临床依据。
1 对象和方法
1.1 对象
本研究数据来源于中国2型糖尿病患者恶性肿瘤发生风险的流行病学研究(risk evaluation of cancers in chinese diabetic individuals:a longitudinal study,REACTION研究)贵阳分中心的数据。基线调查于2011年5月至2011年10月进行,采用整群抽样的方法抽取贵阳市云岩区40岁及以上常驻居民(在贵阳市居住5年以上者)10 140人。纳入标准:绝经后女性。排除标准:①患有甲状腺疾病并接受药物治疗者;②有甲状旁腺功能亢进、多发性骨髓瘤、胸腰椎肿瘤及其他恶性肿瘤、严重的肝肾疾病病史者;③排除自我报告的外伤或车祸引起骨折者;④服用雌激素、糖皮质激素等影响骨代谢及甲状腺功能药物者;⑤资料不全者。根据纳入和排除标准共筛选出5 563名绝经后妇女,经过平均39个月(范围在36~46个月)的随访期,有1 490人失访,最后4 073人纳入本研究,年龄从40岁到80岁,随访率为73.2%。根据基线TSH水平,将入选对象分为3组:TSH减低组(TSH<0.55 mIU/L,71例),TSH 正常组(0.55≤TSH≤4.78mIU/L,3 113例),TSH 升高组(TSH>4.78 mIU/L,889例)。本研究获得贵州医科大学伦理委员会的批准,调查对象按自愿参加的原则,均签署知情同意书。
1.2 方法
1.2.1 一般资料:现场调查采用统一的调查表,由经过培训的内分泌科医师对研究对象进行一对一、面对面询问。调查问卷内容包括:基本资料(性别、年龄、女性月经史及绝经年龄、婚育史及家族史等)、骨折史(时间、部位、诱因)、生活习惯(吸烟、饮酒、饮咖啡、食用豆制品、奶制品及运动情况)及既往疾病(甲状腺疾病、甲状旁腺功能亢进、多发性脊髓瘤等,严重肝、肾功能不全,严重创伤史或恶性肿瘤病史,糖尿病、高脂血症等),近期药物使用情况等。身体活动量根据国际体力活动问卷(IPAQ)短卷进行计算[9]。参加者在穿贴身衣服、脱鞋的情况下测量身高、体重、腰围、臀围。体质量指数(bone mass index,BMI)=体重(kg)/身高2(m2)。
1.2.2 血清TSH测定:采集标本后分离出血清,置-80℃冰箱内保存,送至我院中心实验室,应用西门子ADVIA Centaur XP仪器采用化学发光免疫法检测TSH,其批内变异系数为1.7%~4.69%,批间变异率系数为0.88%~4.2%。参考范围为0.550~4.780 mIU/L。
1.2.3 血脂测定:调查对象禁食至少10 h,采集空腹静脉血。将血清离心后分装于Ep管在-80℃低温下保存,分批加干冰运至上海市内分泌研究所(瑞金医院),用雅培全自动生化免疫分析仪(Architectci16200)统一检测。其中均相测定法测高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C),磷酸甘油氧化酶法测甘油三酯(TG),酶试剂法测总胆固醇(TC)。
1.2.4 骨密度测定:骨密度测定采用超声骨密度仪(美国Hologic,Sahara),测量部位为左侧足跟骨,通过测量T值来表示骨密度。
1.3 诊断标准及分组
本研究中对于骨质疏松性骨折的诊断标准是:居民自我报告的脆性骨折史。脆性骨折是指低能量或非暴力骨折,如从站高或者小于站高跌倒或因其他日常活动而发生的骨折[10]。对于血脂异常的定义根据中国成人血脂异常防治指南(2007年)[11]诊断标准:HDL<1.04 mmol/L为降低,LDL≥4.14 mmol/L为升高,TC≥6.22 mmol/L升高,TG≥2.26 mmol/L为升高,满足上述任何一项即可诊断为血脂异常,或有明确高脂血症病史,目前正在服用调脂药物的受访者。吸烟定义为一生中吸烟≥100支[12];饮酒定义为每周至少摄入30 g乙醇且≥1年[12]。
1.4 统计学方法
应用 SPSS20.0进行统计分析,采用Kolmogorov-Smirnov检验计量资料是否呈正态分布,符合正态分布的计量资料以(珋x±s)表示,组间比较采用t检验或ANOVA单因素方差分析,组间多重比较采用SNK-q检验;非正态分布计量资料则采用中位数和四分位间距M(P25,P75)表示,组间比较采用Krukal-Walli H检验;计数资料的分析采用卡方检验,以P<0.05为差异有统计学意义,三组中两两比较,以 P<0.017为差异有统计学意义。采用Logistics回归模型评估骨折危险因素及不同TSH水平与骨折风险的关系。
2 结果
2.1 受访者基线特征
4 073名绝经后女性,平均随访39月后共有207人(5.1%)发生骨质疏松性骨折,根据是否骨折列出了如表1所示的基线特征。骨密度 T值≤-2.5、血脂异常者的比例在骨折组均高于非骨折组,差异具有统计学意义(P<0.05)。
不同TSH水平人群的基线特征显示(见表2),绝经年龄、血脂异常、甲状腺疾病史在三组间比较差异具有统计意义(P<0.05);TSH降低组与TSH正常组、TSH升高组相比,TSH降低组有甲状腺疾病史者比例较高,差异具有统计学意义(P<0.017)。此外,TSH升高组的绝经年龄高于TSH正常组,差异具有统计学意义(P<0.017)。
2.2 不同TSH水平骨折发病情况
平均随访39个月后,TSH降低组、正常组、升高组骨质疏松性骨折的发病人数分别为8、148、51例,其发病率分别为11.3%、4.8%、5.7%。与TSH正常组相比,TSH降低组骨折发病率较高(P<0.017),而TSH升高组与正常组相比差异无统计学意义(P>0.017)。
2.3 不同TSH水平与骨质疏松性骨折风险的关系
以新发骨折(骨折=1,非骨折=0)为因变量,以绝经年龄、甲状腺疾病史(有=1,无=0)、血脂异常(有=1,无=0)、骨密度 T 值≤-2.5(是=1,否=0)、TSH<0.55 mIU/L(是=1,否=0)为自变量,采用logistics回归方法结果显示,血脂异常、骨密度T值≤-2.5、TSH<0.550 mIU/L均是骨质疏松性骨折的危险因素(OR>1,P<0.05),见表3。调整血脂异常、骨密度T值≤-2.5后,TSH降低组与TSH正常组相比,骨折风险增加2.626倍(P<0.017),而TSH升高组与正常组相比差异无统计学意义(P>0.05),见表4。
3 讨论
这项大型前瞻性研究发现,TSH降低组绝经后女性骨折发病率高于TSH正常组及TSH升高组,经多因素logistics回归分析后显示,骨密度T值≤-2.5、血脂异常、TSH<0.55 mIU/L均是骨质疏松性骨折的危险因素。调整骨密度T值≤-2.5、血脂异常后,与TSH正常组比较,TSH降低组骨质疏松性骨折风险增加 2.626倍[95%CI(1.233,5.592),P<0.05],提示TSH水平降低可能是骨质疏松性骨折的危险因素。由于新诊断的骨质疏松症病例越来越多,有必要对所有可能导致骨密度降低的潜在影响因素进行积极的调查,因为骨质疏松性骨折与生活质量下降、残疾和死亡直接相关。
低骨密度是骨折的一个危险因素。笔者的研究采用定量超声(quantitative ultrasound,QUS)测定跟骨骨密度,与双能 X线吸收仪(dual-energy x-ray absorptiometer,DXA)相比,QUS 具有经济、方便、无射线的特点,适用于流行病学调查研究。随着QUS广泛应用,研究[13]表明QUS具有较好的骨质疏松临床应用的价值,QUS跟骨骨密度T值与DXA测量的T值呈正相关。一项最近的Meta分析[14]显示,QUS能够预测老年男性及女性骨质疏松性骨折的风险。笔者的研究结果显示QUS跟骨骨密度 T值≤-2.5组较骨密度T值>-2.5组,骨质疏松性骨折风险增加1.822倍,与上述结论一致。
多项研究表明血脂异常与骨密度之间可能存在关联。Cui等[15]的研究表明,LDL-C、TC 与绝经前、后女性骨密度均呈负相关,但TC在绝经前女性仅存于腰椎,而在绝经后女性仅存于股骨转子、股骨近端。此外,研究还发现HDL-C与绝经前、后女性任何部位的骨密度均无相关,而TG仅与绝经前妇女股骨转子的骨密度呈负相关。Pliatsika等[16]在希

表1 绝经后女性骨折与非骨折的基线特征比较(珋x±s)Table 1Baseline characteristics of postmenopausal women with or without fractures(珋x±s)
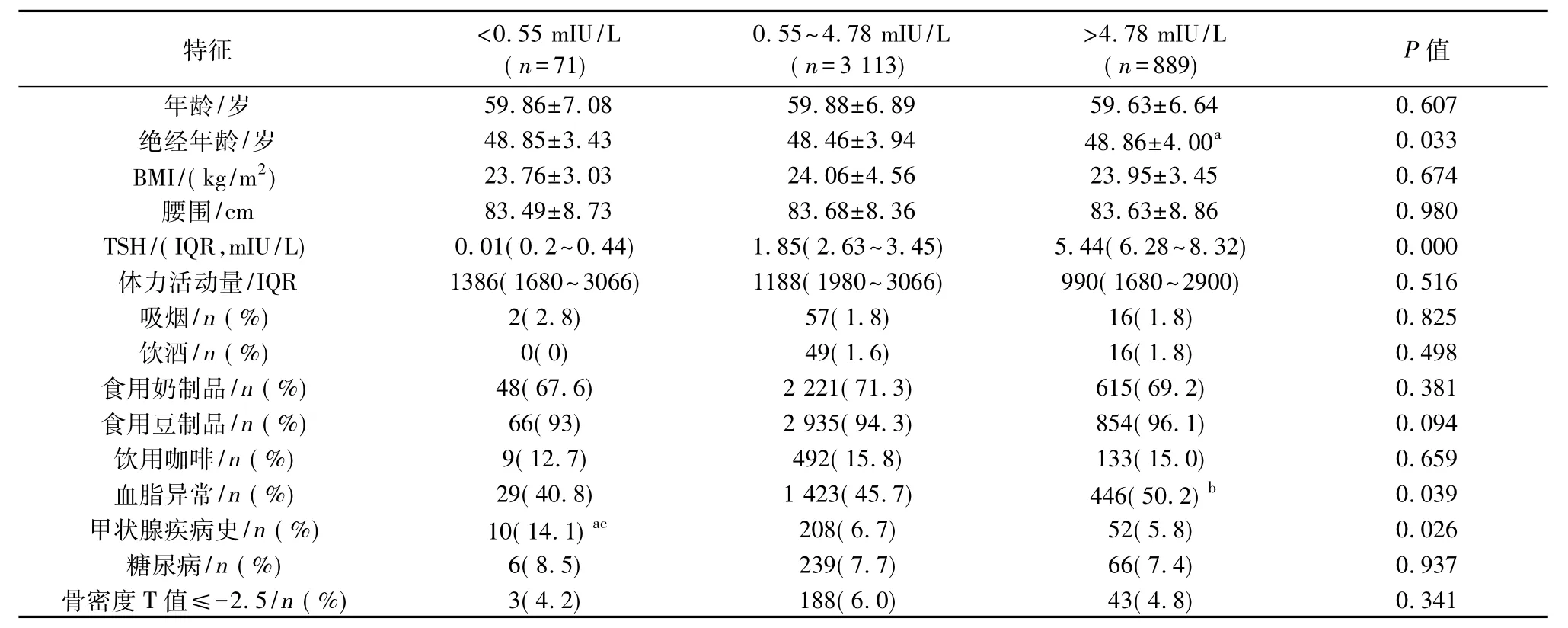
表2 绝经后女性不同TSH水平的基线特征比较(珋x±s)Table 2Baseline characteristics of different TSH levels in postmenopausal women(珋x±s)

表3 骨质疏松性骨折危险因素的Logistic回归分析Table 3 Logistic regression analysis on risk factors of osteoporotic fracture

表4 不同TSH水平的骨折风险Table 4 Hazard ratios for fractures with different TSH levels
腊绝经后女性中发现TC、TG与骨密度均无相关性。因此,不同类型血脂异常对绝经前后女性骨密度影响不同,这可能与种族、年龄以及研究方法不同有关。本研究发现血脂异常是绝经后女性骨质疏松性骨折的独立危险因素。因此,维持血脂水平在正常范围,可能在一定程度上减少骨质疏松性骨折的发生。
本研究发现TSH水平降低与骨折风险增加相关。早在 120多年前,Recklinghausen[17]描述了甲状腺与骨病可能存在的关系。随后许多研究报道[18-19]均表明无论是显性的或亚临床的甲亢均与骨折风险增加相关。然而,甲亢导致的骨质疏松仅因甲状腺激素过量所致的观点已被实验研究所质疑,认为TSH对骨重塑有直接调节作用[20]。为了解TSH与骨折之间的关系,Mazziotti等[21]对130名甲状腺功能正常的绝经后女性进行研究,发现参考范围内低TSH组的椎骨骨折患病率高于中间组及较高组,调整年龄、血清FT4、低BMI、BMD后,发现参考范围内低TSH是椎骨骨折的独立危险因素[OR=2.80,95%CI(1.20,6.79)]。Leader等[22]调查了14 325名65岁以上的甲状腺功能正常者(0.35 mIU/L≤TSH≤4.2 mIU/L),平均随访(102±3)个月后,发现有514人发生髋部骨折,经过年龄、并发症、药物使用等因素的调整后,与中间组(1.7 mIU/L≤TSH≤2.9 mIU/L)相比,女性正常范围内低TSH组(0.35 mIU/L≤TSH≤1.6 mIU/L)髋部骨折风险明显增加[OR=1.28,95%CI(1.03,1.59),P=0.029]。以上研究提示绝经后女性正常范围内低TSH与骨折风险增加相关。
然而,TSH水平与骨折的关系目前仍存在争议,Bauer等[23]在基于9 704人的前瞻性队列研究中对65岁及以上女性随访3.7年后发现,与TSH正常组(0.5 mIU/L≤TSH≤5.5 mIU/L)相比,TSH<0.1 mIU/L者,椎体骨折和髋关节骨折风险分别增加4.5倍和3.6倍。Robert等[24]对17 684名 L-T4替代治疗的患者(平均年龄60.3岁)进行4.5年的随访研究发现,与TSH正常组(0.4 mIU/L≤TSH≤4.0 mIU/L)相比,TSH明显抑制组(TSH≤0.03 mIU/L)骨折风险增加 2倍(OR=2.02,95%CI 1.55~2.62)。这些研究结果提示TSH水平降低是发生骨折的高危因素,这与本研究结果一致,但有研究报道与上述观点不同。Svare等[8]对16 610名40岁及以上女性随访12.5年后,发现基线TSH水平与所有骨折风险之间没有相关性。仅有微弱证据表明,与TSH在正常范围内的中间组(1.5 mIU/L≤TSH≤2.4 mIU/L)相比,女性TSH<0.5 mIU/L和TSH>3.5mIU/L的女性髋部骨折的风险略增加[OR=1.30,95%CI(0.97,1.94)和 OR=1.19,95%CI(0.93,1.52)]。Grain等[7]通过对5 888 例 65 岁及以上老年人的研究发现,无论是男性还是女性,亚临床甲亢与髋部骨折风险及骨密度下降无关。但专家对此述评[25],认为 Garin的研究存在亚临床甲亢患者样本量较少,甲状腺功能随访频次偏少,且实际骨折的数量不确定,一些患者出现骨折后可能就诊其他医院的局限性。并建议,除非甲状腺癌术后抑制治疗,否则,应尽量使TSH水平控制在正常范围之内。
目前,有几种可能的机制来解释TSH与骨代谢的关系,而TSH与骨质疏松性骨折相关的病理生理机制尚不清楚。研究报道,TSH对成骨细胞及破骨细胞均有负性调节作用。TSH受核因子(NF)-κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)和肿瘤坏死因子(TNF-α)激发,抑制JNK/c-Jun和NF-κB信号通路,从而抑制破骨细胞的形成和存活[26]。TSH还可以下调非经典Wnt环路中 frizzled和 Wnt5a,从而抑制成骨细胞分化[27]。甲亢患者TSH水平降低,对成骨细胞和破骨细胞的抑制作用减弱,骨吸收大于骨形成,导致骨质疏松。TSH主要通过与破骨细胞及成骨细胞上TSHR结合影响骨代谢。基因剔除TSHR的小鼠表现出骨量减少,并且比野生型小鼠在TSH浓度不高时的骨丢失更严重,这说明TSH-TSHR信号缺乏是导致TSH受体基因敲除小鼠骨丢失增加的原因,这可能是由于缺乏在骨髓中产生的一种TSHβ剪接变异体[28]。总之,TSH对骨骼的影响机制仍不清楚,还需进一步的研究证实。
本研究主要的优势为大样本前瞻性队列研究,所有受访者在同一个中心检查,资料偏倚较小。但该研究仍存在一定的局限性,如随访率仅为73.2%,且受访者随访期还不够长,可能对结果分析有一定的影响。其次,在不同部位发生骨质疏松性骨折的人数相对较少,不能对TSH水平与不同部位骨折的关系进行分析。另外,只测定一次TSH,且缺少对FT4、FT3、TRAb的检测,不能对所有参与者进行一个更好的分类研究,比较显性甲状腺功能紊乱或亚临床甲状腺功能紊乱者骨折的风险。
综上所述,绝经后女性TSH水平降低与骨质疏松性骨折的风险增加有关。当发现因TSH水平降低而引起临床或亚临床甲状腺紊乱时,使TSH水平维持在正常范围内,将可能减少骨质疏松性骨折的发生。
