超声胃镜引导下腹腔干淋巴结穿刺1例
2019-07-25李叶张北平
李叶,张北平
淋巴转移是食管癌的主要转移方式,当胸段食管癌无胸腔淋巴结转移而却有腹腔淋巴结转移时,称为“跳跃性转移”[1]。腹腔淋巴结“跳跃性”转移的发生率非常低,仅为4.2%,增强CT和PET-CT常作为术前诊断的重要手段,但有时敏感性低,不能满足临床需要,此时,超声胃镜引导下腹腔淋巴结穿刺可取得病理确诊,直接影响治疗方式。广东省中医院胃肠肿瘤多学科协作中心收治l例早期中段食管癌可疑腹腔干淋巴结转移患者,通过多学科讨论合作,取得了良好的治疗效果,现报道如下。
1 病例资料
患者,男,72岁,因“吞咽困难1月”于2017年7月入住广东省中医院胃肠外科。患者近一个月以来逐渐出现吞咽固体食物困难,近期无体重下降。既往史无特殊。入院查体:脉搏70次/min,血压125/70 mmHg,腹平软,无压痛,肠鸣音6次/min。辅助检查:血常规和肝肾功能等正常。胃镜(图1):距门齿32~33 cm后壁见约20 mm×20 mm的Ⅱa+Ⅱc病灶,ME-NBI示IPCLⅤn型。取活检病理诊断为:食管鳞状细胞癌。PET-CT提示(图2):①食管癌,上下径约2 cm;②腹腔干周围软组织病灶,代谢仅轻度增高,建议密切随访观察,以除外淋巴结转移。遂进一步行超声胃镜检查,首先用12 MHz小探头超声(图3)检查,见管壁厚约12.5 mm,以黏膜层至黏膜下层增厚为主,厚约8.2mm,肿瘤侵犯至黏膜下层(T1b)。然后再用纵轴超声胃镜检查(图4),见腹腔干淋巴结肿大,融合,范围约20 mm×18 mm,呈低回声,边界欠清晰,包绕血管。从贲门以COOK22G-PROCORE细针穿刺腹腔干淋巴结(图5、6),采用微负压,分别从淋巴结边缘和中央进针,避开周围血管,并进行扇形技术,共穿4针,抽吸出较多白色组织条(图7)。术后患者没有出血、穿孔、感染等并发症。腹腔干淋巴结病理(图片8):低分化鳞状细胞癌,免疫组化:CK(+),P63(+),P40(+),CK5/6(+),CD56(-),Syn(-),CgA(-),NSE(-),p53(+),ki67(15%+),CK7(-)。患者最后诊断为食管癌伴腹腔淋巴结转移。方案确定为先到放疗科行食管癌新辅助放化疗,遂于7月31日至9月1日共放疗25次,并每周行一次单药同期(顺铂)化疗,共5程化疗。经治疗后患者症状明显好转,无吞咽困难等不适。放化疗后6周行手术治疗,达R0切除。随访至今暂无肿瘤复发。
2 讨论
食管癌发病率在所有恶性肿瘤中居前十位[2],它的远期生存情况与浸润深度、淋巴结转移情况相关。肿瘤浸润全层,长度超过5 cm以及细胞分化程度低患者淋巴结转移多见[3],而T1期原发性食管癌患者肿瘤浸润深度在黏膜下层,病位相对较浅,淋巴结转移相对较少,T1a期、T1b期患者的5年生存率分别为94.5%、74.4%[4]。
食管的淋巴引流并无明显的节段性,一般是各段食管的淋巴注入附近的淋巴结。如胸上段食管癌患者颈部淋巴结转移较为多见,而胸中段食管癌则可转移至颈部、纵隔,少数通过跳跃转移至腹部,胸下段食管癌可转移至隆突下、贲门旁、胃左动脉等腹部淋巴结[5]。食管癌腹腔区域淋巴结转移的规律一直是临床研究的热点,多数为“连续转移”,即沿着食管壁的淋巴引流管至贲门部,然后沿着胃小弯向胃左动脉旁,腹腔动脉旁等处转移,再经腹腔淋巴管汇入胸导管。另外,由于毛细淋巴管黏膜下播散并非连续性,故可无胸腔淋巴结转移而却有腹腔淋巴结转移,即“跳跃性转移”[6]。“跳跃性转移”发生率低,仅为4.2%,但预后差,术后3年生存率仅为42.3%,远低于无腹腔淋巴结转移的患者(70.6%),提示腹腔淋巴结的转移与否仍然是直接影响食管癌患者术后生存率的重要预后因素[7]。
本病例进行了MDT讨论,认为关键点在于判断腹腔干周围淋巴结(第九组淋巴结)有无转移。指南明确指出:对于Tis和T1a患者优先推荐内镜下切除;对于T1b患者,优先推荐根治性食管癌切除术:R0切除者,推荐观察并进行密切随访;R1和R2切除者推荐术后辅助放化疗或支持治疗[8]。
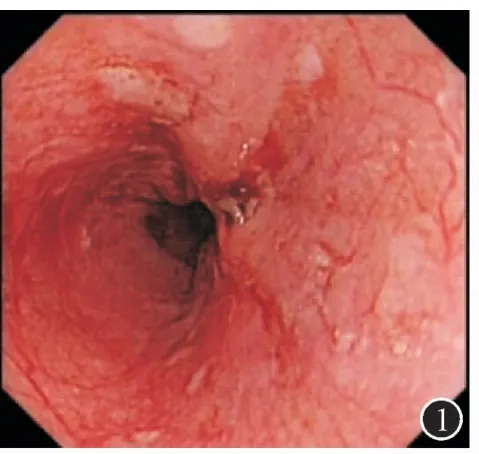
图1 胃镜:食管距门齿32~33 cm后壁见约20 mm×20 mm的Ⅱa+Ⅱc病灶(病理:食管鳞状细胞癌);

图5 从贲门以COOK22G-PROCORE细针穿刺腹腔干淋巴结,以微负压;
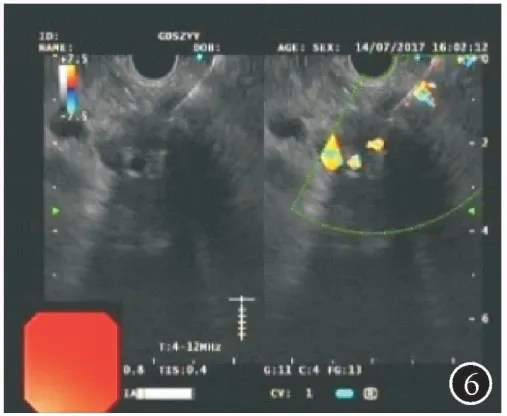
图6 分别从淋巴结边缘和中央进针,避开周围血管,并进行FAN技术;

图7 穿刺物中见白色组织条;
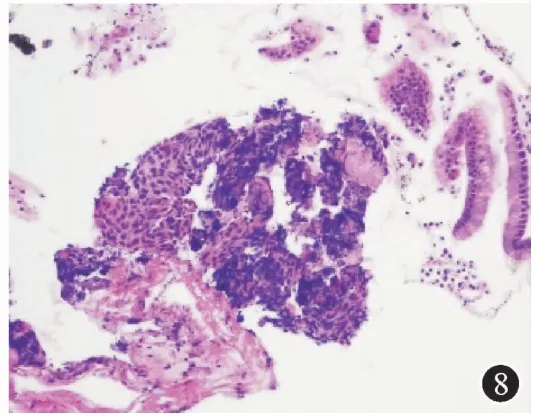
图8 腹腔干淋巴结穿刺病理 低分化鳞状细胞癌。
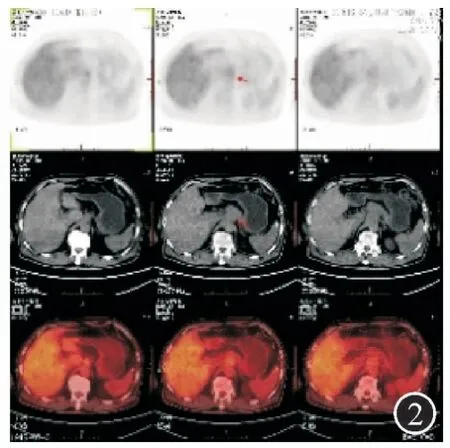
图2 PET-CT:食管癌,上下径约2 cm;腹腔干周围软组织病灶,代谢仅轻度增高,建议密切随访观察,以除外淋巴结转移;
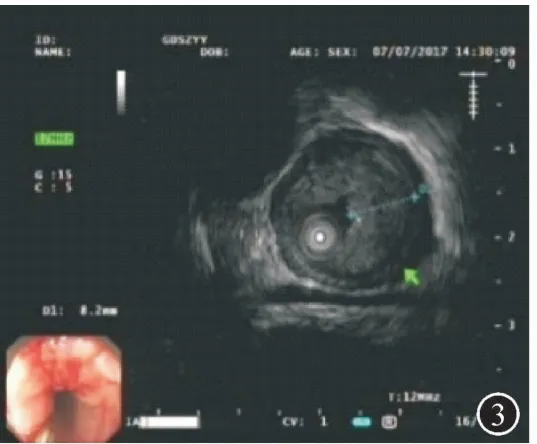
图3 超声胃镜:以12 MHz探查,食管管壁增厚,厚约12.5 mm,以黏膜层至黏膜下层增厚为主,厚约8.2 mm,呈低回声,回声尚均匀,肿瘤侵犯至黏膜下层(T1b);
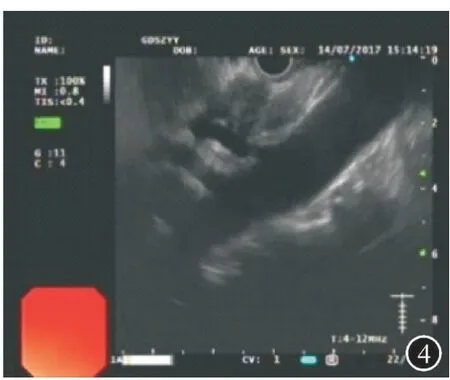
图4 纵轴超声胃镜:腹腔干淋巴结肿大,融合,范围约20 mm×18 mm,呈低回声,边界欠清晰,包绕血管;
因此,该患者若无淋巴结转移,可进行食管癌的外科手术切除。若有远处淋巴结转移,则需先行新辅助放化疗。术前新辅助治疗是近年来进展期食管癌治疗领域的研究热点,与术后辅助治疗比较,术前新辅助治疗有以下优点:①患者对术前新辅助治疗的耐受能力更强;②术前患者有良好的血运和氧供,放化疗的敏感性更佳;③它能够消灭早期的亚临床灶和微转移灶,并能缩小病灶,降低手术难度,提高镜下无残留切除率;④在有实体瘤的情况下,可进行个体化的放化疗敏感性评估[9]。
目前多采用增强CT和PET-CT检查作为术前评估的重要手段,然而常常难以满足临床术前精准评估要求[10]。本病例超声胃镜引导下穿刺是最佳选择。穿刺为获得更好的阳性结果,建议最好采取ROSE,即快速现场评价(细胞学)[11],但是ROSE现场需要玻片、染色剂和显微镜,需要细胞学技术来制片,以及细胞病理医师阅片,成本高,一般医院没有这个条件。此时便可采用MOSE,即现场肉眼评价(总体样本)。MOSE无需细胞学技术,现场无需染色剂和显微镜,无需细胞病理医师,仅通过判断样本组织的合适度,便可提高准确率[12]。本病例取样中有肉眼可见的白色组织条,且长度大于4 mm,因此得到了阳性的病理结果。
腹腔干淋巴结转移属于远处转移,越来越多的证据显示新辅助放化疗或新辅助化疗联合手术较单纯手术治疗能明显改善进展期食管癌患者的生存。此外,学者一般认为手术时机应在新辅助治疗结束后的2~8周内进行。总之,应用超声胃镜引导下穿刺判定食管癌腹腔淋巴结转移对治疗决策及预后的影响意义重大。EUS-FNA是有效的诊断方法,具有创伤小,准确性高的优势,结合弹性成像、细胞学、及组织学等常可使患者得到精确诊断,避免了不必要的手术。
