加味参苓白术散联合合生元用于肠内营养对胃肠手术后大鼠肠黏膜屏障修复作用研究
2019-07-25刘钰刘丽郑景辉何泽生秦伟夫牙韩威
刘钰,刘丽,郑景辉,何泽生,秦伟夫,牙韩威
肠道黏膜屏障发挥重要生理功能,受到损伤时可继发肠道菌群移位,增加感染风险。研究发现,肠内营养不仅可提供营养,还可在一定程度上改善肠黏膜屏障功能,成为临床常用营养方式[1]。外科创伤应激是目前造成肠道功能障碍的主要原因,其中肠黏膜屏障是受损最早、最重的区域[2]。合生元(Synbiotics)是益生菌与益生元的联合,可改善人体肠道微生态,并促进益生菌生长,保护肠黏膜屏障[3]。黄玉珍[4]的研究表明,参苓白术散有益于减轻模型大鼠肠黏膜损伤,降低肠黏膜通透性,修复及保护肠黏膜屏障,但在肠内营养中的应用研究则鲜有报道。本研究以40只SD大鼠进行实验,观察加味参苓白术散与合生元联合应用肠内营养对胃肠手术后大鼠肠黏膜屏障受损保护作用,现报道如下。
1 材料与方法
1.1 实验材料
清洁级健康成年雄性SD大鼠40只,体重200~250 g(由北京维通利华公司提供)。大鼠胃造口管、10 mL无菌小瓶、高温高压灭菌锅、细菌鉴定系统(API20A、API20E)、高效液相色谱仪、内毒素检测试剂盒。
1.2 实验试剂
戊巴比妥钠溶液(购自上海榕柏生物技术有限公司)、阿莫西林(购自昆明贝克诺顿制药有限公司)、甲硝唑(购自北京太洋药业有限公司)、生理盐水。
1.3 方法
1.3.1 模型制备 饲养温度24℃左右,湿度50%~70%,每天光照12 h,统一喂养3 d。SD大鼠空腹过夜后,用1 mL注射器将戊巴比妥钠溶液注入腹腔(剂量50 mg/kg),等待大鼠角膜反射消失。寻找大鼠颈根部第7颈椎棘突,标记,并以此为中心以1.5 cm为半径备皮。大鼠仰卧位固定好,备皮。常规消毒铺巾,以剑突下1 cm处为起点,沿腹正中线向下作2 cm切口切开。用长止血钳由切口处皮下与左侧分离皮下隧道至第7颈椎棘突处,消毒该处皮肤后切开,穿出长止血钳。将针头的头皮针剪去做成胃造口管,用止血钳夹住头皮针,沿皮下隧道拉出至腹部皮下,结扎固定头皮针外口。于原切口处沿腹正中线切开腹部肌肉及腹膜,牵开腹壁,将盲肠提至切口处,用止血钳分离钳夹盲肠系膜,剪断后分别结扎。在距盲肠末端1.5 cm处用止血钳压榨,用丝线结扎,于结扎线远端约0.3 cm处切断盲肠,断端用络合碘消毒。在结扎线近段约0.5 cm处环绕肠壁缝浆肌层荷包,收紧荷包线,打结,还纳入腹腔。于左上方钝性分离腹壁肌层形成小孔,将皮下头皮针管穿过小孔进入腹腔。胃前壁缝浆肌层荷包,上下方各缝悬吊线连接造瘘管进入壁层腹膜,余约1.0 cm。在胃前壁荷包内剪约2 mm小口将造瘘管末端插入胃内。收紧悬吊线与荷包线,固定牢靠。植入造瘘管后将3 mL生理盐水注入大鼠腹腔,腹壁间断全层缝合。
1.3.2 肠内营养干预 术后大鼠停止自主进食,自由饮水。当天及术后第1天经胃造口管予阿莫西林50 mg、甲硝唑20 mg。将40只大鼠按随机数据表法分为两组,每组20只。联合组营养制剂:整蛋白含膳食纤维肠内营养(能全力)+双歧杆菌三联活菌(210 mg)+加味参苓白术散(3 mL)+生理盐水(0.8 mL)。加味参苓白术散成人用量为18 g/d,大鼠体重折算系数为6.25,故大鼠的加味参苓白术散用量为每天18 g/6.25=2.88 g≈3 g。加味参苓白术散水煎液按原方比例配置,经无菌蒸馏水浸泡2 h,常法煎煮2次,30 min/次,滤出药液,水浴浓缩至每mL药液含1 g生药。对照组营养制剂:整蛋白含膳食纤维肠内营养(能全力)+双歧杆菌三联活菌(210 mg)+生理盐水(0.8 mL)。两组均于术后连续予以5 d肠内营养。术后第6天测定乳果糖/甘露醇(L/M)值:用大鼠灌胃针予1.6 mL乳果糖/甘露醇制剂(含乳果糖0.4 g,甘露醇0.2 g),放入代谢笼,收集24 h尿液。留取10 mL保存于无菌小瓶中(-20℃)待测。
1.3.3 肠系膜淋巴结细菌移位率测定 术后第7天通过手术取结肠内容物梯度稀释测定革兰氏阴性菌浓度;取肝、肺、门脉血、肠系膜淋巴结测细菌移位率,具体方法如下:将组织标本研磨为匀浆,再吸取0.1 mL置于琼脂平板上(上海莼试生物技术有限公司提供,货号CS-P3093),涂布均匀后将琼脂平板放在暖箱中孵育48 h,以门脉血标本,菌落数≥1为阳性,肝、肺及肠系膜淋巴结标本以菌落数≥5为阳性。取起始段结肠测结肠黏膜厚度,测量方法:选取3~5个完整黏膜,采用Image proplus6.0光学显微镜(奥林巴斯公司提供)测定黏膜厚度,取平均值为最终结果。取门脉血测内毒素浓度:取血清液1~3 mL,3 000 r/min离心后,用一次性真空管冷冻保存。将100μL样品与50μL鲎试剂混匀,温水下反应25min后再依次加50μL鲎三肽、亚硝酸钠0.5 mL、氨基磺酸铵及萘乙二胺0.5 mL,混匀后利用分光光度计,在545 nm下,参照标准吸光度值计算内毒素浓度。
1.4 统计学方法
应用SPSS 19.0统计软件对研究数据进行处理。计量资料以¯±s表示,采用t检验;计数资料以n(%)表示,比较采用χ2检验,理论频数<5时采用连续校正χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 革兰氏阴性菌浓度、尿L/M值、内毒素浓度及结肠黏膜厚度
联合组肠内容物的革兰氏阴性菌浓度、尿L/M值与门脉血内毒素浓度显著低于对照组,结肠黏膜厚度显著高于对照组,差异均有统计学意义(P<0.01),见表1。
2.2 细菌移位率
联合组细菌总移位率为25.00%,显著低于对照组的60.00%,差异有统计学意义(P<0.05),见表2。
3 讨论
手术创伤及术后疼痛等因素均可造成术后肠黏膜屏障损害,而肠黏膜屏障是防止肠腔内细菌和内毒素移位的最大屏障,故胃肠手术后感染风险较高[5]。
表1 两组革兰氏阴性菌浓度、尿L/M值、内毒素浓度、结肠黏膜厚度的比较(¯±s)
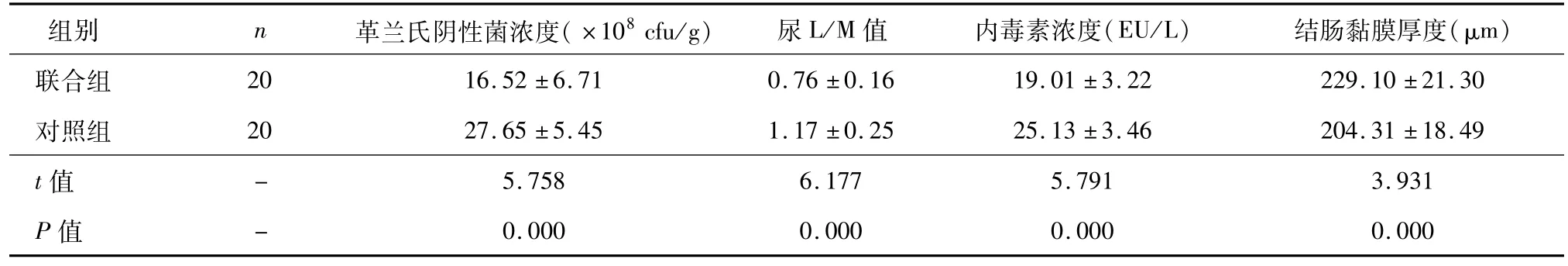
表1 两组革兰氏阴性菌浓度、尿L/M值、内毒素浓度、结肠黏膜厚度的比较(¯±s)
组别 n 革兰氏阴性菌浓度(×108 cfu/g)尿L/M值 内毒素浓度(EU/L)结肠黏膜厚度(μm)联合组 20 16.52±6.71 0.76±0.16 19.01±3.22 229.10±21.30对照组 20 27.65±5.45 1.17±0.25 25.13±3.46 204.31±18.49 t值5.758 6.177 5.791 3.931 P值--0.000 0.000 0.000 0.000

表2 两组细菌移位率的比较[n(%)]
合生元是益生菌和益生元的联合制剂,可改善肠内菌群结构,有益肠道健康[6]。证据表明[7],合生元应用肠内营养在减少肠源性感染方面具有良好效果。本研究联合组肠内营养在合生元基础上联合加味参苓白术,结果显示加味参苓白术散在改善结肠菌落构成、减少细菌移位、修复结肠生物屏障方面均发挥积极作用。加味参苓白术散中人参、茯苓、白术、甘草益气健脾、和胃渗湿为君;配伍山药、莲子肉助君药健脾益气、兼以止泻;白扁豆、薏苡仁可助白术、茯苓健脾渗湿,为臣药;砂仁醒脾和胃、行气化滞,为佐药;桔梗宣肺利气、载药上行,为使药。诸药合用,补中气、渗湿浊、化气滞[8-10],改善胃肠动力,修复胃肠黏膜屏障。
革兰氏阴性菌为肠道感染的主要菌种之一,内毒素则由革兰氏阴性菌外膜成分形成[11]。联合组肠内容物的革兰氏阴性菌浓度与门脉血内毒素浓度均相对更低,考虑与加味参苓白术散的抗菌、杀菌作用有关。现代药理学研究证实,茯苓、砂仁可有效抗菌、抗氧化[12-13];白术、甘草具有抑菌作用[14-15]。
L/M是反映肠黏膜屏障功能的主要指标之一,乳果糖与甘露醇均经小肠吸收,不被人体代谢,以原型经小便排出体外[16-17]。其中甘露醇为小分子单糖,多经肠黏膜细胞膜上的水溶性微孔透过肠黏膜;乳果糖为大分子双糖,多经肠黏膜细胞间透过肠黏膜[18]。而细菌与其毒素通过肠黏膜的途径与乳果糖相同,故当肠黏膜屏障功能损伤时,肠黏膜萎缩,吸收面积减少,甘露醇通过减少,同时细胞间缝隙变大,乳果糖通过增加,使L/M值升高[19-20]。L/M值越大,肠黏膜屏障损伤越严重。联合组术后第7天的L/M值低于对照组,表明该组肠黏膜屏障修复更佳,屏障功能更佳。结肠黏膜厚度与肠黏膜功能有关,肠黏膜功能受损时,会造成肠黏膜萎缩,使结肠黏膜厚度减小,而随着肠黏膜屏障功能的修复,肠黏膜厚度会逐渐恢复[21-22]。
肠黏膜有3道屏障,包括第1道机械屏障、第2道生态屏障与第3道免疫屏障[23]。肠黏膜功能受损时,肠黏膜屏障损伤或萎缩,免疫防御功能减弱,肠道菌群失调使细菌过度增生[24-25],上述多种机制使细菌移位,增加机体感染风险,故细菌移位是胃肠手术患者肠黏膜屏障遭到破坏的直接后果[26]。联合组细菌总移位率为25.00%,显著低于60.00%,说明患者经过5 d的肠内营养干预后,肠黏膜屏障功能获得修复,细菌移位随之减少。
综上所述,加味参苓白术散与合生元联合用于肠内营养可有效抑制结肠内革兰氏阴性菌、修复并保护肠黏膜屏障功能,使肠黏膜厚度增加、肠道细菌移位减少,L/M值降低。
