虎杖提取物血脂调节作用及其机制研究
2019-07-24赵圣剑田香霞
赵圣剑,田香霞
(河南中医药大学第三附属医院,河南 郑州 450008)
近年来,随着经济社会发展,人们生活水平提高及生活习惯改善,高脂血症的发生率逐年增加,并呈年轻化趋势,高脂血症与其他心脑血管风险因素相互作用,易导致动脉粥样硬化,增加心脑血管发病率和死亡率[1]。西药虽有很好的降血脂疗效,但会引起胃肠道、肝肾损害等毒副作用[1]。中医认为,血脂异常与肝、脾、肾最为密切,以脾肾虚弱为本,以痰浊、血瘀、气滞为标;在中医理论的指导下,近年来,中药已广泛应用于高血脂症的治疗,具有疗效好、副作用小等优点[2]。虎杖(PolygonumcuspidatumSieb.et Zucc.)是蓼科蓼属Polgohum L.多年生灌木状草本植物,以干燥茎和根入药,味微苦、性寒,归肝、胆、肺经;现代药理研究证实,虎杖提取物具有多种药理作用,包括抗炎、调血脂、抗血栓、抗氧化等[3]。虎杖苷是从虎杖根茎中提取的单体,是白藜芦醇与葡萄糖结合的产物,具有与白藜芦醇相似的药理作用[4],目前关于虎杖苷的降脂作用研究较少,为了明确虎杖提取物中对调血脂作用的效果及机制,为临床合理应用提供依据,本文研究虎杖提取物对高血脂症大鼠的降血脂作用,并探讨其可能的机制,现报道如下。
1 材料
1.1 药物与试剂
虎杖苷(西安药材公司,产地陕西);辛伐他汀(杭州默沙东制药有限公司);胆固醇、胆酸钠均购自湖北鸿运隆生物科技有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、氧化低密度脂蛋白胆固醇(oxygen low density lipoprotein cholesterol,ox-LDL-C)测定试剂盒均购自上海生工生物工程有限公司;过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)、一氧化氮(nitric oxide,NO)试剂盒均购自南京建成生物工程研究所;肉碱软脂酰基转移酶-I(carnitine palmitoyltransferase-I,CPT-Ⅰ)、肉碱软脂酰基转移酶-Ⅱ(carnitine palmitoyltransferase-Ⅱ,CPT-Ⅱ)、乙酰CoA羧化酶(acetylcoa carboxylase,ACC)、脂肪酸合成酶(fatty acid synthase,FAS)定量检测试剂盒购自上海江莱生物技术有限公司。
1.2 主要仪器
J-25型高速冷冻离心机(美国贝克曼公司);7100型全自动生化分析仪(日本日立公司);S-10高速分散器(宁波新芝生物科技有限公司);CX21FSIC型显微镜(奥林巴斯公司)。
1.3 实验动物
雄性SD大鼠48只,体质量200~250 g,购自河北省实验动物中心,许可证号SCXK(冀)2003-1-003。适应性喂养1周,喂养环境:温度25℃±5℃,相对湿度50%,12 h昼夜交替。
2 方法
2.1 动物分组及模型建立
所有大鼠均经适应性喂养1周后,随机分为空白对照组、模型对照组、阳性对照组、虎杖提取物组,每组各12只,其中空白对照组大鼠继续喂养普通饲料,其他组大鼠喂养高脂饲料,连续喂养4周后,眼眶取血,3 500 r/min离心15 min,分离得血清,按照试剂盒说明书测定TC和TG,TC和TG升高说明造模成功[5]。从第5周开始阳性对照组大鼠灌胃给予辛伐他汀6 mg/(kg·d),虎杖提取物组大鼠灌胃给予虎杖苷100 mg/(kg·d),空白对照组、模型组大鼠灌胃给予蒸馏水,1次/d,连续给药4周。
2.2 指标测定
2.3.1 血脂水平测定
连续给药4周后,眼眶取血,室温静置30 min后,3 500 r/min离心15 min,分离得血清,按照试剂盒说明书操作,采用全自动生化分析仪测定TG、TC、HDL-C、LDL-C、氧化低密度脂蛋白(ox-LDL)。
2.3.2 脂质过氧化指标测定
连续给药4周后,眼眶取血,室温静置30 min后,3 500 r/min离心15 min,分离得血清,按照试剂盒说明书操作,测定一氧化氮(NO)、丙二醛(MDA)浓度,及过氧化氢酶(CAT)、过氧化物歧化酶(SOD)活性。
2.3.3 脂质代谢酶测定
取大鼠肝脏0.1 g,加10倍的4℃缓冲液冰浴匀浆,制成10%匀浆液,4℃下2 000 r/min离心10 min,分离得上清液,-20℃保存待测。按照试剂盒说明书操作,测定CPT-I、CPTII、ACC和FAS水平。
2.3.4 组织形态学及脂联素受体2(adipo R2)免疫组化观察
连续给药4周后,处死大鼠。取大鼠部分肝脏,以4%多聚甲醛液固定,经梯度乙醇脱水,每次30 min,二甲苯透明、石蜡包埋,切成5 μm薄片,45℃烘干,二甲苯脱去石蜡,梯度乙醇(100%、95%、80%、75%)浸泡,每次5 min,蒸馏水浸泡3 min,HE染色10 min,无水乙醇脱水,二甲苯透明,滴加中性树脂,盖上盖玻片封片,光镜下观察,选取不同的视野,观察并拍照。
另取剩余大鼠肝脏制作石蜡切片,石蜡切片置于67℃烘箱中,烘片2 h,脱蜡至水,用pH7.4的PBS冲洗3次,每次3 min。取一定量pH6.0的柠檬酸盐缓冲液,加入微波盒中,微波加热至沸腾,将脱蜡水化后的组织切片置于耐高温塑料切片架上,放入已沸腾的缓冲液中,中档微波处理10 min,取出微波盒流水自然泠却,从缓冲液中取出玻片,先用蒸馏水冲洗两次,之后用PBS冲洗2次,每次3 min。 每张切片加1滴3%过氧化氢溶液,室温下孵育10 min,以阻断内源性过氧化物酶的活性。PBS冲洗3次,每次3 min。最后在显微镜下读片,拍照。
2.3.5 adipo R2 mRNA与PPARα mRNA测定
取肝脏组织0.6 g,采用总RNA提取试剂盒提取肝脏组织总RNA,NAase 37℃消化5 min,反转录试剂盒进行总RNA的反转录,获取得cDNA,荧光定量PCR检测RNA水平的表达,本研究用到的PPARα mRNA及adipo R2 mRNA的引物序列见表1。内参为β-actin。定量PCR检测adipo R2 mRNA及PPARα mRNA的反应条件在94℃ 1 min,95℃ 10 s,55℃ 10 s,72℃ 10 s(40个循环)下进行。adipo R2、PPARα序列及引物均有上海江莱生物技术有限公司购买合成。
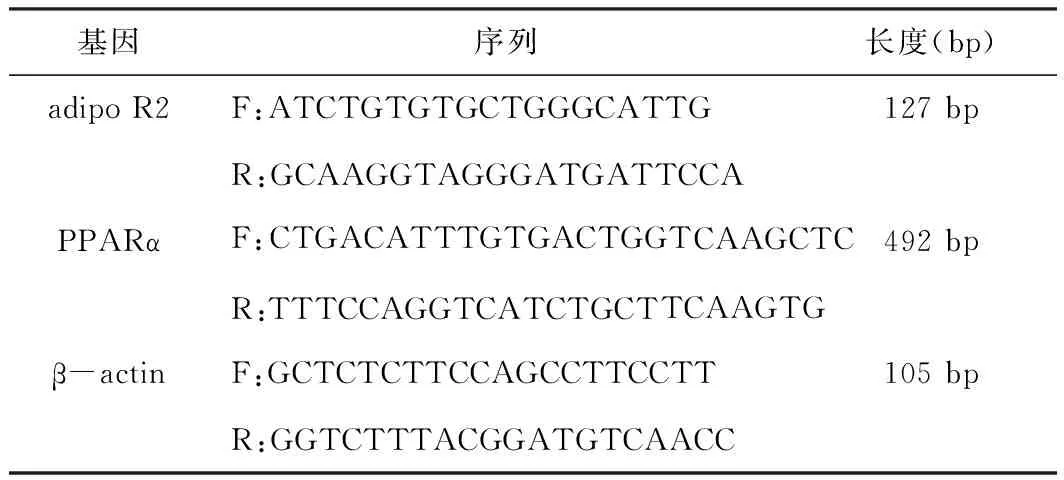
表1 adipo R2及PPARα引物信息
2.4 统计学分析
3 结果
3.1 血脂水平
与空白对照比较,模型对照组的TC、TG、LDL-C、ox-LDL表达水平显著升高(P<0.05),HDL-C表达水平显著降低(P<0.05)。与模型对照组比较,虎杖苷组和阳性对照组TC、TG、LDL-C、ox-LDL表达水平显著降低(P<0.05),HDL-C表达水平显著升高(P<0.05),虎杖苷组与阳性对照组无显著性差异(P>0.05)。见表2。
3.2 组织学形态
正常对照组大鼠肝脏被膜光滑,无病变迹象,呈深红色,质韧有弹性。模型对照组大鼠肝脏体积较大,表面暗淡,边缘较圆钝,呈弥漫性淡粉红色,质软。阳性组和虎杖苷组无明显差异。光镜检查可知,正常对照组大鼠肝细胞呈规则六边形,索状分布,胞质均匀,胞核清晰细胞间分界清楚,无病变,无脂肪滴和炎性浸润。模型对照组大鼠肝脏轻微病变,部分细胞呈不规则,肝组织中存在较多脂肪滴。阳性对照组和虎杖苷组大鼠的肝脏脂肪变性程度均轻于模型组,虎杖苷组病变最轻。见图1。
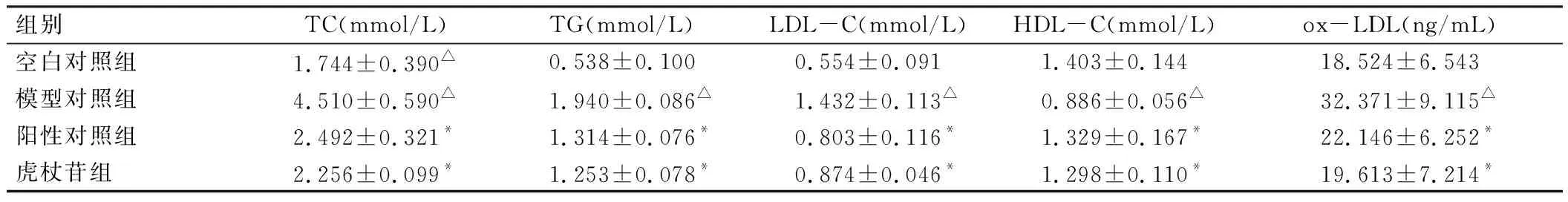
组别TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)ox-LDL(ng/mL)空白对照组1.744±0.390△0.538±0.1000.554±0.0911.403±0.14418.524±6.543模型对照组4.510±0.590△1.940±0.086△1.432±0.113△0.886±0.056△32.371±9.115△阳性对照组2.492±0.321*1.314±0.076*0.803±0.116*1.329±0.167*22.146±6.252*虎杖苷组2.256±0.099*1.253±0.078*0.874±0.046*1.298±0.110*19.613±7.214*
注:与空白对照组相比,△P<0.05;与模型组相比,*P<0.05
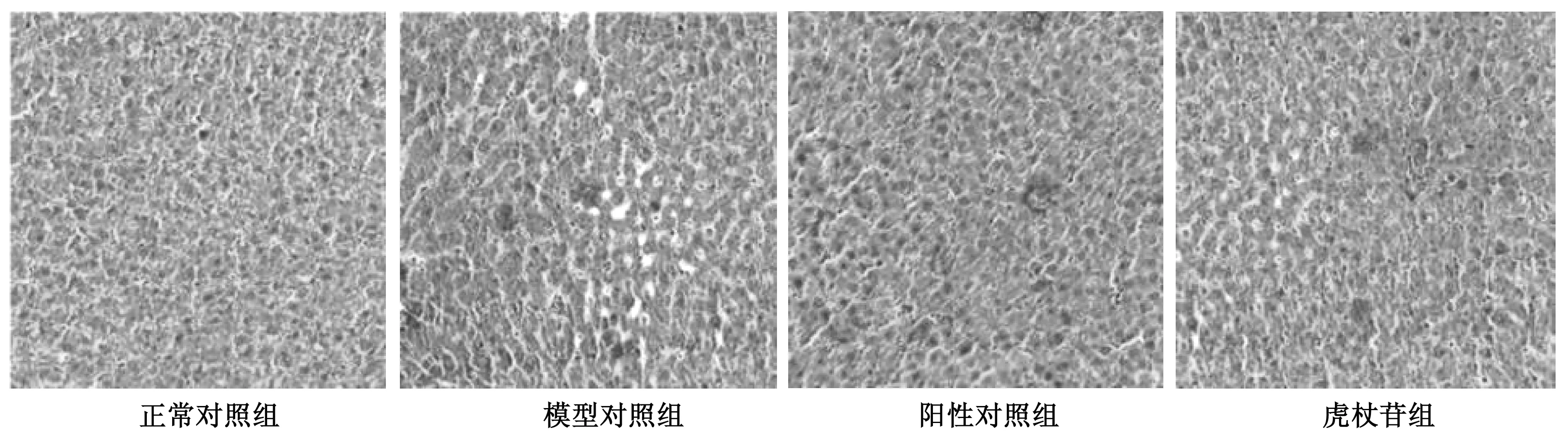
图1 各组大鼠肝脏组织学形态图片(×400)
3.3 脂质过氧化酶水平对比
与空白对照组相比,模型对照组大鼠血清中CAT、SOD的活性明显降低(P<0.05),NO水平显著降低(P<0.05),MDA的含量显著升高(P<0.05)。与模型对照组相比,阳性对照组和虎杖苷组大鼠血清中CAT、SOD活性显著升高(P<0.05),NO水平显著升高(P<0.05),MDA活性显著降低(P<0.05),且虎杖苷组较阳性对照组改善明显(P<0.05)。见表3。
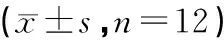
表3 各组脂质过氧化指标结果比较
注:与空白对照组相比,△P<0.05;与模型组相比,*P<0.05;与阳性对照组相比,☆P<0.05
3.4 肝脏脂质代谢酶水平对比
与空白对照组相比,模型对照组大鼠血清中CPI-I、CPI-II、FAS和ACC表达水平显著升高(P<0.05),HMGR表达水平显著降低(P<0.05)。与模型对照组相比,阳性对照组和虎杖苷组大鼠血清中CPI-I、CPI-II、FAS和ACC表达均显著降低(P<0.05),HMGR表达水平显著升高(P<0.05),且虎杖苷组较阳性对照组改善明显(P<0.05)。见表4。
3.5 adipo R2和PPARα mRNA水平对比及adipo R2免疫组化信息
与模型对照组相比,阳性对照组和虎杖苷组大鼠肝组织中adipo R2 mRNA水平显著提升(P>0.05),与阳性对照组相比,虎杖苷组大鼠肝组织中PPARαmRNA表达水平均显著升高(P<0.05),见表5。对比空白对照组、阳性对照组以及虎杖苷组adipo R2免疫组化结果,adipo R2均有广泛表达。

组别CPI-I(pg/mL)CPI-II(pg/mL)FAS(pg/mL)ACC(U/mL)HMGR(pg/mL)空白对照组96.34±1.7893.10±1.9865.99±2.2790.01±2.1975.31±3.16模型对照组145.71±1.23△140.00±2.29△87.63±3.17△145.20±1.51△97.26±5.25△阳性对照组128.59±1.60*119.06±1.54*76.36±2.45*128.69±1.31*87.65±3.54*虎杖提取无组105.43±1.23*☆102.32±1.25*☆69.35±1.52*☆105.38±1.47*☆80.26±2.37*☆
注:与空白对照组相比,△P<0.05;与模型组相比,*P<0.05;与阳性对照组相比,☆P<0.05
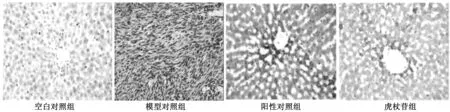
图2 三组adipo R2免疫组化图片(×400)

表5 各组adipo R2 mRNA与PPARα mRNA水平结果比较
注:与空白对照组相比,△P<0.05;与模型组相比,*P<0.05;与阳性对照组相比,☆P<0.05
4 讨论
脂类是人体结构和营养的重要物质,其在正常机体内的吸收和代谢维持着平衡状态。但随着人们生活水平提高、生活习惯改变,人们脂类物质的摄入增加,打破了脂质吸收和代谢平衡,导致高血脂症的发病人数逐渐增多。统计数据显示,我国成人高血脂症的患病率为20%,患病人数高达1.6亿人,不仅增加动脉粥样硬化的发生风险,同时也增加了高血压、糖尿病、冠心病等发病风险,增加心脑血管疾病的发病率和死亡率[6]。西药降血脂效果明显,但毒副作用较大,限制其长期的临床应用。因此,发掘祖国传统医药资源,寻找安全、疗效显著的调脂中药具有重要意义。
虽中医学中无高血脂概念,但可用中医血、津、液概括,《灵枢·血络论》中“其血黑以浊”与高血脂症、高黏血症概念极为相近,形象地说明了气血津液代谢失调,破坏“阴平阳秘”动态平衡,以致痰瘀胶结于血脉中的状况[7]。历代医家认为,嗜食肥甘厚味为标,脾肾运化失职为本,二者致气机阻滞,痰瘀内聚,膏脂不归正化,血脂异常多与肝、脾、肾三脏最为密切,以脾肾亏虚、肝失调达为本,以痰浊、血瘀、气滞为标,因此,对该病的治疗主张以调节肝肾亏虚为主[8-9]。虎杖味微苦、性寒,归肝、胆、肺经,广泛应用于心血管疾病的治疗,如虎杖降脂颗粒、血脂宁等方中均含有虎杖,在降血脂方面取得了一定疗效,但关于其主要降脂活性物质及机制的研究较少,虎杖苷是虎杖的主要成分,是白藜芦醇与葡萄糖结合的产物,又称为白藜芦醇苷,而白藜芦醇抗脂质过氧化、降血脂、保护血管等药理作用已被证实。
本文通过喂养高脂饲料建立大鼠高脂血症模型,灌胃给予虎杖苷治疗,结果显示:虎杖苷可以显著降低高脂症大鼠血清中的TC、TG、LDL-C和ox-LDL水平,提高HDL-C水平,提高adipo R2与PPARα表达水平,减小LDL-C/HDL-C比值。血清中TC、TG、LDL-C、HDL-C水平是血脂变化的重要监测指标,TC和TG过高时会导致高胆固醇血症,LDL-C和ox-LDL是导致动脉粥样硬化性脂蛋白,其水平升高会导致心脑血管疾病;HDL-C主要功能是将肝外组织中过多的胆固醇转运到肝脏代谢,减少组织中胆固醇的聚集,可竞争性抑制LDL与内皮细胞受体结合,具有防止动脉粥样硬化、降低冠心病病死率的作用[10-11],adipo R2为脂联素的受体,脂联素是脂肪细胞分泌的一种内源性生物活性多肽或蛋白质,能预示II型糖尿病和冠心病等的发展。组织学观察发现,虎杖苷组大鼠肝脏脂肪变性程度较模型对照组均显著改善,同时免疫组化结果显示虎杖苷组adipo R2表达程度与空白对照相近,较阳性对照组有很大提高,上述结果说明虎杖苷可以有效降低高脂血症大鼠血脂水平,改善肝脏脂肪变性程度。
本文在研究虎杖苷调节血脂机制过程中发现,虎杖苷可以有效提高高脂血症大鼠血清CAT、MDA和NO水平,下调SOD水平。CAT、MDA、SOD和NO是机体氧化应激的重要因子,氧化应激能够引起细胞膜脂质过氧化,产生丙二醇和β-羟化壬烯,水解B-100,抑制TG向LDL-C转变,抑制肝脏向外输送脂肪酸,造成脂肪堆积[12-13]。CAT主要是催化体内的过氧化氢,使细胞免受过氧化氢的损伤,其水平降低提示机体清除过氧化氢能力降低,增加了细胞被过氧化氢损伤的风险;MDA是脂质代谢的一个最终产物,产生的自由基能够严重的破坏肝细胞膜的结构,导致肝细胞发生肿胀、坏死。SOD能够清除超氧阴离子自由基,减轻和阻断脂质过氧化,对肝细胞有保护作用[14]。上述结果说明虎杖苷可以有效纠正高脂血症大鼠的氧化应激状态,减少脂质过氧化,防止脂肪堆积。
CPT-I、CPI-II是脂肪代谢的限速酶,CPI-I的活性受丙二酰辅酶A调控,是脂肪酸吸收的限速因素[15]。研究表明CPT-I与机体脂肪沉积有一定关系,其表达水平升高有助于增加脂肪酸分解并降低体脂肪的含量[16]。FAS和ACC是肝脏组织脂肪酸合成过程中重要酶,ACC催化乙酰辅酶A羧化成丙二醛辅酶A,FAS催化乙酰辅酶A及丙二醛辅酶A合成长链脂肪酸[17]。本研究发现,虎杖苷可以上调高脂血症大鼠肝脏CPT-I和CPI-II的表达水平,下调FAS和ACC酶水平,说明虎杖苷一方面减少脂肪酸合成,另一方面能促进脂肪氧化分解,从而减少脂肪积累。HMGR是体内催化胆固醇合成的关键酶,通过调节HMGR的活性,可以调节血脂水平[18]。在本次试验中,与对照组相比,各组大鼠肝脏HMGR的表达水平均有下降。与高脂对照组相比,各个剂量组大鼠肝脏HMGR的表达水平均显著降低,说明丹参素对高脂血症大鼠肝脏HMGR的表达有进一步地抑制作用,从而减少胆固醇的合成。adipo R2与PPARα都为体内调节脂联素代谢水平的重要受体,且均与脂联素水平为正相关,结合研究结果虎杖苷可以在基因层面调节受体表达,从而调节降低血脂水平。
综上,虎杖苷可以有效降低高脂血症大鼠的血脂水平,改善肝脏脂肪病变,其机制可能与减少脂肪酸和胆固醇合成,纠正高脂血症大鼠氧化应激状态,从而减少脂质过氧化,防止脂肪堆积。大鼠血浆胆固醇的主要载体为HDL,约占血浆脂蛋白的80%,而人血浆胆固醇的主要载体是LDL,约占血浆脂蛋白的60%,但大鼠具有成本低、易饲养、模型稳定等优点,且大鼠在胆固醇合成、代谢及对膳食胆固醇负荷的反应等方面更接近人类[19]。因此,本文选用大鼠建立高脂血症模型,实验结果具有一定的科学性。
