拟南芥生物钟双突变体lhycca1营养生长时相转变
2019-07-23傅钰王苓龙鸿
傅钰 王苓 龙鸿


摘 要 高等植物生长发育阶段可分为营养生长和生殖生长2个阶段,其中营养生长阶段中只有通过营养生长时相转变方可进入生殖生长阶段。营养生长时相转变(vegetative phase change,VPC)是植物从幼龄期(juvenile stage)到成熟期(adult phase)的转变,受到基因表达的调控。生物钟(circadian clock)相关基因LHY和CCA1单独作用延迟VPC的发生,这2个基因的共同作用下VPC是否受到影响尚未见报道。本研究以拟南芥(Arabidopsis thaliana)为研究对象,通过形态和茎尖分生组织(shoot apical meristem,SAM)解剖结构观察及调控因子miR156和靶基因SPL3的表达变化,分析LHY和CCA1 2个基因在VPC过程中的作用。结果表明:双突变体lhycca1生长周期为15 d,莲座叶第5片时(第10天)出现远轴面表皮毛,此时叶基角和叶长宽比增大且茎尖分生组织凸起明显,miR156和SPL3的表达水平在植物生长发育阶段呈负相关变化。而野生型生长周期为20 d,莲座叶第6片(第15天)时才出现远轴面表皮毛、叶长宽、叶基角、SAM、miR156和SPL3的变化。这些结果说明在LHY和CCA1的共同作用下,VPC提前发生,LHY和CCA1 2个基因参与VPC的调控。
关键词 营养生长时相转变;lhycca1;生物钟;拟南芥
中图分类号 Q945 文献标识码 A
Abstract Developmental phase of higher plant is composed of two stages: vegetative growth and reproductive growth. Only after the phase transition through vegetative growth does plant go through further reproductive growth. The transition from the juvenile stage to the adult phase in plants is termed vegetative phase change (VPC), which is regulated by genes. Circadian clock-related genes LHY and CCA1 delay the occurrence of VPC by oneself, but the combined effects of these genes on VPC are not clear. Here, a double mutant lhycca1 of Arabidopsis thaliana was used to investigate the characters of VPC through the observation of plant morphology and anatomical structure of shoot tip meristem (shoot apical meristem, SAM). The expression of molecular regulatory factor miR156 and its target gene SPL3 in VPC were also analyzed. Our results showed that the growth cycle of the lhycca1 double mutant lasted for 15 d. The onset of abaxial trichomes was on the fifth rosette leaf (the 10th day). Meanwhile, the base angle and the length: width ratio of leaves increased dramatically, and the shoot tip meristem bulged obviously. During growth and development, the expression levels of miR156 and SPL3 was negatively correlated. By contrast, the growth cycle of the wild-type was about 20 d, with the changes of the abaxial trichomes, length: width ratio of leaves, leaf base angle, SAM, miR156 and SPL3 on the sixth rosette leaf (the 15th day). These results indicated that VPC in the lhycca1 double mutant occurred in advance under the combined effects of the two genes. LHY and CCA1 genes regulated VPC to some extent.
Keywords vegetative phase change; lhycca1; circadian clock; Arabidopsis thaliana
DOI 10.3969/j.issn.1000-2561.2019.06.008
高等植物的生命周期經历一系列不同的生长发育阶段,其中会经历营养生长阶段和生殖生长阶段。大多数高等植物的营养生长和生殖生长阶段通常以花芽的分化作为界限,通常一年生植物(拟南芥)在此过渡阶段形态上变化较不明显[1]。其中营养生长阶段又分为幼龄期(juvenile stage)和成熟期(adult phase),从幼龄期到成熟期的转变称为营养生长时相转变(vegetative phase change,VPC)[2]。
一年生拟南芥通常作为研究VPC过程的模式植物,VPC过程会伴随其形态学、细胞学以及分子层面上的变化。形态学的研究已经表明,拟南芥植株幼年期叶片呈圆形,叶边缘光滑,只生长近轴面表皮毛;植株成熟期叶片呈匙形,叶边缘呈锯齿状,生长近轴面表皮毛和远轴面表皮毛,其发生VPC的标志即出现远轴面表皮毛[3-4]。而细胞学上的标志以茎尖分生组织(shoot apical meristem, SAM)生长锥从平坦到凸起的变化[5]。分子研究表明,小分子RNA—miR156,及SPLs(SQUAMOSA promoter binding protein-like)基因家族中的靶基因SPL3在VPC中起重要作用[6],miR156通过抑制SPLs基因家族中靶基因SPL3的表达进而实现自身表达,VPC的变化与miR156和SPL3表达水平的变化密切相关[7],且研究结果显示,在植物生长发育阶段,miR156幼龄期高水平表达,进入成熟期其表达量大幅度下降,而靶基因SPL3表达模式则与miR156相反[8-9],因而miR156通过对SPL3基因的表達来调节VPC。
VPC与植物自身生物钟密切相关。生物钟是生物体内周而复始的节律,常见为近似24 h的生物节律钟[10]。其中CIRCADIAN CLOCK ASSOCIATED 1 (CCA1),LATE ELONGATED HYPOCOTYL(LHY), 和TIMING OF CAB EXPRESSION 1 (TOC1)是拟南芥生物钟相关基因,且构成中央振荡器的3个核心组成部分[11-12],有研究发现,TOC1促进LHY和CCA1的表达,而LHY和CCA1的结合抑制TOC1的表达[13]。前期本课题组研究结果表明[14],生物钟相关基因LHY和CCA1单一缺失突变体均在第7片莲座叶(第16天)出现远轴面表皮毛、茎尖分生组织生长锥出现明显凸起以及发生miR156明显下降的结果,均说明生物钟相关基因LHY和CCA1单一突变体对VPC起延迟作用。那么,两基因共同缺失对VPC的影响值得进一步研究。本研究通过观察lhycca1双突变体植株生长发育各阶段的形态学变化、茎尖分生组织以及对miR156和SPL3的表达变化,探究了生物钟相关基因对拟南芥VPC的影响,为深入研究生物钟相关基因对VPC的调节机制提供依据。
1 材料与方法
1.1 材料
本研究所用的拟南芥(Arabidopsis thaliana)野生型(WT)种子由本实验室保存。
拟南芥生物钟相关基因双突变体lhycca1的种子购自美国俄亥俄州立大学种子中心库(Arab idopsis Biological Resource Center,ABRC)。
1.2 方法
1.2.1 种植 将在4 ℃低温处理3 d的种子均匀点种在湿润的人工土[蛭石与大汉土体积比=1∶1混合,高温(121 ℃,30 min)灭菌]表面,贴好标签,覆上具有透气孔的保鲜膜,放入人工培养室中,待子叶较大时揭膜。培养条件为22 ℃,16 h光照,20 ℃,8 h黑暗,相对湿度60 %,光照强度80~200 μmol/(cm2·s)。
1.2.2 形态学观察 观察野生型拟南芥及lhycca1双突变体的生长发育过程。记录其莲座叶叶片总数、最早出现远轴面表皮毛的叶片数及叶片形态变化趋势;植物抽薹后,将全部莲座叶摘取排列拍照,并使用DWRuler测量其叶片及叶柄之间形成的叶片基角。莲座叶片长与宽使用数显游标卡尺进行测量,叶片长为叶片顶端到叶柄与叶片连接处,叶片宽为叶片中最宽处,且用SPSS软件对叶片长宽比数据进行差异显著性分析。
1.2.3 石蜡切片的制作 拟南芥长出真叶时,根据李和平[15]的方法,取不同生长时期的野生型和双突变体的植株于FAA固定液中固定24 h以上,用爱氏苏木精整染3 d,梯度乙醇脱水,梯度二甲苯透明。浸蜡包埋后,用切片机LEICA RM2265切片,切片厚度9 ?m。中性树脂封片后,于正置显微镜Olympus BX53下观察,Spot Idea相机拍照,并保存。
1.2.4 荧光定量PCR对VPC相关基因进行分析 使用实时荧光定量PCR仪(BIO-RAD CFX96)和大连宝生物荧光定量试剂(SYBR Premix Ex TaqTMⅡ)进行检测。
在荧光定量PCR中,提取野生型和双突变体生长发育阶段各个时期的叶片组织中的RNA,且反转成cDNA作为样品模板,每个样品重复3次,以Actin-2为内参基因,对植株叶片中调控基因miR156和靶基因SPL3的表达进行分析检测。荧光定量PCR所用引物序列为:Actin-2-F: 5-GCTG
2 结果与分析
2.1 双突变体的叶形观察
观察野生型和lhycca1双突变体的叶形变化,进而了解双突变体对营养生长时相转变的影响特征。实验观察到,野生型和双突变体的第1对真叶分别出现在第7天和第6天,第2对真叶分别出现在第11天和第9天,第3对真叶分别出现在第15天和第13天。其中野生型在第20天时发生抽薹,但双突变体在第15天时已经出现抽薹。根据图2显示,野生型莲座叶叶片总数为15片,前5片叶形为近圆形,后期变为渐长的匙形(图1A),叶片宽度变小,叶型伸长,第6片(第15天)为远轴面表皮毛出现的叶序数;双突变体莲座叶总数为7片,其中前4片接近圆形,后期叶片逐渐变为渐长匙形(图1B),在第5片(第10天)叶片宽度开始变小,叶缘出现锯齿,且出现远轴面表皮毛。
结果表明,野生型和双突变体分别在第6片和第5片时发生VPC,双突变体的远轴面表皮毛和抽薹时间均早于野生型,说明双突变体VPC提前。
2.2 叶片基角的变化趋势
植物营养生长发育时期,观察葉片基角的变化,可观察VPC发生时间。测量与统计野生型和双突变体的叶片基角。双突变体第3、4、5片莲座叶叶基角分别为:111.35°、118.17°、128.83°,野生型第3、6、9片莲座叶叶片基角分别为
A:野生型莲座叶叶形;B:lhycca1双突变体莲座叶叶形。
106.38°、119.54°、127.34°。结果显示,双突变体的叶片基角均比野生型角度大,其中双突变体的叶基角在第5片明显增大,而野生型叶基角在第6片明显增大。说明双突变体VPC比野生型发生时间提前。
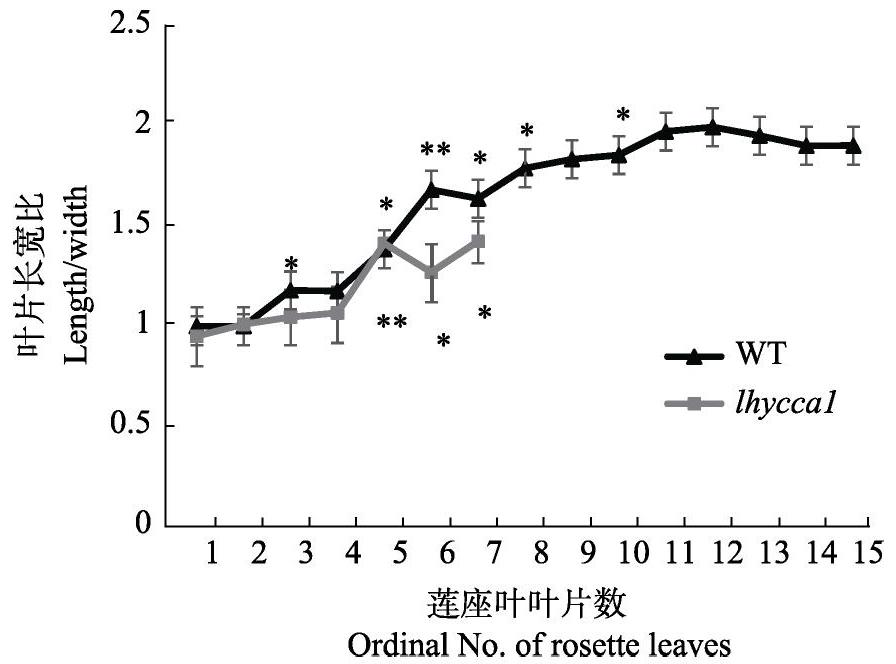
2.3 双突变体叶长宽比的变化
由图2可知,野生型和双突变体前2片叶近似圆形,长宽比比值接近于1,第3、4片叶长宽比略增大,但比值基本相同;而野生型和双突变体叶片长宽比随叶片数增多而逐渐增大,且分别在第6片和第5片叶长宽比比值相比前一片莲座叶极显著增大(P<0.01)。因此,根据叶长宽比分析,得到双突变体VPC提前。
2.4 茎尖分生组织石蜡切片
野生型植株生长第5天时(图3A),SAM解剖结构观察发现,叶原基已生成,SAM生长锥呈平坦状,原套区域细胞为单层(图3a);WT植株生长到第8天时(图3B),生长锥略有凸起,细胞为单层(图3b);第10天时(图3C),SAM与第8天相比凸起略有升高(图3c);第13天时(图3D),随植株进一步生长发育,茎尖分生组织细胞增多,同时具有单层和多层细胞,但未进入成熟期(图3d);第15天时(图3E),生长锥持续生长发育,凸起明显增高,具多层原套细胞,原体和髓分生组织细胞分裂,数量增多(图3e);第20天时,花芽出现(图3F),雄蕊原基出现(图3f)。双突变体lhycca1生长第5天(图3G)时,SAM生长锥也呈平坦状,细胞未分化(图3g);第10天(图3H)时,生长锥较野生型凸起明显,细胞分裂、增多(图3h);第13天(图3I)时,生长锥凸起十分明显,原套细胞为多层,原体和髓分生组织细胞均分裂、增多(图3i);第15天时,已出现花芽(图3J),出现典型的花原基(图3j)。根据野生型和双突变体茎尖分生组织生长锥明显凸起的时间对比发现,双突变体VPC提前,与形态上观察结果一致。
2.5 荧光定量PCR
在植株的生长发育过程中,野生型和双突变体植株的miR156表达水平均呈现下降的趋势,但双突变体在各个发育阶段的miR156表达量均比野生型低。从图4可以看出,野生型在第15天时的miR156的表达量显著低于第13天(P<0.05),说明野生型在此时发生VPC,而双突变体在第10天时相比于第8天时的miR156的表达量显著降低(P<0.05),说明双突变体在此时发生VPC。结果表明双突变体VPC发生的时间比野生型提前。对于SPL3的检测结果表明,随着植株的生长发育,野生型和双突变体的SPL3的表达水平均出现上升趋势,但野生型均比双突变体表达量高。从图5可以看出,野生型第15天的SPL3表达量显著高于第13天时的表达量(P<0.05),双突变体在第10天时的SPL3表达量显著高于第8天的表达量(P<0.05),说明野生型和双突变体VPC分别发生在第15天和第10天,与miR156所得出的结果一致,且与本研究中的其他结果一致。
3 讨论
高等植物生长发育经历营养生长和生殖生长,其中营养生长时期由幼龄期和成熟期组成,从幼龄期到成熟期过渡的重要转变时期为营养生长时相转变,经历这一阶段后,植株进入生殖生长[4]。如今对于营养生长时相转变的研究已有越来越多的学者关注,如Usami等[17]观察莲座叶叶形、远轴面表皮毛的出现等形态学和细胞学方面探究其VPC发生时间,因此在研究拟南芥VPC方面已有较为成熟的体系。前期本课题组[14]在单一生物节律钟相关基因缺失对VPC的影响已有研究,而对于两个生物节律钟相关基因共同缺失对营养生长时相转变体制的影响尚缺乏详尽的研究。
本实验通过研究双突变体lhycca1在形态学、细胞学以及基因表达3个方面,分析其对VPC的影响。结果表明,野生型和双突变体分别在莲座叶第6片(第15天)和莲座叶第5片(第10天)出现远轴面表皮毛等形态上的变化,与野生型相比,双突变体的VPC提前,而前期研究表明[14]各单一基因突变体均在莲座叶第7片(第16天)发生形态变化,VPC均被延迟。说明LHY和CCA1双基因突变造成植株VPC提前,单基因突变导致VPC发生延迟。为清楚了解野生型和双突变体VPC变化特征,通过SAM的观察得到,双突变体SAM的原套、原体及髓分生组织提前发育,而前期结果中[14]各单一突变体其SAM发育迟缓。说明LHY和CCA1共同作用下促进SAM的发育,从而造成VPC提前,但单基因作用下,SAM发育延缓,延迟VPC的发生。且VPC的变化伴随主要调控基因miR156及靶基因SPL3表达量的改变,从分子水平上证实双突变体VPC提前,而前期[14] 对各单一基因突变体进行miR156检测发现VPC均被延迟。以上对其分析结果表明,生物节律钟相关基因LHY和CCA1导致VPC发生变化,且两基因作用下使VPC提前,而单基因作用下VPC被延迟。
因此在前期研究发现缺失LHY或CCA1单一基因延迟VPC发生的基础上,进一步得到生物节律钟相关基因LHY和CCA1同时缺失会造成VPC提前,促进植株生长发育的进程,且仍能保持自身生物钟运转,说明生物节律钟相关基因LHY和CCA1参与调控VPC,是生物钟核心振荡器发挥调节作用的核心组成部分。据此可以推测生物节律钟相关基因LHY和CCA1在植株的生长发育过程中起重要调控作用。但其他生物节律钟基因的双重缺失是否会导致VPC以及生长发育的改变,还玆待研究。
参考文献
[1]Huijser P, Schmid M. The control of developmental phase transitions in plants[J]. Development, 2011, 138(19): 41.
[2]Poethig R S. The past, present, and future of vegetative phase change[J]. Plant Physiology, 2010, 154: 541-544.
[3]Telfer A, Bollman K M, Poethig R S. Phase change and the regulation of trichome distribution in Arabidopsis thaliana[J]. Development, 1997, 124: 645-654.
[4]Wu G, Park M Y, Conway S R, et al. The sequential action of miR156 and miR172 regulates developmental timing in Arabidopsis[J]. Cell, 2009, 138: 750-759.
[5]Jacqmard A, Gadisseur I, Bernier G. Cell division and morphological changes in the shoot apex of Arabidopsis thaliana during floral transition[J]. Annals of Botany, 2003, 91: 571-576.
[6]Yang L, Conway S R, Poethig R S. Vegetative phase change is mediated by a leaf-derived signal that represses the tran-
scription of miR156[J]. Development, 2011, 138(2): 245-249.
[7]Spanudakis E, Jackson S. The role of microRNAs in the control of flowering time[J]. Journal of Experimental Botany, 2014, 65(2): 365-380.
[8]Wu G, Park M Y, Conway S R, et al. The sequential action of miR156 and miR172 regulates developmental timing in Arabidopsis[J]. Cell, 2009, 138: 750-759.
[9]Gou J Y, Felippes Felipe F, Liu C J, et al. Negative regulation of anthocyanin biosynthesis in Arabidopsis by a miR156-Targeted SPL transcription factor[J]. Plant Cell, 2011, 23(4): 1512-1522.
[10]Tsuyoshi M, Kay W, Yoshie H, et al. LHY and CCA1 are partially redundant genes required to maintain circadian rhythms in Arabidopsis[J]. Developmental Cell, 2002, 2(5): 629-641.
[11]Schaffer R, Landgraf J, Accerbi M, et al. Microarray analysis of diurnal and circadian-regulated genes in Arabidopsis[J]. The Plant Cell, 2001, 13(1): 113-123.
[12]Gendron Joshua M, Pruneda-Paz José L, Doherty Colleen J, et al. Arabidopsis circadian clock protein, TOC1, is a DNA-binding transcription factor[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(8): 3167-3172.
[13]AlabadílabaOyama T, Yanovsky M J, et al. Reciprocal regulation between TOC1 and LHY/CCA1 within the Arabidopsis circadian clock[J]. Science, 2001, 293(5531): 880-883.
[14]郭 蕊. 擬南芥生物节律钟相关基因LHY、CCA1和GI对其营养生长时相转变的作用[D]. 天津: 天津农学院, 2017.
[15]李和平. 植物显微技术[M]. 2版. 北京: 科学出版社, 2009:12-14, 29, 32-33.
[16]卢 阳, 龙 鸿. 拟南芥叶片数目变化突变体对营养生长时相转变的影响[J]. 植物学报, 2015, 50(3): 331-337.
[17]Usami T, Horiguchi G, Yano S, et al. The more and smaller cells mutants of Arabidopsis thaliana identify novel roles for SQUAMOSA PROMOTER BINDING PROTEIN-LIKE genes in the control of heteroblasty[J]. Development, 2009, 136: 955-964
