扁舵鲣脂肪氧化分析及其对肌红蛋白氧化的影响
2019-07-23林森森1戴志远23
林森森1 戴志远23
1.浙江国际海运职业技术学院 浙江舟山 316021 2.浙江工商大学水产品加工研究所 浙江杭州 310035 3.浙江省水产品加工技术研究联合重点实验室 浙江杭州 310035
扁舵鲣属鲭科,是一种产量较高的低值金枪鱼,其肌红蛋白(Mb)和脂肪含量较高,在加工贮藏中容易发生颜色褐变和脂肪氧化。肌红蛋白氧化导致的不良气味、肉色褐变、有毒代谢加合物等结果是造成肉类品质下降的重要原因。
脂肪氧化是不饱和脂肪酸与氧分子发生的链式反应,在反应过程中会产生自由基、过氧化物(初级代谢产物)和各种次级代谢产物[1]。其中,次级代谢产物主要为一些醛类、醇类、酮类、环氧化合物等低分子量易挥发物质,常见的物质如己醛、丙醛、丙二醛(MAD)以及4-羟基壬烯醛(4-HNE)[2]。肌红蛋白氧化包括氧合氧化(Oxygen oxidation)和自动氧化(Autoxidation),后者是造成肉色褐变的主要原因。
近年来,不少研究证明脂肪氧化和肌红蛋白氧化存在密切关系[2]。在试管模型中,含高浓度不饱和脂肪酸的肌肉微粒体能有效促进氧合肌红蛋白(OxyMb)的氧化[3]。有研究指出脂肪氧化产生的一些代谢产物对肉类颜色的稳定性有影响,并有多种解释。O’Grady[4](2001)等认为脂质氧化先于Mb氧化,脂肪的初级代谢产物及自由基才能促进Mb(牛肉)的氧化,而次级代谢产物不具有这种能力。而在另外的研究中研究者提出了相反的结论[5]关于脂肪氧化代谢产物对肌红蛋白氧化影响的研究主要集中在禽畜肉类,代谢产物主要集中在MAD、4-HNE等醛类物质上[2]。
目前,针对扁舵鲣的研究较少,主要集中在生物学特性、组胺产生及肌肉组成营养成分上[7]。本研究针对扁舵鲣肌肉高脂肪、高肌红蛋白特点,拟对低温贮藏中扁舵鲣肌肉脂肪氧化产物进行分析,并探讨氧化产物对肌红蛋白氧化的影响,旨在为扁舵鲣在冷藏中肉色变化提供相关的研究支持。
1 材料与方法
1.1 材料、试剂与仪器
原料:扁舵鲣捕捞于浙江福建沿岸海域,捕捞后冻至-18℃以下,与冰块混合包装后运至实验室(约4h)。规格:250~330g/条,体长25~35cm。
试剂:甲醇、氯仿、氯化钠、浓盐酸,成都市科龙化工试剂有限公司;正己烷,国药集团化学试剂有限公司;三羟甲基氨基甲烷(Tris),生工生物工程(上海)股份有限公司;37种脂肪酸甲酯标样:Sigma-aldrich公司;MES(吗啉乙磺酸一水,≥99%)、脂肪氧化产物标准品(正己醛、正壬醛、苯甲醛、(E,E)-2,4-庚二烯醛、1-辛烯-3-醇、2-壬酮、2-乙基呋喃、乙醇),阿拉丁试剂(上海)有限公司。以上试剂除特别说明外均为分析纯;实验用水为超纯水。
仪器:BCD-251wbsv型冰箱,青岛海尔股份有限公司;DK-S24型电热恒温水浴锅,上海森信实验仪器有限公司;DSY-Ⅲ氮吹仪:北京金科精华苑科技有限公司;PC-6 Plus高速冷冻离心机,美国热电仪器有限公司;T18型高速均质机,德国IKA公司;Mili-Q超纯水机Gradient型,美国Milipore公司;Thermo Evolution 60S紫外可见分光光度计,美国赛默飞世尔公司;7890A型气相色谱仪(GC),美国安捷伦仪器公司。
GC-MS相关仪器:DVB/CAR/PDMS微萃取头(50μm/30μm),美国Supelco公司;TR-35MS毛细管柱(30m×0.25mm,0.25μm),美国赛默飞世尔公司;Thermo Trace DSQ II气质联用仪,美国赛默飞世尔公司。
肌红蛋白纯化中所涉及的相关仪器参见作者参与的另一篇文章[7],主要有:Biologic DuoFlow 10型层析系统、UNO Q-1阴离子交换柱、Gel P-6 脱盐柱,美国伯乐公司。
1.2 实验方法
鱼肉取样:鱼沿腹部切开,去头,去内脏,剔除鱼骨分离普通肌与暗色肌,置于冰上保存。
1.2.1 脂肪酸成分分析
(1)样品脂肪酸提取及甲酯化。
样品处理方法参考卢洁[8](2005)等,稍作修改。称取鱼肉5.00g,加入4mL甲醇和8mL氯仿后均质,充氮密封超声20min后离心15min(8 500r/min,4℃),固液分离后取液体的下层于60℃氮气吹干,加入5mL KOH-甲醇溶液(0.5mol/L),充氮密封后水浴20min(65℃)。液体冷却后加入2mL三氟化硼-甲醇溶液(14%),充氮密封后50℃水浴5min,超声10min,加入2mL正己烷后用饱和NaCl溶液淋洗上层,静置后取上层液体储存备用。
(2)气相色谱条件。
采用气相色谱进行样品分析,色谱柱为美国安捷伦仪器公司的HP-INNOWAX毛细管色谱柱(30m×0.25mm,0.15μm)。
进样量为1μl;载气为高纯N2;N2流速为0.65mL/min;分流比为200∶1。
进样口温度为250℃。
柱温升温程序:初温50℃,保持2min,以4℃/min升到220℃,并保持15min。
(3)脂肪酸定性、定量分析。
采用37种脂肪酸甲酯标准品进行定性分析,并采用面积归一化法进行定量分析,计算公式为:
其中Ai为单个脂肪酸的峰面积,∑Ai为所有出峰物质的面积总和。
1.2.2 GC-MS分析脂质氧化产物
扁舵鲣置于4℃贮藏,分别在第0、1、3、6、9、12天取样分析。
样品处理:取3.00g鱼肉于进样瓶,封口。
(1)SPME顶空萃取:样品瓶于60℃水浴5min;萃取温度为60℃,萃取40min;解析温度为250℃,解析6min。
(2)GC分析:进样口温度为250℃。升温程序:初温为35℃,保持3min,以3℃/min升到70℃,以10℃/min升到200℃,以15℃/min升到250℃,并保持10min。载气(He)流速:1mL/min,无分流进样模式。
(3)质谱条件:传输线温度250℃;检测器温度250℃;扫描范围33~500μ;扫描速率(amu/s)2 392.8;电离能70ev。
数据处理:通过NIST 2.0 Library标准谱库进行检索,当正反匹配度均大于800时予以定性,采用面积归一化法进行半定量分析。
1.2.3 Mb分离纯化及OxyMb制备
扁舵鲣肌红蛋白分离纯化方法及结果参见文献[7]。
主要过程:选取扁舵鲣暗色肌,用Tris-HCl缓冲液均质提取后,加入适量Na2SO4盐析,离心后取沉淀加入少量缓冲液溶解置于透析袋中(8 000~14 000Da),透析24h。透析液用UNO Q-1阴离子交换柱分离纯化后,进行冷冻干燥浓缩。取适量Mb溶液加入适量Na2S2O3粉末,离心后取上清液,用Gel P-6脱盐柱(pH 7.0 Tris-HCl缓冲液或pH 5.7MES缓冲液)脱盐,最后用相同缓冲液稀释成0.15mM、pH7.0和pH5.7的OxyMb溶液。
1.2.4 脂肪氧化产物对Mb的影响
实验方法参考Yaowapa T(2011)和Naveena B(2009)等[9,10]的方法,稍作修改。用pH 7.0的Tris-HCl溶液(10mM)分别将7种标准品(正己醛、正壬醛、苯甲醛、(E,E)-2,4-庚二烯醛、1-辛烯-3-醇、2-壬酮、2-乙基呋喃)和对照品(乙醇)配成浓度为1mM的溶液;用pH5.7的MES溶液(10mM)按上述操作将氧化产物标准品和对照品配成浓度为1mM的溶液。
将pH7.0与pH5.7的OxyMb溶液与同pH值的氧化产物溶液等体积混合,OxyMb与乙醇溶液的混合液作为对照组。将两组溶液置于2℃保存,pH7.0的样品于第0、1、3、5天取样进行光谱扫描,pH5.7的样品于第0、1、2天取样进行光谱扫描。将添加己醛的Mb溶液记为第1组,壬醛、苯甲醛、(E,E)-2,4-庚二烯醛、1-辛烯-3-醇、2-壬酮、2-乙基呋喃分别记为第2~7组,乙醇为第0组(对照组)。
MetMb%含量的计算:Mb衍生物百分含量测定方法参考Chotika等人针对金枪鱼Mb建立的计算方法[11],计算公式如下:
CMetMb=-0.10×A555-0.057×A540+0.150×A500
COxyMb=0.173×A555-0.109×A540-0.003×A500
CDeoMb=-0.116×A555+0.165×A540-0.052×A500
MetMb%=CMetMb/(CMetMb+COxyMb+CDeoMb)
OxyMb%=COxyMb/(CMetMb+COxyMb+CDeoMb)
DeoMb%=CDeoMb/(CMetMb+COxyMb+CDeoMb)
2 结果与分析
2.1 扁舵鲣脂肪酸组成分析
经测定,扁舵鲣暗色肌和普通肌的脂肪含量较高,分别为33.9mg/g和11.1mg/g。扁舵鲣脂肪酸的组成如表1所示。

表1 扁舵鲣普通肌和暗色肌的脂肪酸组成分析
续表1
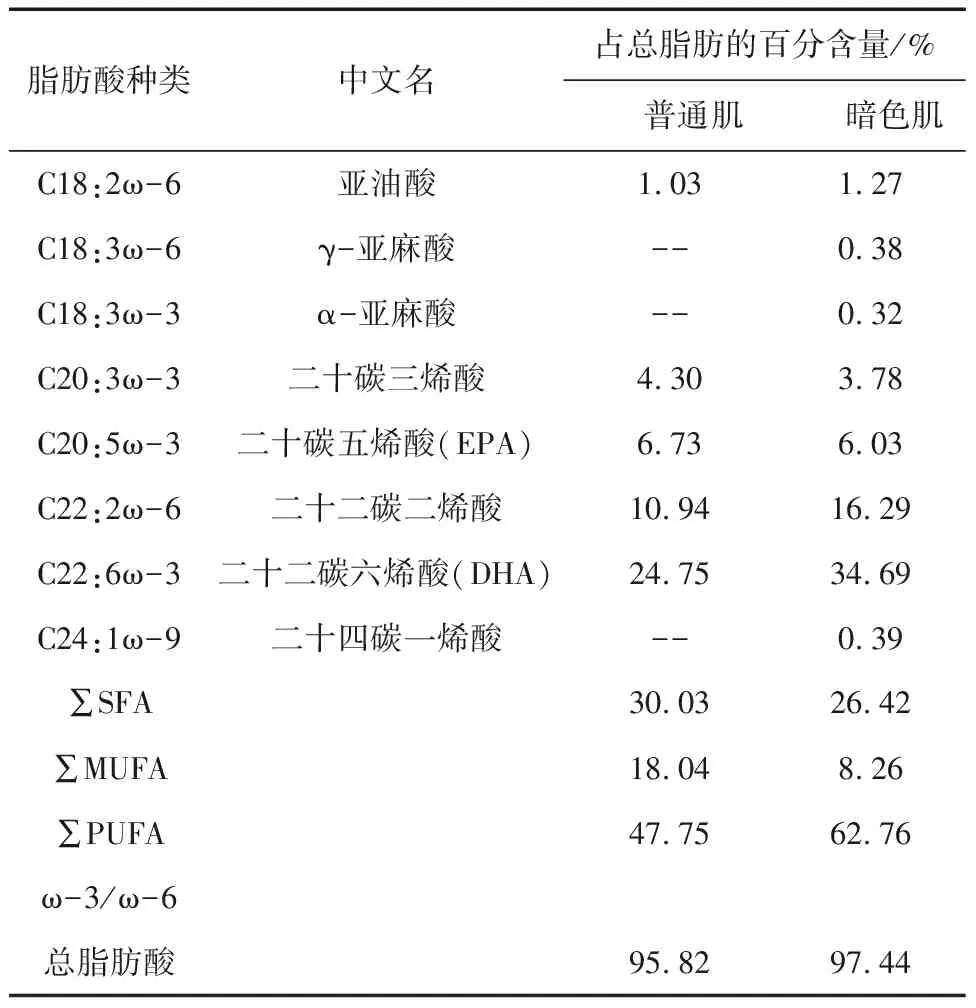
脂肪酸种类中文名占总脂肪的百分含量/%普通肌暗色肌C18:2ω-6亚油酸1.031.27C18:3ω-6γ-亚麻酸--0.38C18:3ω-3α-亚麻酸--0.32C20:3ω-3二十碳三烯酸4.303.78C20:5ω-3二十碳五烯酸(EPA)6.736.03C22:2ω-6二十二碳二烯酸10.9416.29C22:6ω-3二十二碳六烯酸(DHA)24.7534.69C24:1ω-9二十四碳一烯酸--0.39∑SFA30.0326.42∑MUFA18.048.26∑PUFA47.7562.76ω-3/ω-6总脂肪酸95.8297.44
注:--未检出。
肌肉中的饱和脂肪酸(SFA)以C16:0、C18:0为主,单不饱和脂肪酸(MUFA)以C18:1ω-9为主,多不饱和脂肪酸(PUFA)以C20:3ω-3、C22:2ω-6、C20:5ω-3(EPA)和C22:6ω-3(DHA)为主。其中,PUFA的比例较高(在暗色肌和普通肌中的比例分别为62.76%和47.75%),SFA次之,MUFA的比例较低。EPA和DHA为一类营养价值较高的PUFA,两者在暗色肌和普通肌中的比例高达31.48%和40.72%。据报道,一些红肉鱼类(沙丁鱼、金枪鱼、鲭鱼)中的暗色肌脂肪含量明显高于普通肌,且PUFA比例较高[12]。脂肪氧化主要发生在不饱和脂肪酸,故不饱和脂肪酸含量高的肌肉更容易氧化[2]。如正鲣的暗色肌和普通肌中PUFA比例分别为54.62%和56.85%,含量分别为27.89mg/g和12.28mg/g,其在贮藏中暗色肌的氧化程度远高于普通肌[13]。研究[14]发现,脂质氧化不利于肉色的稳定性,脂质氧化程度越高,肉色稳定性越低。
2.2 扁舵鲣鱼肉在贮藏中的挥发性物质的GC-MS分析
脂质氧化过程中会产生一系列初级、次极代谢产物,大多为挥发性物质,故本实验采用顶空固相微萃取联合GC-MS技术来分析扁舵鲣贮藏中的挥发性物质。实验采用了二乙烯基苯/碳分子筛/聚二甲基硅氧烷复合涂层(DVB/CAR/PDMS)的微萃取头,相比于单物质和双物质涂层,其萃取的物质分子量范围更加宽广,且对极性、中等级性和非极性物质均有较好的萃取效果[15]。扁舵鲣在4℃贮藏期间鱼肉中一些挥发性物质百分含量的变化如表2所示。表中列出了36种相对含量较高的物质,主要包括醇类、醛类、酮类、杂环类及其他物质。

表2 扁舵鲣在4℃贮藏中暗色肌和普通肌挥发性物质分析表
续表2

挥发性物质不同贮藏时间下挥发性物质的百分含量暗色肌普通肌01369120136912十一碳醛------------1.391.471.330.450.41N肉豆蔻醛------------0.720.90.670.710.560.45醇类9.4412.317.223.919.325.76.118.7211.426.934.840.61-戊烯-3-醇0.50.561.35.052.335.000.420.761.483.493.313.41戊醇0.500.200.280.610.340.35------------2-戊烯-1-醇0.310.280.592.061.130.64--0.320.671.220.941.69己醇0.560.630.650.540.440.950.150.210.260.90.410.47庚醇------------0.270.40.351.760.910.81-辛烯-3-醇2.844.235.346.957.779.302.453.084.4313.820.323.12-乙基己醇0.400.611.972.180.720.790.271.210.540.761.441.28辛醇0.681.161.081.10.91.380.9410.811.110.80.742-辛烯-1-醇0.740.990.830.650.691.30.50.470.570.661.952.182,7-辛二烯-1-醇2.12.883.223.954.094.321.111.272.283.284.746.96壬醇0.810.771.930.840.911.7------------酮类4.058.77.615.425.16.686.916.398.8910.110.812.12,3-戊二酮N0.420.570.490.260.170.3N0.540.620.410.333-己烯-5-酮------------1.510.770.780.850.390.452,3-辛二酮2.636.584.792.441.911.861.561.471.93.342.252.122-壬酮1.161.321.81.721.972.711.111.272.283.284.746.963,5-辛二烯-2-酮0.260.380.450.770.961.940.40.91.421.552.161.932-十一烷酮------------2.031.981.970.430.810.3杂环类及其他11.214.413.321.42122.74.857.0710.213.914.415.22-乙基呋喃2.033.843.873.822.631.782.232.472.723.041.921.782-正戊基呋喃3.984.544.549.69.4312.52.063.174.567.779.019.41戊烯基呋喃1.42.42.43.13.74.230.561.432.963.13.453.96辛酸21.361.323.091.841.41------------2-十一烷1.772.211.141.753.432.79------------总44.871.555.569.463.867.869.366.671.771.881.178.7
醛类主要包括饱和醛类,如己醛、庚醛、辛醛、壬醛、葵醛、十一碳醛和肉豆蔻醛;不饱和醛类,如2-戊烯醛,苯甲醛,对甲基苯乙醛。另外,在普通肌检出苯乙醛和2-乙基苯甲醛;在暗色肉中检出(E,E)-2,4-庚二烯醛(普通肉中未检出),这与全晶晶等对正鲣的研究结果相同[16]。醛类物质是脂质氧化产生一类重要的次级代谢产物,可通过测定其含量来评价各类食物脂质氧化程度[17]。己醛是脂肪氧化产物中主要的醛类物质,它主要是亚油酸的代谢产物[17],研究[18]表明在贮藏前期其含量增加速度显著高于其它醛类,贮藏后期则显著下降,这可能是由于己醛与肌肉中的其他物质发生反应,或者转变为己酸。磷脂氧化后也能产生一些不饱和醛类和酮醛类物质[19]。
醇类物质主要是脂肪氧化中二级氢过氧化物的分解产物,或者由糖基化合物还原生成[19]。检测出的醇类物质包括饱和醇类和不饱和醇类物质,饱和醇类为C5~C9的直链醇。醇类中相对含量较高的为烯醇类物质,如1-辛烯-3-醇和2,7-辛二烯-1-醇。扁舵鲣肌肉的挥发性醇类中含有较多的八碳醇,八碳的醇类物质广泛存在于所有鱼类的挥发性物质中。
酮类物质中相对含量较高有2,3-辛二酮、2-壬酮,酮类物质主要来自于硬脂酸的分解[19]。杂环类物质中相对含量较多为呋喃类物质,如2-乙基呋喃、2-正戊基呋喃。肉类中的杂环类物质主要由多不饱和脂肪氧化产生,如ω-3系(亚麻酸)、ω-5系(EPA)和ω-6(DHA)系多不饱和脂肪酸[20],呋喃类物质也可由碳水化合物在脱水和加热情况下形成。
从表2中可知,暗色肌和普通肌中各种类物质的百分含量表现出较明显的变化趋势。在贮藏中,醛类、酮类物质的百分含量逐渐减少,且醛类物质下降比较明显;醇类、杂环类及其他物质逐渐增加,且醇类物质增加较明显。暗色肌中这些物质的百分含量总量较普通肌少,这是由于暗色肌中的成分较复杂,在贮藏中生成了较多其他种类的挥发性成分。另外,表中所列物质相对含量的变化并不能代表其实际含量的变化趋势,比如肉类在贮藏中醛类及大部分挥发性物质的含量是逐渐增加的。
2.3 几种氧化产物对肌红蛋白氧化的影响
较多研究证明脂质氧化的次级代谢产物具有促进Mb氧化的作用,此外,不同代谢产物对不同来源的Mb的影响有所差异[21]。根据扁舵鲣在贮藏中的挥发性物质的GC-MS分析结果,在以往的研究基础上扩大氧化产物种类,选取了醛类、醇类、酮类和杂环类等七种物质(己醛、壬醛、苯甲醛、(E,E)-2,4-庚二烯醛、1-辛烯-3-醇、2-壬酮和2-乙基呋喃)来分析其对Mb氧化的影响。研究表明[22]金枪鱼等红肉鱼类死后一段时间内肌肉呈弱酸性,pH值最低可降到5.0~6.0,故选择pH5.7和7.0的条件来研究各种物质对Mb的影响。

表3 2℃,pH7.0条件下各物质对OxyMb B带(nm)的影响
肌红蛋白中血红素是含铁的卟啉化合物,在紫外可见区域具有特征吸收:在420nm附近的强吸收峰称为B带,500~750nm范围中的若干个特征吸收峰称为Q带。不同pH值下OxyMb的B带变化如表3、表4所示,在450~750nm范围内的吸收光谱如图1、图2所示。
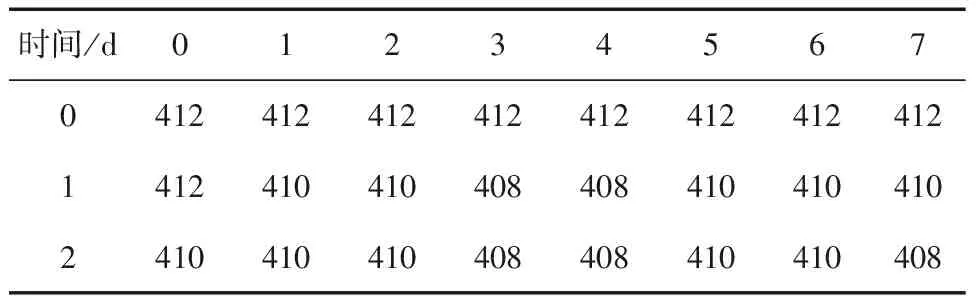
表4 2℃,pH5.7条件下各物质对OxyMb B带(nm)的影响Table 4 Changes in B band of OxyMb added with different substances in 2 oC and pH 5.7 storage
从表3、表4中看,两种pH值的Mb溶液初始B带分别为416nm和412nm,相较于中性环境,pH5.7条件下Mb的B带发生了蓝移。在贮藏中,两组Mb的B带也都发生了不同程度的蓝移。据报道,抹香鲸Mb发生氧化时,其B带从418nm移到409nm[23]。pH7.0条件下,8组Mb的B带均从416nm移到408nm,其中第4组((E,E)-2,4-庚二烯醛)的B带蓝移较快,第7组(2-乙基呋喃)次之,对照组和第5、6组(1-辛烯-3-醇、2-壬酮)无明显差别。pH5.7条件下,8组Mb的B带从416nm移到410nm或408nm,其中,第3、4组(苯甲醛、(E,E)-2,4-庚二烯醛)的B带蓝移较快,第7组次之,对照组最慢。
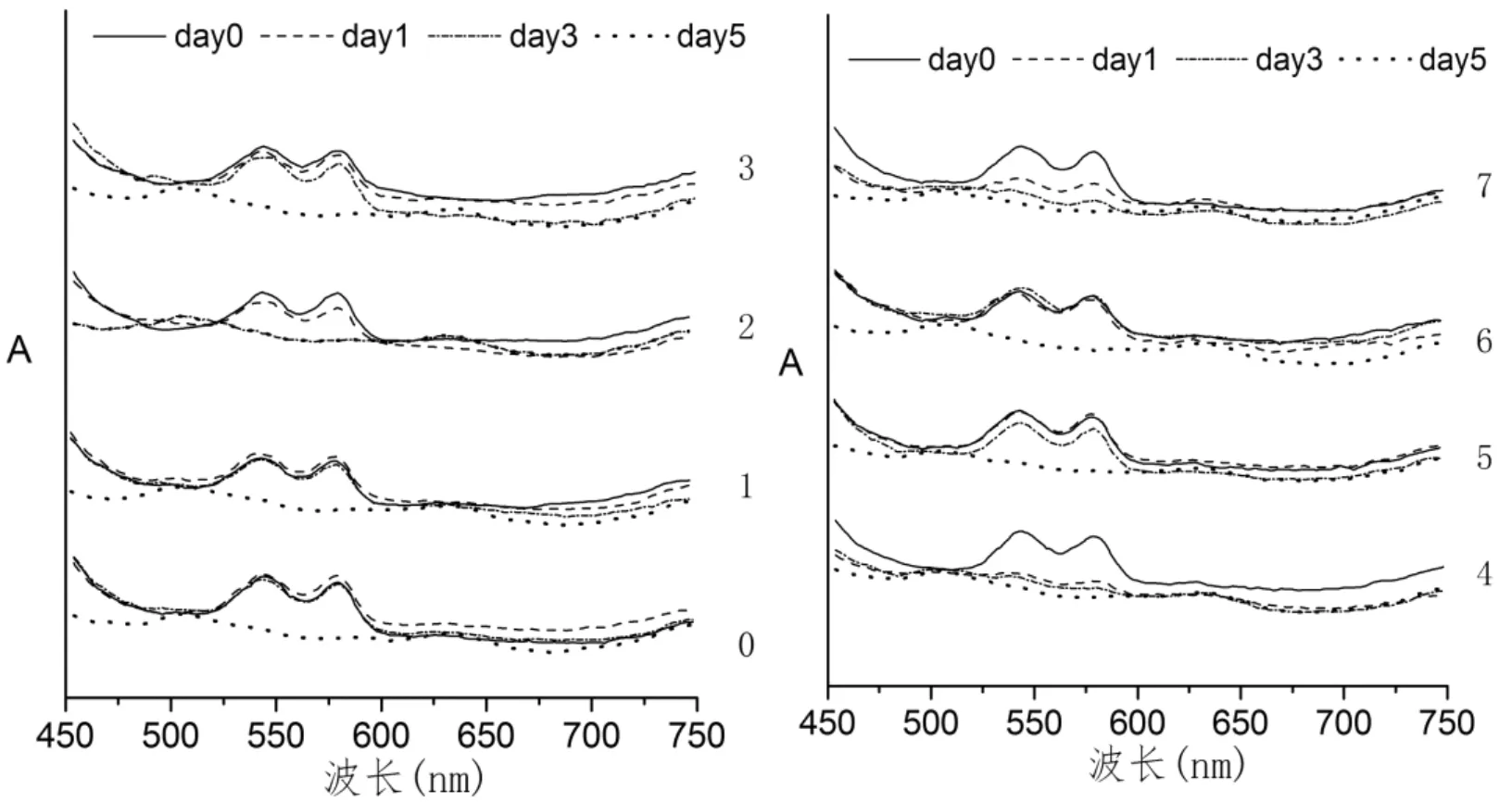
图1 2℃,pH 7.0条件下各物质对OxyMb吸收光谱的影响Fig.1 Changes in absorption spectra of OxyMb added with different substances in 2 oC and pH 7.0 storage.

图2 2℃,pH 5.7条件下各物质对OxyMb吸收光谱的影响Fig. 2 Changes in absorption spectra of OxyMb added with different substances in 2 oC and pH 5.7 storage.

图3 不同pH条件下各物质对MetMb%增量(%)的影响Fig. 3 Changes in the increment of MetMb% with different substances at pH 7.0 and 5.7
从图1看,Mb分别在540nm和575nm左右处有特征吸收峰,这与一些鱼类的Mb较为相似[24]。第1天,第4组的Q带就基本消失,第7组的Q带出现了明显的衰退,并在随后的时间内逐渐消失。其他几组在0~3d中,Q带较为明显,第5天基本都消失。pH5.7条件下,各组Mb的Q带都较为明显,随后均出现不同程度的衰退现象。其中第3、4、7组的Q带在第1天就基本消失。
研究表明[7],在一定pH范围内,B带会随着pH值的减小而向低波长移动。OxyMb转变为MetMb的过程中,B带也会发生蓝移,且Q带逐渐消失,转而出现MetMb的特征吸收峰。在pH5.7时,各组Mb溶液的特征吸收峰比pH7.0组衰退的更为快速和明显。
从图3看,各实验组与对照组相比,MetMb%的含量都有所增加,说明各氧化产物均有一定的促Mb氧化作用。其中,促Mb氧化作用较大的为(E,E)-2,4-庚二烯醛、2-乙基呋喃和苯甲醛,其在pH5.7时的增量分别为14.72%、12.33%和9.93%。pH5.7时,各组(除第5组,1-辛烯-3-醇)MetMb%的增量(%)比pH7.0条件下的有所增加,其中第2,3,4,7组增加显著(P<0.05),说明降低pH值各氧化产物的促Mb氧化作用增大。
综上所述,各氧化产物对OxyMb的影响为醛类>呋喃类>酮类>醇类,醛类中不饱和醛的促氧化作用大于饱和醛((E,E)-2,4-庚二烯醛>苯甲醛>壬醛>己醛)。且各物质在低pH值条件下更能促进Mb氧化。从挥发性物质分析结果看,贮藏中,醇类物质相对含量较高,但其对Mb的影响较小,而不饱和醛的相对含量较低,其对Mb有较大的促氧化作用。
O'Grady(2010)[25]等利用牛肌肉匀浆模型研究脂质和肌红蛋白氧化的结论指出脂质氧化先于Mb氧化,并且在脂质氧化产物中,主要是初级代谢产物促进了OxyMb氧化,而不是次级代谢产物。Grimsrud等指出脂质次级代谢产物如醛、酮类物质,可与Mb共价结合形成加合物,从而促进OxyMb的氧化[26]。也有研究指出不饱和醛通过影响酶来影响Mb的氧化还原稳定性,并且增加了MetMb的过氧化活性[12]。Lynch(2001)等[27]报道牛肉在4℃贮藏中脂质氧化代谢产物主要为小分子醛类物质,它们比自由基更加稳定并且容易分散在细胞中,故更容易对一些生物成分产生影响。Yaowapa[9]和Lynch[28]等研究指出不饱和醛类物质促OxyMb氧化能力大于同碳链长度的饱和醛,并且它们的促氧化作用随着碳链的增加而增加(从六碳到九碳),这与本实验结果相符。其中苯甲醛中的苯环具有一定的不饱和度,故其对Mb影响大于壬醛和己醛。Naveena的研究[29]指出,降低pH值,HNE对火鸡Mb的促氧化作用降低。而Yin等在HNE对羊Mb影响的研究中发现,降低pH值,HNE的促Mb氧化作用增加[3]。此外,相关研究指出HNE对不同来源Mb的影响有所差异,醛类介导的Mb氧化程度和Mb种类有关[2]。这种脂肪氧化对Mb稳定性存在种类间的差异现象可能是由于氨基酸排列和脂肪酸种类不同造成的[30]。
3 总结
通过GC分析扁舵鲣脂肪酸组成,并利用顶空萃取联合GC-MS技术分析贮藏过程中鱼肉挥发性物质的相对含量及其变化趋势,并从中挑选7种氧化产物研究其对Mb的影响。扁舵鲣鱼肉中的不饱和脂肪酸比例较高,表明其脂质更易氧化。鱼肉的挥发性物质主要为醛、醇、酮、杂环类物质,其中醛类和醇类为主要成分。各氧化产物中对OxyMb促氧化作用较大的为不饱和醛类(((E,E)-2,4-庚二烯醛、苯甲醛)和呋喃类(2-乙基呋喃),且各物质在低pH值条件下的促氧化作用更大。
