肌萎缩侧索硬化患者血清氧化应激标志物与神经功能、肌电图特征、脑脊液神经标志物的相关性
2019-07-23周光宁林铃芳陈霞陆国云徐燕金
周光宁,林铃芳,陈霞,陆国云,徐燕金
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是一类以运动神经元选择性损害为特征的进行性神经系统变性疾病,主要侵犯脊髓前角及皮质椎体的细胞、脑干后组的运动神经元、椎体束等部位。ALS的起病隐匿且进展迅速,患者出现不同部位肌肉无力萎缩、最终因呼吸肌受累而死亡。流行病学资料显示,ALS患者生存时间为3~5年[1-2]。近年来发现氧化应激与多种神经退行性疾病有关,为了明确氧化应激在ALS中所起的作用,现分析ALS患者血清氧化应激标志物与神经功能、肌电图特征、脑脊液神经标志物的相关性,报道如下。
1 资料与方法
1.1 临床资料 选择2014年2月—2018年6月福建省宁德市医院神经内科确诊为ALS患者36例作为ALS组,其中男22例,女14例,年龄28~48(34.41±6.23)岁;病程5~19(7.65±0.93)月;合并高血压7例,糖尿病2例,血脂异常5例。取同期在医院接受腰硬联合阻滞下腹腔手术且无脊髓肌肉损伤的患者50例作为对照组,其中男29例,女 21例,年龄26~45(33.84±6.51)岁;合并高血压17例,糖尿病8例,血脂异常14例。2组性别、年龄、合并症等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会批准,全部受试者知情同意并签署知情同意书。
1.2 选择标准 (1)入选标准:①符合中华医学会神经病学分会肌电图与临床神经电生理学组、中华医学会神经病学分会神经肌肉病学组制定的ALS诊断标准[3];②接受肌电图及脑脊液检查;③临床资料完整。(2)排除标准:①合并脊髓压迫、多灶性运动神经病、进行性脊肌萎缩症的患者;②既往有脑肿瘤、脑外伤、脑卒中等病史的患者。
1.3 观察指标与方法
1.3.1 氧化应激标志物测定: 采集2组患者的空腹肘静脉血3 ml,离心分离血清,采用酶联免疫吸附法(ELISA)测定8-羟基脱氧鸟苷酸(8-OhdG)含量,硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量,黄嘌呤氧化酶法测定谷胱甘肽过氧化物酶(GPX)、超氧化物歧化酶(SOD)含量。
1.3.2 神经功能评价: 采用改良肌萎缩侧索硬化功能评分(ALSFRS-r)评价ALS组患者的神经功能,通过延髓功能、颈膨大支配的上肢运动功能、腰膨大支配的下肢运动功能、胸髓支配的呼吸功能进行评价,每种功能均包含3个项目、每个项目得分0~4分,总分48分,得分越低,神经损害越严重。
1.3.3 肌电图检测: 采用上海海神医疗电子仪器有限公司生产的NDI-092型肌电图诱发电位仪对双侧正中神经、尺神经、腓总神经、胫神经的复合肌肉动作电位(CMAP)进行测定,CMAP波幅的定义为从基线至负向波峰的波幅。通过测定CMAP波幅能够反映肌肉中有功能运动单位的数目。
1.3.4 脑脊液神经标志物测定: 2组患者腰穿采集脑脊液,采用ELISA法测定髓鞘碱性蛋白(MBP)、Tau蛋白(Tau)、磷酸化神经丝蛋白重链(pNfH)的含量。其能反映神经元及血脑屏障的损害程度[4-5]。
2 结 果
2.1 2组患者血清氧化应激标志物比较 与对照组比较,ALS组患者的血清8-OhdG、MDA含量均升高,GPX、SOD含量均降低,差异有统计学意义(P<0.01),见表1。
2.2 ALS组ALSFRS-r评分 ALS组患者延髓功能、上肢运动功能、下肢运动功能、呼吸功能的ALSFRS-r评分分别为(5.41±0.74)、(6.28±0.93)、(4.89±0.72)、(8.71±1.15)分。
2.3 2组患者肌电图参数比较 与对照组比较,ALS组患者正中神经、尺神经、腓总神经、胫神经的CMAP水平均明显降低(P<0.01),见表2。
2.4 2组患者脑脊液神经标志物比较 与对照组比较,ALS组患者脑脊液中MBP、Tau、pNfH的含量均明显升高,差异有统计学意义(P<0.01),见表3。
2.5 相关性分析 ALS组患者血清8-OhdG、MDA含量与ALSFRS-r评分、CMAP水平均呈负相关,与脑脊液MBP、Tau、pNfH含量呈正相关(P<0.05);血清GPX、SOD含量与ALSFRS-r评分、CMAP水平均呈正相关,与脑脊液MBP、Tau、pNfH含量均呈负相关(P<0.05),见表4。

表3 2组患者脑脊液神经标志物的比较
3 讨 论
ALS是以上运动神经元和下运动神经元同时受损为特征的进行性加重的神经系统变性疾病,患者生存时间短,但具体机制仍未阐明。氧化应激反应是近年来发现的与多种神经退行性疾病具有密切关系的病理环节,阿尔茨海默病、帕金森病患者体内的氧化应激反应均呈过度激活的状态[6-7]。在氧化应激过度激活的过程中,具有强氧化特性的氧自由基及氮自由基均大量生成,作用于神经元的蛋白质、脂质、核酸等,使相应的物质丧失正常的结构,进而影响神经元的功能并逐步发生损伤、变性、坏死。在不同的神经退行性疾病中,氧化应激所累及的部位存在差异,阿尔茨海默病患者主要表现为大脑皮质的记忆神经元受损,帕金森病患者主要表现为中脑黑质多巴胺能神经元的受损,ALS患者则同时累及上下运动神经元及锥体束[8-9]。

表1 2组患者血清氧化应激标志物比较

表2 2组患者肌电图参数比较
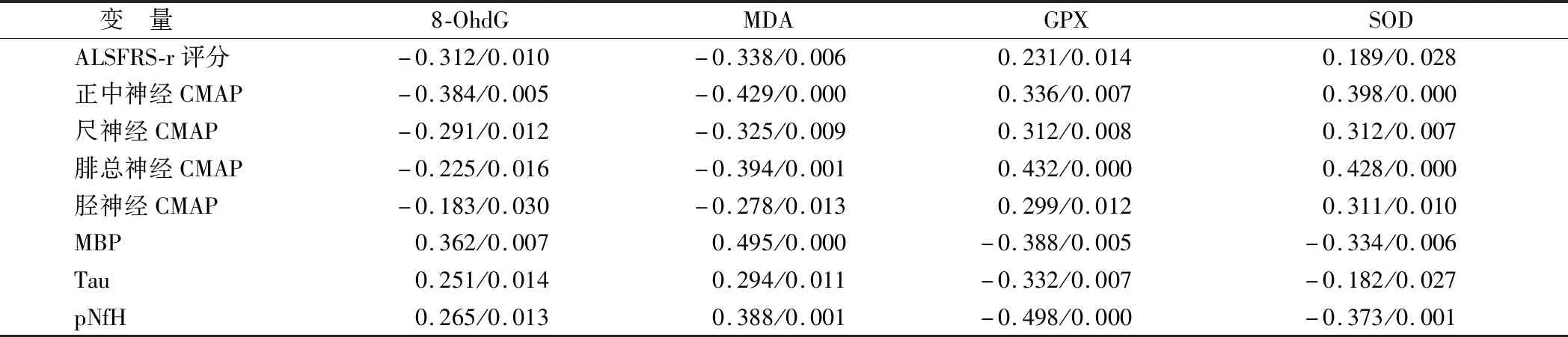
表4 血清氧化应激标志物与其他指标相关性 (r/P值)
常庚等[10]关于ALS患者体内氧化应激反应的研究发现,ALD患者血清中多种氧化产物生成增多,而具有抗氧化功能的代谢酶明显减少。核酸中的鸟嘌呤与自由基发生氧化反应后生成8-OhdG,脂质与自由基发生氧化反应后生成MDA,两者是反映氧化应激程度的氧化产物;GPX、SOD是催化还原反应的抗氧化酶,能够清除自由基并减轻氧化应激程度。本研究中ALS组患者的血清8-OhdG、MDA含量与对照组比较均明显升高,GPX、SOD含量与对照组比较均明显降低,与上述研究一致。这一结果表明在ALS病程中,体内具有氧化功能的自由基生成增多并引起相应氧化产物8-OhdG、MDA生成增多,同时具有抗氧化功能的GPX、SOD生成不足、消耗增多,提示氧化应激的过度激活是造成ALS发生的重要病理环节。
在ALS患者运动神经元发生损害的过程中,所支配的肌肉出现无力、萎缩、肌束颤动等运动神经元损害症状,本研究通过ALSFRS-r评分来反映神经功能受损的程度及其与氧化应激的关系,ALS患者的血清8-OhdG、MDA含量与ALSFRS-r评分均呈负相关,血清GPX、SOD含量与ALSFRS-r评分均呈正相关。这一结果表明ALS患者体内氧化产物的增多、抗氧化酶的减少与ALSFRS-r评分的降低有关,ALSFRS-r评分越低、神经功能受损越严重,进而也提示氧化应激反应的激活能够加重ALS患者神经功能的损害。肌电图是评价运动神经元损伤的重要方式,表现为所支配肌肉CMAP水平的下降[11-12],本研究结果也证实,ALS组患者正中神经、尺神经、腓总神经、胫神经的CMAP水平均明显降低且与血清8-OhdG、MDA含量呈负相关,与血清GPX、SOD含量呈正相关。由此进一步证实氧化应激反应的激活能够加重ALS患者运动神经元的损害。
神经损伤的过程不仅会引起所支配区域功能及电生理特征的改变,同时还会引起脑脊液中相应神经标志物的变化[13-14]。MBP、Tau、pNfH等神经元和神经胶质内的分子已经被证实在ALS患者的脑脊液中明显增多[15-17],提示ALS患者的神经元细胞和胶质细胞均发生了损伤。本研究也发现,ALS组患者脑脊液中MBP、Tau、pNfH的含量与对照组比较均明显升高。在此基础上进一步分析氧化应激反应与脑脊液中神经标志物变化的关系可知,ALS患者的血清8-OhdG、MDA含量与脑脊液MBP、Tau、pNfH含量呈正相关,血清GPX、SOD含量与脑脊液MBP、Tau、pNfH含量均呈负相关,由此表明氧化应激反应的激活能够加重ALS患者神经元和神经胶质细胞的损伤。
综上所述,ALS患者体内氧化应激的过度激活与神经功能及肌电图特征性损害、脑脊液神经标志物增多有关,血清氧化应激标志物的测定能够用于病情评估。
利益冲突:无
作者贡献声明
周光宁:研究设计、论文撰写;林铃芳:论文修改,审核;陈霞:量表评价;陆国云、徐燕金:数据收集和统计
